
Asa cum s-a aratat, marea majoritate a produselor agroalimentare contin ca substanta esentiala apa, in care sunt dispersate celelalte componente. Structura si proprietatile fizico-chimice ale produsului depind de natura componentelor dispersate in apa si de gradul lor de dispersie.
 Efectele pe care le au
temperaturile scazute asupra produselor agroalimentare depind de
cantitatea de apa din produs, de modul de legare a acesteia si in mod
hotarator, de starea celulelor. De aceea, in continuare, in acest paragraf
se va analiza cazul sistemelor necelulare sau partial necelulare,
respectiv efectele frigului asupra solutiilor adevarate asupra
sistemelor coloidale, asupra emulsiilor si asupra spumelor.
Efectele pe care le au
temperaturile scazute asupra produselor agroalimentare depind de
cantitatea de apa din produs, de modul de legare a acesteia si in mod
hotarator, de starea celulelor. De aceea, in continuare, in acest paragraf
se va analiza cazul sistemelor necelulare sau partial necelulare,
respectiv efectele frigului asupra solutiilor adevarate asupra
sistemelor coloidale, asupra emulsiilor si asupra spumelor.
Cazurile sistemelor celulare pentru produsele de origine vegetala si respectiv de origine animala, vor fi tratate la ulterior.
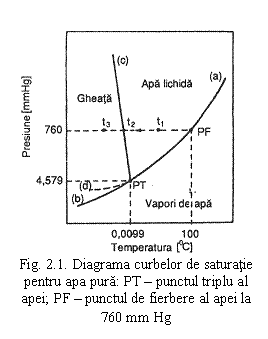
Pentru apa pura, la diferite presiuni, variatia temperaturii poate conduce la schimbari de faza in conformitate cu diagrama curbelor de saturatie redata in fig. 2.1. Curbele de saturatie reprezinta conditiile de temperatura si presiune la care coexista doua faze in echilibru termodinamic: curba vapori-lichid, a-PT; curba lichid-solid, PT-c; curba vapori-solid, PT-b si curba limita a starilor metastabile de apa subracita si vapori subraciti, PT-d. Punctul PT de intersectie a curbelor de saturatie reprezinta conditiile de temperatura si presiune la care coexista cele trei faze in echilibru termodinamic si se numeste punctul triplu al apei.
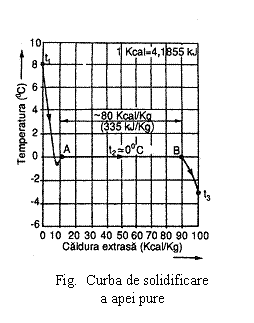
Daca se considera,
la presiunea atmosferica de exemplu, temperatura initiala a apei
in faza lichida, ![]() atunci daca apei i
se extrage caldura, temperatura sa va scadea, iar la atingerea
temperaturii
atunci daca apei i
se extrage caldura, temperatura sa va scadea, iar la atingerea
temperaturii ![]() , numita punct de congelare, corespunzatoare curbei
de saturatie lichid-solid, se va produce transformarea de faza, apa
transformandu-se in gheata, absorbind pentru aceasta caldura
latenta egala cu cca 80 kcal/kg, adica 335 kJ/ kg (fig. ).
Racirea in continuare va conduce la scaderea temperaturii
ghetii. Pe portiunea
, numita punct de congelare, corespunzatoare curbei
de saturatie lichid-solid, se va produce transformarea de faza, apa
transformandu-se in gheata, absorbind pentru aceasta caldura
latenta egala cu cca 80 kcal/kg, adica 335 kJ/ kg (fig. ).
Racirea in continuare va conduce la scaderea temperaturii
ghetii. Pe portiunea ![]() temperatura apei scade
cu circa 1°C la fiecare 1 kcal/kg (4,186 kJ/kg) de caldura
extrasa, iar pe portiunea
temperatura apei scade
cu circa 1°C la fiecare 1 kcal/kg (4,186 kJ/kg) de caldura
extrasa, iar pe portiunea ![]() temperatura
ghetii scade cu circa 0,5°C la fiecare 1 kcal/kg (4,186 kJ/kg) de
caldura extrasa.
temperatura
ghetii scade cu circa 0,5°C la fiecare 1 kcal/kg (4,186 kJ/kg) de
caldura extrasa.
Echilibrul fazelor in cazul unei solutii apoase cu mai multi componenti este net diferit si mult mai complex decat cel corespunzator apei pure. Reprezentarea grafica in plan a curbelor de saturatie este posibila doar in cazul solutiilor bicomponente asa cum se poate observa, de exemplu, in diagrama din fig. 2.3.
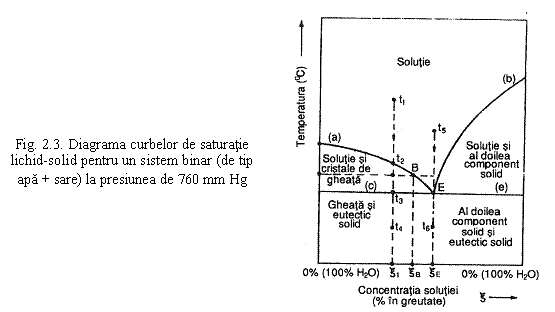
Diagrama cuprinde: curba a - E, de echilibru bifazic intre solutie si starea solida a primului component (apa) care se afla in exces (in orice punct al acestei curbe, solutia este saturata si se afla in punctul ei de congelare); curba E-b, de echilibru bifazic intre solutie si starea solida a celui de al doilea component care se afla in exces (in orice punct al acestei curbe, solutia este saturata si se afla la punctul ei de congelare). Punctul E de intersectie al celor doua curbe, numit punct eutectic sau punct criohidratic reprezinta concentratia si temperatura la care solutia poate exista in echilibru termodinamic cu starile solide ale celor doua componente.
Se observa ca,
pentru o concentratie oarecare a solutiei, exista un singur punct
de congelare. Pentru o alta concentratie exista un alt punct de
congelare. Sa consideram procesul de racire al unei solutii
de concentratie ![]() mai
mica decat cea eutectica, de la o temperatura initiala
mai
mica decat cea eutectica, de la o temperatura initiala
![]() , superioara punctului de congelare
, superioara punctului de congelare ![]() pana la o
temperatura finala
pana la o
temperatura finala ![]() inferioara
temperaturii eutectice
inferioara
temperaturii eutectice ![]() La racirea solutiei de la
La racirea solutiei de la
![]() spre
spre ![]() concentratia
ramane neschimbata. La atingerea temperaturii
concentratia
ramane neschimbata. La atingerea temperaturii ![]() adica
a punctului de solidificare, din solutie se formeaza cristale de
gheata care degaja caldura latenta de solidificare
(circa 80 kJ/kg adica 335 kcal/kg). Prin separarea cristalelor de
gheata, concentratia solutiei creste. Pentru o
temperatura oarecare
adica
a punctului de solidificare, din solutie se formeaza cristale de
gheata care degaja caldura latenta de solidificare
(circa 80 kJ/kg adica 335 kcal/kg). Prin separarea cristalelor de
gheata, concentratia solutiei creste. Pentru o
temperatura oarecare ![]() cuprinsa intre
temperaturile
cuprinsa intre
temperaturile ![]() si
si ![]() sistemul binar se
afla in stare de echilibru termodinamic (intre cristalele de
gheata cu
sistemul binar se
afla in stare de echilibru termodinamic (intre cristalele de
gheata cu ![]() si solutia
si solutia ![]() ). Prin regula parghiei, se poate determina cantitatea de
cristale de gheata si respectiv cantitatea de solutie de
concentratie
). Prin regula parghiei, se poate determina cantitatea de
cristale de gheata si respectiv cantitatea de solutie de
concentratie ![]() Amestecul de cristale de
gheata - solutie are in ansamblu, concentratia
initiala
Amestecul de cristale de
gheata - solutie are in ansamblu, concentratia
initiala ![]() Continuand
racirea sub punctul A, continua formarea de cristale de
gheata si concomitent cresterea concentratiei
solutiei cu care aceastea sunt permanent in echilibru. La atingerea temperaturii
Continuand
racirea sub punctul A, continua formarea de cristale de
gheata si concomitent cresterea concentratiei
solutiei cu care aceastea sunt permanent in echilibru. La atingerea temperaturii
![]() solutia atinge
concentratia eutectica si racirea in continuare conduce la
formarea de eutectic solid, dupa care amestecul solid format din cristale
de gheata si eutectic solid isi scade temperatura prin
cedare de caldura sensibila. Fenomenele se produc similar
si in cazul racirii unei solutii de concentratie mai mare
decat cea eutectica, faza care se separa din solutie la
atingerea temperaturii de congelare fiind insa cristalele substantei
dizolvate.
solutia atinge
concentratia eutectica si racirea in continuare conduce la
formarea de eutectic solid, dupa care amestecul solid format din cristale
de gheata si eutectic solid isi scade temperatura prin
cedare de caldura sensibila. Fenomenele se produc similar
si in cazul racirii unei solutii de concentratie mai mare
decat cea eutectica, faza care se separa din solutie la
atingerea temperaturii de congelare fiind insa cristalele substantei
dizolvate.
In cazul racirii solutiei de concentratie eutectica, fenomenele se produc similar cu cele de la racirea unei substante pure (fig. ).
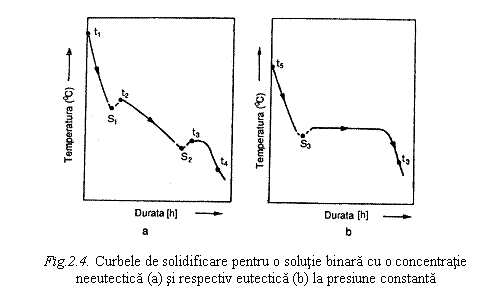
La racirea solutiilor, in afara fenomenelor discutate mai sus, se pot produce in anumite conditii, unele fenomene care vor fi tratate succint in continuare si anume: subracirea, suprasaturatia, vitrifierea si recristalizarea.
Subracirea solutiei consta in atingerea unor
temperaturi inferioare punctului de solidificare fara ca sa se
produca formare de faza solida (punctul ![]() din fig. 2.4. a,
pentru solutii de concentratii neeutectice si respectiv punctul
din fig. 2.4. a,
pentru solutii de concentratii neeutectice si respectiv punctul ![]() din fig. 2.4. b,
pentru solutii eutectice).
din fig. 2.4. b,
pentru solutii eutectice).
Starea de subracire
(denumita uneori si supraracire) este insa labila
si amorsarea formarii de cristale (la atingerea unor temperaturi
minime limita, la agitarea solutiei sau la adaugarea unei
impuritati in solutie) se poate produce rapid cu crestere
de temperatura pana la punctul de solidificare ![]()
Suprasaturatia solutiei consta in atingerea unor
temperaturi inferioare punctului de solidificare a solutiilor cu
concentratii mai mari decat concentratia eutectica,
fara ca sa se produca cristale ale substantei
dizolvate (punctul ![]() din fig. 2.4.). Starea
de saturatie este labila.
din fig. 2.4.). Starea
de saturatie este labila.
Vitrifierea consta in solidificarea fara formare de cristale. Faza solida formata este in stare amorfa. Pentru producerea vitrifierii sunt necesare viteze foarte mari de racire si temperaturi foarte scazute. Pentru a se evita trecerea starii amorfe in stare cristalina sunt necesare temperaturi foarte scazute de depozitare (sub -130°C), iar decongelarea trebuie facuta cu viteze foarte mari pentru a se evita trecerea prin faza cristalizata.
Recristalizarea consta in transformarea cristalelor de mici dimensiuni (care se obtin la congelarea rapida a solutiilor) in cristale mai mari. Recristalizarea determina o structura grosiera si modifica transparenta.
Asa cum s-a aratat, produsele agroalimentare ca sisteme complexe, cuprind o faza continua de solutii apoase (care pot fi considerate din anumite puncte de vedere solutii adevarate) si o faza dispersata care poate contine dispersii coloidale sau grosiere. Prezenta coloizilor sau a substantelor dispersate grosier nu influenteaza practic prin natura lor proprietatile coligative ale solutiilor adevarate cum ar fi punctul de congelare, punctul de fierbere, presiunea partiala de vapori, presiunea osmotica, coeficientul de dispersie s.a. Proprietatile coligative depind de numarul particolelor dispersate si nu de natura lor. Sistemele coloidale din alimente pot fi hidrosoluri sau hidrogeluri.
Hidrosolurile sunt fluide si difera de solutiile adevarate prin particolele de mari dimensiuni si prin vascozitati ridicate.
Hidrogelurile sunt sisteme bifazice care cuprind o retea continua de material solid la interfata careia este dispersata fin o faza lichida.
Intre cele doua tipuri distincte de sisteme coloidale exista sisteme coloidale intermediare sau mixte.
Racirea alimentelor care cuprind sisteme coloidale poate determina o serie intreaga de modificari, destabilizari si denaturari.
In produsele alimentare de origine animala, datorita capacitatii relativ ridicate de legare a apei, cele mai multe proteine sunt capabile de a forma hidrosoluri si hidrogeluri. In cazul produselor de origine vegetala, continutul celulelor se comporta partial ca hidrosol si partial ca hidrogel.
Racirea pana la limita de congelare creste in general capacitatea de legare a apei in raport cu proteinele, determinand o intarziere a denaturarii proteinelor. Prin denaturare trebuie inteles un proces sau o secventa a unui proces in care aranjamentul spatial al lantului de polipeptide in cadrul moleculei este modificat de la forma tipica, naturala a proteinei intr-un aranjament dezordonat. Denaturarea proteinelor cuprinde pierderea specificitatii biologice, modificari in forma moleculelor, cresterea reactivitatii, scaderea capacitatii de legare a apei, scaderea solubilitatii si cresterea vascozitatii hidrosolului. Ca rezultat al denaturarii, proteinele devin mai mult sau mai putin hidrofobe.
Daca racirea pana la limita de congelare are ca efect intarzierea denaturarii proteinelor, in schimb congelarea, de regula, poate produce denaturarea. Denaturarea cauzata de congelare este mai accentuata la globuline in raport cu albuminele, iar protidele din tesuturile mamiferelor sunt mult mai stabile decat cele din peste. Denaturarea datorata congelarii propriu-zise se caracterizeaza printr-o separare de apa sub forma de cristale de gheata.
Denaturarea proteinelor este mai mult accentuata in timpul depozitarii in stare congelata, fiind cu atat mai importanta cu cat temperatura de depozitare este mai ridicata si durata depozitarii mai mare. Deoarece intensitatea denaturarii este cu atat mai ridicata cu cat concentratia ionilor de hidrogen este mai mare (pH mai mic) se recomanda congelarea carnii si pestelui in faze biochimice cu pH mai ridicat, adica inainte de faza de rigiditate musculara sau dupa o perioada de maturare. La congelarea fileurilor de peste se pot adauga substante care maresc pH-ul cum ar fi de exemplu polifosfati. Albusul de ou fiert are rezistenta mai mica la denaturare prin congelare in raport cu albusul crud de ou. Produsele culinare congelate care contin o mare cantitate de albus de ou fiert sufera modificari importante ale texturii dupa congelare, depozitare si decongelare. Ca urmare a denaturarii, albusul de ou devine rigid, elastic, granular, apos si prezinta tendinta de a se separa in bucati sau straturi. Pentru a preveni denaturarea produselor culinare care contin albus de ou fiert, este indicata congelarea ultrarapida, de exemplu cu azot lichid, asigurandu-se astfel dupa decongelare o calitate apropiata de cea a produsului necongelat.
Emulsiile pot fi definite ca
sisteme eterogene care contin unul sau mai multe lichide nemiscibile
dispersate in altul sub forma de picaturi fine (cu diametre in general mai
mari decat 0,1 ![]() ). Emulsiile sunt mult mai instabile decat sistemele
coloidale. In alimente, emulsiile sunt de cele mai multe ori formate din
grasimi si apa: laptele (in special laptele cald), smantana,
inghetata, untul, galbenusul de ou, sosurile, supele etc.
). Emulsiile sunt mult mai instabile decat sistemele
coloidale. In alimente, emulsiile sunt de cele mai multe ori formate din
grasimi si apa: laptele (in special laptele cald), smantana,
inghetata, untul, galbenusul de ou, sosurile, supele etc.
Temperaturile scazute pot determina destabilizarea emulsiilor datorita cresterii tensiunii superficiale sau modificarilor produse in membranele de protectie a particulelor dispersate. Destabilizarea emulsiilor se poate produce prin separarea incompleta datorata diferentelor dintre densitatea apei si cea a grasimii, prin 'spargerea' emulsiei si prin inversiunea emulsiei din emulsie de tip grasime in apa in emulsie de tip apa in grasime.
Pentru obtinerea unei emulsii adevarate este necesar un anumit nivel al temperaturii, in functie de felul emulsiei: 814°C pentru unt, 6677°C pentru omogenizarea mixtului de inghetata etc.
Datorita faptului ca racirea creste de cel mai multe ori tensiunea superficiala a lichidelor, emulsiile de tip grasime - apa tind sa se destabilizeze la racirea sub temperatura optima pentru emulsionare. Cresterea vascozitatii ca urmare a scaderii temperaturii tinde sa contracareze efectul destabilizator al racirii.
Congelarea si decongelarea tind sa sparga emulsiile grasime-apa. Cu cat viteza de congelare este mai mica, temperatura de depozitare este mai ridicata si viteza de decongelare este mai mica, cu atat destabilizarea prin spargerea emulsiilor este mai intensa.
Spumele sunt sisteme disperse care contin o faza gazoasa intr-un mediu de dispersie (de cele mai multe ori un lichid). Ele se obtin prin batere, injectare cu gaz sau dizolvare de gaz (frisca, sufleuri, spuma de albus de ou, inghetata s.a.)
Racirea intarzie spumarea si determina un volum mai mic de spuma la baterea albusului de ou datorita cresterii tensiunii superficiale. Dimpotriva, racirea la 78°C sau mai putin favorizeaza spumarea smantanii.
Congelarea determina de regula destabilizarea spumelor din aceleasi motive ca si in cazul emulsiilor. Frisca congelata rezista la congelare si depozitare pana la 3 luni daca in prealabil s-au adaugat zahar si stabilizatori. Acelasi lucru este valabil si pentru inghetata, perioada de depozitare acceptabila fiind mai mare. Smantana congelata folosita la fabricarea de frisca sau inghetata trebuie in prealabil decongelata, omogenizata si amestecata cu smantana proaspata.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |