Principii de tratament Sepsisul neonatal este o boala foarte grava, care necesita un tratament urgent, complex si sustinut, in stare sa inlature infectia si sa corecteze gravele tulburari fiziopatologice. Un asemenea tratament se poate face in mod corespunzator numai intr-un spital, care dispune de un serviciu special de terapie intensiva pentru nou-nascuti (Neonatal Intensive Care Unit - NICU) dotat cu aparatura de reanimare, un laborator de urgenta pentru explorari umorale si un laborator de bacteriologie utilat pentru controlul terapiei cu antibiotice.
Tratamentul etiologic trebuie sa se desfasoare in paralel cu cel patogenic, fara insa a neglija celelalte componente ale tratamentului (igieno-dietetic, simptomatic). Daca starea bolnavului este agravata de complicatiile care insotesc adesea sepsisul, tratamentul acestora va trece pe primul plan.
A. Tratamentul profilactic
Se adreseaza streptococului beta-hemolitic
(GBS) deoarece acesta continua sa fie o cauza majora de
morbiditate si mortalitate la nou-nascuti. Administrarea
intrapartum a antibioticelor se pare ca previne aparitia
imbolnavirilor la nou-nascuti.9 Cateva
strategii preventive bazate pe aceasta observatie au fost dezvoltate
de CDCP (Center for Disease Control
and Prevention), AAP (
Prima strategie recomanda ca toate gravidele aflate in saptamana 35-37 de gestatie sa fie supuse unui test screening constand in culturi pentru depistarea GBS prelevate de la nivelul vaginului si rectului. Chimioprofilaxia intrapartum (Penicilina sau Ampicilina) ar trebui administrata tuturor gravidelor purtatoare de GBS. Daca, din diverse motive, rezultatul culturilor nu sunt cunoscute la momentul nasterii administrarea antibioticelor se face doar in prezenta factorilor de risc.
Cea de-a doua se refera la posibilitatea preventiei sepsisului neonatal cu debut tardiv (nosocomial) la nou nascutii prematuri. Se pare ca administrarea de IgG intravenoasa (cunoscandu-se nivelul scazut al acesteia la prematuri) reduce riscul de infectie nosocomiala si reduce durata spitalizarii.
a) Masurile de igiena obligatorii in cazul unui nou-nascut cu sepsis sunt asigurarea neutralitatii termice, a igienei corporale si a lenjeriei si o manipulare minima pentru diminuarea consumului de oxigen si pentru scaderea transmiterii orizontale.
b) Bilantul hidric este necesar de apreciat zilnic, uneori mai des, in vederea unei terapii volemice corecte. Pornind de la evaluarea intrarilor si iesirilor, se impune monitorizarea diurezei orare. La nou-nascutii cu debit urinar scazut si instabilitate hemodinamica, bilantul hidric se monitorizeaza mai eficient cu ajutorul parametrilor furnizati de cateterul pulmonar. La pacientii cu o stare grava, care necesitasuport ventilator si multe zile de ventilatie mecanica, monitorizarea bilantului hidric pe baza presiunii venoase centrale nu are nici o valoare.
Prematurii cu greutate foarte mica la nastere (care asociaza frecvent sepsis neonatal) vor primi alaturi de laptele de mama, suplimente din formule destinate special acestor varste, pentru a se obtine un ritm de crestere identic cu cel din viata intrauterina (continut mai ridicat in proteine dacat formulele de start 1,8 - 2,4 g/100ml; hidratii de carbon sunt reprezentati de lactoza in proportie de 50% si polimeri de glucoza, iar grasimile sunt reprezentate de trigliceride cu lant mediu in proportie de 50%)7.
Exista numeroase formule pentru prematuri: Alprem (Nestle), Humana-Pre (Humana), Preaptamil cu Milupan (Milupa), Nutrilon Premium (Nutricia), Similac Special Care24 (Abbott-Ross).
Formulele speciale delactozate sunt recomandate nou-nascutului si sugarului care prezinta intoleranta la lactoza, cel mai frecvent secundar unei infectiei digestive (sindrom postenterita).
Exista formule din lapte de vaca si formule din soia, ultimele nefiind recomandate la prematuri si nou-nascuti la termen datorita cantitatii ridicate de fitati (ce predispun la hipofosfatemie), cantitati inadecvate de vitamine pentru aceasta varsta si ritmului de crestere inadecvat.7 Formulele din lapte de vaca au ca sursa de proteine laptele de vaca modificat, glucidele sunt reprezentate de polimeri de glucoza, detrinmaltoza si amidon, lactoza lipseste iar lipidele au, fie sursa vegetala exclusiva (soia, nuca de cocos, ulei de porumb), fie sursa mixta (vegetala sau animala).
Formulele delactozate utilizate, avand ca sursa laptele de vaca sunt Alfare, AL 110 (Nestle), Humana-HN (Humana), Milupa-HN25 (Milupa), Morigana-NL33 (Morigana) si cele avand drept sursa soia: Alsoy (Nestle), Isomil (Abbott-Ross).
Daca starea generala nu este foarte grava se foloseste drept cale de administrare calea enterala care este calea fiziologica cu numeroase avantaje psihologice, tehnice si mai ales nutritionale. Alimentatia parenterala trebuie sa ramana o procedura de exceptie.
În situatiile speciale, cand reflexul de deglutitie este abolit (coma) sau la prematurii cu greutate foarte mica la nastere, se poate recurge la tehnici speciale pentru mentinerea caii digestive in circuitul aportului nutritional precum gavajul (sonda nazogastrica). Gavajul este metoda curenta de administrare a formulelor dar, imediat ce alimentatia pe cale orala se poate relua, se va renunta la aceasta metoda.
Nutritia parenterala consta in utilizarea caii venoase pentru asigurarea aportului de substante nutritive in situatii in care calea digestiva este imposibil de utilizat (cazuri de diaree nespecifica asociate cu malabsorbtie si malnutritie severa).
Abordarea caii venoase se face prin doua variante: pe vene periferice (procedeu mai simplu si cu mai putine complicatii) sau pe vene centrale (venele cave) care permit perfuzarea unor solutii hiperosmolare intr-un volum mic. Dezavantajul major al acestei metoda este acela al unor complicatii infectioase severe.
Indiferent de modalitatea prin care nou-nascutul este alimentat, trebuie sa i se asigure necesarul de principii conform tabelului 10.
Tabel 10. Necesarul de principii nutritive la nou-nascut (dupa Ciofu7)
|
Aport caloric total |
165 - 180 kcal/kg/zi |
|
Proteine |
3,2 - 4 g/kg/zi (10% din calorii) |
|
Glucide |
12g/kg/zi (40 - 50% din calorii) |
|
Lipide |
3,5 - 6g/kg/zi (35 - 40% din calorii) |
|
Na+ |
2,5 mmol/100kcal |
|
K+ |
2,5 mmol/100kcal |
|
Ca2+ |
50 mg/100kcal (400 - 600 mg/zi) |
|
P |
160 mg/zi |
|
Mg2+ |
60 mg/zi |
Na=sodiu; K=potasiu; Ca=calciu; P=fosfati; Mg=magneziu;
Oxigenoterapia si suportul ventilator mecanic trebuie instituite in vederea supleerii functiei ventilatorii pulmonare si a inlaturarii hipoxiei prin ameliorarea oxigenarii tisulare. Presiunea arteriala a oxigenului la nou-nascuti ar trebui mentinuta la un nivel optim de 6,6 - 9,3 kPa (50-70 torr) ceea ce corespunde unei saturatii in oxigen de 92-95%, iar pentru CO2 nivelul ar fi intre 6 - 7,3 kPa (45-55 torr).9 Mentinerea unei PaO2 ridicate si/sau PaCO2 scazute se poate asocia cu afectarea semnificativa pulmonara (in urma hiperoxiei si barotraumei) cu dezvoltarea unei boli pulmonare cronice.
Expansiunea rapida a volumului intravascular este necesara pentru cresterea debitului cardiac, restabilirea presiunii arteriale si imbunatatirea perfuziei periferice in special in cazurile de soc septic. Necesarul de lichide poate fi foarte ridicat datorita vasodilatatiei periferice si permeabilitatii capilare crescute, ajungand la 10-20 ml/kg in primele 10 minute.4 Administratea de lichide se poate se poate repeta, la nevoie, acest lucru fiind stabilit in urma examinarii clinice, cuantificarii diurezei si eventual prin tehnici de monitorizare invazive (pentru presiunea venoasa centrala). Se folosesc albumina (pentru mentinerea presiunii oncotice), masa eritrocitara sau sange integral pentru ameliorarea transportului de O2 si pentru prevenirea coagularii intravasculare diseminate (CID).
c) Mentinerea echilibrului acido-bazic
Corectarea tulburarilor acidobazice ( cel mai frecvent acidoza metabolica) pemite o functionalitate celulara mai buna, scaderea rezistentei vasculare pulmonare si imbunatatirea performantei miocardului.
Acidoza se poate corecta doar prin instituirea ventilatiei asistate si administrarea de fluide. În cazuri severe se foloseste bicarbonat de Na in bolus cu administrare lenta 1-2 mEq/kg. La prematuri se folosesc solutii de 0,5 mEq/ml pentru prevenirea schimbarii osmolaritatii si hemoragiei intraventriculare. Daca acidoza metabolica persista, bicarbonatul se administreaza in perfuzie. Principala reactie adversa la bicarbonat este cresterea osmolaritatii serice, de aceea administrarea acestuia trebuie facuta cu precautie.
3. Tratamentul etiologic
a) Tratamentul antimicrobian
Va fi inceput imediat dupa recoltarea culturilor, in prezenta unei suspiciuni clinice la care se adauga prezenta reactantilor de faza acuta.
Tratamentul cu antibiotice si chimioterapice se desfasoara dupa cateva principii (vezi tabelul 11).
Tabel 11. Principii ale tratamentului etiologic (dupǎ Gavrilǎ si Pǎscariu15)
|
alegerea potrivita a acestuia |
|
alegerea caii de administrare |
|
conducerea acestui tratament |
|
durata tratamentului |
|
combaterea efectelor secundare |
În etapa initiala, el este empiric si acopera spectrul antibacterian al celor mai comuni germeni pentru aceasta varsta. Se opteaza, mai ales pentru sepsisul precoce, pentru asocierea de Ampicilina + Aminoglicozid. Alternativa la aceasta schema este o cefalosporina de generatia a III-a (Cefotaxim) -vezi mai jos-. Aceasta etapa initiala este acceptata doar pana la obtinerea antibiogramei, apoi se ajusteaza in functie de rezultatele aceasteia.
Medicatia de electie impotriva stafilococului auriu ramane Oxaciclina, Nafcilina si Meticilina. Pentru stafilococul meticilino-rezistent (MRSA) se foloseste Vancomicina. Stafilococul coagulazo negativ poate fi inca sensibil la Penicilina.
Controlul tratamentului cu antibiotice este foarte important, neonatologul alaturi de bacteriolog, avand responsabilitatea nu numai de a alege ci si de a supraveghea acest tratament. Controlul se face pe baza unor criterii clinice, paraclinice si de laborator, eficienta tratamentului fiind apreciata in functie de15:
-scaderea febrei in 3-4 zile;
-retrocedarea fenomenelor nervoase;
-normalizarea numarului de leucocite;
-scaderea VSH;
-sterilizarea hemoculturilor;
O hemocultura sterila, in plin tratament cu antibiotice, nu indica cu certitudine si sterilizarea focarelor, in timp ce persistenta germenilor in sange e o dovada certa a ineficientei terapeutice. Repetarea antibiogramei este necesara pentru controlul sensibilitatii germenului la antibiotice, mai ales cand se foloseste o medicatie fata de care germenii pot dezvolta rezistenta.
Protocoale ale tratamentului antimicrobian in functie de forma de sepsis sunt prezentate mai jos.5
nSEPSIS PRECOCE
Schema de electie (protocol primar) asociaza:
1. Ampicilina
a) Sepsis: 50mg/kg/doza; iv/im la 12h
b) Meningita: 100mg/kg/doza; iv/im la 12h
2. Gentamicina
a) pentru varsta gestationala (VG) < 28 sapt: 2,5 mg/kg/doza; iv/im la 24h
b) VG intre 28-34 sapt: : 2,5 mg/kg/doza; iv/im la 18h
c) VG > 34 sapt.: 2,5 mg/kg/doza; iv/im la 12h
Scheme alternative
Protocol alternativ 1
1. Ampicilina (in dozele mentionate)
2. Cefotaxime: 50mg/kg/doza; iv/im la 12h
Protocol alternativ 2
1. Ampicilina (in dozele mentionate)
2. Ceftriaxona: 50 mg/kg/doza; iv/im la 24h.
nSEPSIS TARDIV
Schema de electie (protocol primar 1)
1. Ampicilina (doza mai mare in suspiciunea de meningita)
a) greutate < 2kg: 25-50 mg/kg/doza; iv/im la 8h
b) greutate >2kg: 25-50 mg/kg/doza; iv/imla 6h
2. Cefotaxim: 50 mg/kg/doza; IV/IM la 8h
Schema de electie (protocol primar 2
1. Ampicilina (conform schemei anterioare)
2. Ceftriaxona 75 mg/kg/doza; iv/im la 24h
Schema alternativa
1. Ampicilina (conform schemei anterioare)
2. Gentamicina
a) VG < 37 sapt: 2,5 mg/kg/doza; iv/im la 12h
b) VG >37 sapt: 2,5 mg/kg/doza; iv/im la 8h
b) Tratamentul antiviral. Tratamentul formei diseminate a infectiei herpetice este profilactic si curativ.
Tratamentul profilactic se refera la prevenirea contactului nou-nascutului cu leziunile herpetice genitale ale mamei si de aceea gravidele cu astfel de leziuni trebuie sa nasca prin cezariana.
Tratamentul curativ se face cu Aciclovir 30 ml/kg/zi i.v. 14-21 zile sau Vidarabina 15-30 mg/kg/zi in p.e.v., 10 zile. Vidarabina se utilizeaza mai putin datorita toxicitatii mai mari.
c) Tratamentul antifungic. Infectiile fungice survin in special la prematuri care primesc alimentatie parenterala prelungita (cateter venos central) sau dupa o cura de antibiotice care provoaca dismicrobisme si faciliteaza astfel, dezvoltarea fungilor. De aceea, este necesara reducerea la minim a cateterizarii pentru evitarea infectiilor fungice diseminate (candidiaz ).9 Se utilizeazǎ Amfotericinǎ B i.v. 0,5-1 mg/kgc/zi, dozǎ divizatǎ in 4 administrari si/sau 5-fluorocitozin per os, 150 mg/kgc, de 4 ori pe zi.
4. Tratamentul formelor localizate
a) Tratamentul meningitei
Tratamentul antibiotic de prima intentie, administrat inaintea rezultatelor bacteriologice, consta in asocierea Cefotaximului in doza de 100mg/kg/zi, + Gentamicina 3-5mg/kg/zi, doze divizate in doua administrari pe zi, pe cale i.v. Dupa prima saptamana de tratament doza de cefotaxim se dubleaza (200mg/kg/zi, divizate in 3-4 administrari/zi). Durata tratamentului continuu este de doua saptamani dupa sterilizarea LCR, in total 21 zile pentru germenii Gram (-) si circa 14 zile in meningitele cu germenii Gram (+). Examinarea LCR se repeta dupa 48h de la initierea tratamentului. Daca metodele imagistice arata prezenta de empiem subdural, abces cerebral sau ventriculita, poate fi necesara interventia neurochirurgicala.
b) Infectiile cutanate
Beneficiaza de toaleta locala, tratament local cu pulbere de Bacitracina si Neomicina, (preparate Neobasept sau Baneocin), dar de obicei este necesar tratamentul parenteral antistafilococic cu Oxacilina, 50mg/kg la fiecare 12 ore in prima saptamana post-partum. Dupa prima saptamana de viata, doza se creste la 150-200 mg/kg/zi in 3-4 prize pentru nou nascutul la termen.
c) Oftalmia gonococica
Daca este confirmata bacteriologic, impune tratament cu Cefotaxim, 100mg/kg/zi, i.v./i.m, sau Ceftriaxon, 125 mg/zi, i.m./i.v. Daca susa este sensibila la Penicilina, doza de 100.000 u.i./kg/zi, administrata in doua prize zilnice, va fi initiata imediat dupa diagnostic. Durata tratamentului este de 7-10 zile.
Tabel 12. Dozele de antibiotice folosite la nou-nǎscuti (Adaptat dupa McCracken si Nelson
Antibiotice |
Administrare |
Dozele (mg/kgc/24h) si intervale de administrare |
|||
Greutate < 2000g |
Greutate > 2000 g |
||||
Varsta: 0-7 zile |
Varsta > 7 zile |
Varsta: 0-7 zile |
Varsta > 7 zile |
||
|
Amikacina |
IM/IV |
15 divizat la 12h |
30 divizat la 8h |
20 divizat la 1wh |
30 divizat la 8h |
|
Ampicilina - Meningita |
IV/IM |
100 divizat la 12h |
150 divizat la 8h |
150 divizat la 8h |
200 divizat la 6h |
|
Ampcilina - Alte boli |
IV/IM |
50 divizat la 12h |
75 divizat la 8h |
75 divizat la 8h |
100 divizat la 6h |
|
Cefazolin |
IV/IM |
40 divizat la 12h |
40 divizat la 12h |
40 divizat la 12h |
60 divizat la 8h |
|
IV/IM |
100 divizat la 12h |
150 divizat la 8h |
100 divizat la 12h |
150 divizat la 8h |
|
|
Cefalotin |
IV |
40 divizat la 12h |
60 divizat la 8h |
60 divizat la 8h |
80 divizat la 6h |
|
Cloramfenicol |
IV/PO |
25 o data pe zi |
25 o data pe zi |
25 o data pe zi |
50 divizat la 12h |
|
Eritromicina |
PO |
20 divizat la 12h |
30 divizat la 8h |
20 divizat la 12h |
30-40 divizat la 8h |
|
Gentamicina |
IM/IV |
5 divizat la 12h |
7.5 divizat la 8h |
5 divizat la 12h |
7,5 divizat la 8h |
|
Kanamicina |
IM/IV |
15 divizat la 12h |
30 divizat la 8h |
20 divizat la 12h |
30 divizat la 8h |
|
Meticilina - meningita |
IV/IM |
100 divizat la 12h |
150 divizat la 8h |
150 divizat la 8h |
200 divizat la 6h |
|
Metcilina - alte boli |
IV/IM |
50 divizat la 12h |
75 divizat la 8h |
75 divizat la 8h |
100 divizat la 6h |
|
Mezlocilina |
IV/IM |
150 divizat la 12h |
225 divizat la 8h |
150 divizat la 12h |
225 divizat la 8h |
|
Nafcilina |
IV |
50 divizat la 12h |
75 divizat la 8h |
50 divizat la 8h |
75 divizat la 6h |
|
Penicilina G (benzatin) |
IM |
50 mii UI o doza |
50 mii UI o doza |
50 mii UI o doza |
50 mii UI o doza |
|
Penicilina G (procain) |
IM |
50 mii UI o data pe zi |
50 mii UI o data pe zi |
50mii UI o data pe zi |
50 mii UI o data pe zi |
|
Penicilina G - meningita |
IV |
100 mii UI divizat la 12h |
150 mii UI divizat la 8h |
150 mii UI divizat la 8h |
200 miiUI divizat la 6h |
|
Penicilina G - alte boli |
IV |
50 mii UI divizat la 12h |
75 mii UI divizat la 8h |
50 mii UI divizat la 8h |
1 milion UI divizat la 6h |
|
Ticarcilina |
IV/IM |
150 divizat la 12h |
225 divizat la 8h |
225 divizat la 8h |
300 divizat la 6h |
|
Tobramicina |
IM/IV |
4 divizat la 12h |
6 divizat la 8h |
4 divizat la 12h |
6 divizat la 8h |
|
Vancomicina |
IV |
30 divizat la 12h |
45 divizat la 8h |
30 divizat la 12h |
45 divizat la 8h |
d) Osteomielita
Se trateaza initial cu Oxaciclina + Gentamicina, pana se identifica agentul etiologic si sensibilitatea acestuia la antibiotice. Durata tratamentului va fi prelungita inca 3-4 saptamani dupa disparitia semnelor clinice locale sau generale. Orice colectie purulenta (inclusiv intraarticulara) va fi drenata, la nevoie chirurgical. Artrita septica impune imobilizarea articulatiei.
5. Tratamentul patogenic si al complicatiilor (vezi capitolul Complicatii)
Tratamentului patogenic i se acorda o importanta deosebita, fapt explicabil pe de o parte prin progresele realizate in cunoasterea patogeniei procesului septic, iar pe de alta parte prin utilizarea unor medicamente deosebit de active precum corticoizii si derivatii sai. Totusi utilizarea lor impune anumite precautii datorita unor proprietati proinfectioase.
Studii recente (vezi subcapitolul Posibile optiuni terapeutice) au dovedit eficienta utilizarii anticorpilor monoclonali impotria endotoxinelor bacteriene (Centoxin, Xomen). Se mai incearca utilizarea anticorpi anti-CD14, a proteinelo recombinate genetic (rBPI), inhibitia guanilat-ciclazei (activata de NO), precum si interferarea adeziunii leucocitelor la endoteliu.
6. Posibile optiuni terapeutice
Limitarea modalitatilor terapeutice curente in sepsis este evidentiata de mentinerea unei rate inalte a mortalitatii in ciuda unor progrese inregistrate in ceea ce priveste terapia antibiotica si tehnologia utilizata in sectiile de terapie intensiva.
Terapia conventionala in sepsis se adreseaza stadiilor initiale (tratamentul etiologic) si finale (incercarea de a restabilii functia normala a organelor insuficiente in urma procesului septic prin masuri suportive). Potentialele tinte vizeaza etapele patogenice intermediare ale procesului septic ale noilor terapii (vezi fig 7). Modularea selectiva a raspunsului imun (prin anticorpi anti-LPS; analogii lipidului A) sau interferarea actiunii citokinelor asupra celulelor-tinta (anticorpi anticitokina; antagonistii receptorilor citokinici) sunt doar cateva modalitati terapeutice, care, probabil in viitor, vor imbunatati supravietuirea.
a) Neutralizarea endotoxinei
Datorita importantei deosebite in patogenia sepsisului, endotoxina bacteriilor Gram (-) sau lipopolizaharidul (LPS) reprezinta una din primele tinte ale noilor metode terapeutice. Nivelurile LPS se afla in raport de proportionalitate inversa cu rata supravietuirii. Neutralizarea proprietatilor toxice ale LPS, indepartarea LPS de la nivelul potentialelor locuri de activare sau blocarea interactiunii cu receptorii celulelor susceptibile sunt cateva din obiectivele urmarite.
Anticorpii antiendotoxina monoclonali
Anticorpii indreptati impotriva regiunii centrale (lipidul A) a LPS, regiune comuna tuturor bacteriilor Gram(-), au fost verificati daca neutralizeaza efectele negative ale LPS sau confera rezistenta la infectii.
Doi anticorpii monoclonali (de tip IgM) au fost studiati mai amanuntit : HA-1A si E5. HA-1A (Centoxin) deriva dintr-o linie celulara umana, iar E5 (Xomen) este un anticorp de origine murina.10
Fig.7 Etape-cheie in patogenia procesului septic si cateva din potentialele tinte terapeutice (dupǎ DeBoisblanc, Guery si Nelson10)
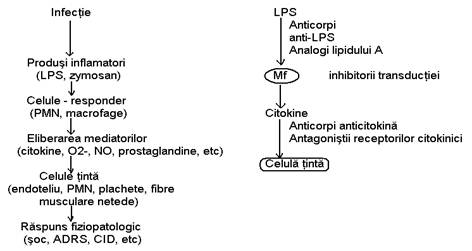
LPS=Lipopolizaharid; PMN=Polimorfonucleare; Mf=Macrofage; NO=Oxid nitric; ARDS=Detresǎ respiratorie; CID=Coagulare intravascularǎ diseminatǎ;
Primele rezultate privind folosirea acestor anticorpi monoclonali au fost incurajatoare, dar ulterior, dupa analize atente, entuziasmul a fost temperat de diverse studii care nu au dovedit o imbunatatire semnificativa a supravietuirii pacientilor tratati.
Un studiu prospectiv, randomizat, placebo-control, utilizand, in care au fost inclusi 543 de pacienti cu sepsis, a avut rezultate sub asteptari. A demonstrat o usoara scadere a letalitatii, in urma utilizarii HA-1A, pentru subgrupul de pacienti cu sepsis determinat de Gram(-). Letalitatea a fost aproximativ aceeasi la placebo si control: 49% mortalitate pentru placebo si 30% pentru cei tratati cu HA-1A.10
Un alt studiu, utilizand E5 versus placebo a inclus 486 de pacienti cu un probabil sepsis determinat de Gram(-). Concluziile au fost aceleasi: rata supravietuirii pentru cele doua subgrupuri (cei ce au primit E5 si placebo) a fost aceeasi. Singura deosebire a fost ca, la pacientii care nu au avut soc refractar, supravietuirea la 30 de zile a fost de 2 ori mai mare pentru cei tratati cu E5.10
Anticorpii antiendotoxina policlonali
Ramane de dovedit daca imunizarea pasiva impotriva infectiei cu Gram(-) folosind anticorpii antiendotoxina policlonali, polivalenti (de tip IgG, IgM, IgA) ar putea fi o optiune terapeutica. Într-un studiu prospectiv, cu 55 de pacienti cu soc septic produs de Gram(-), in care criteriul obligatoriu de includere a fost detectarea endotoxinemiei, mortalitatea in cazul celor ce au primit anticorpi policlonali a fost de doar 4% comparativ cu 32% in grupul control.10
Bactericidal Permeability Increasing Protein (BPI)
BPI este o citotoxina foarte potenta, eliberata de catre neutrofile in timpul fagocitozei, cu specificitate pentru bacteriile Gram(-). Aceasta inhiba activitatea endotoxinei prin legarea la nivelul regiunii lipidulului A. Odata legata, altereaza permeabilitatea membranara a bacteriilor Gram(-) si produce moartea acestora. Un alt rol atribuit BPI este acela de a preveni activarea neutrofilelor de catre LPS (lucru demonstrat in vitro) si de a inhiba productia TNF indusa de LPS.10 Aceste proprietati foarte interesante au condus la ideea ca BPI ar fi capabila sa produca o diminuare a raspunsului organismului fata de LPS, atat prin stoparea proliferarii bacteriilor ce produc LPS, cat si prin legarea directa de LPS.
A fost dovedit ca BPI este mult mai utila in legarea si neutralizarea endotoxinei comparativ cu anticorpii monoclonali (HA-1A si E5). Într-un model de sepsis determinat de Gram (-), cu afectare pulmonara, s-a comparat eficacitatea E5 cu cea a unui fragment N-terminal de 23kD a BPI, obtinut prin recombinare genetica (rBPI23). Protectia conferita de aesta a fost cu mult mai mare decat cea a E5, rata supravietuii fiind de 95% fata de 20%. De asemenea, rBPI23 a accelerat clearance-ul pulmonar si vascular al bacteriilor.10
Într-un alt studiu realizat cu ajutorul a 8 voluntari, care au primit anterior endotoxina, rBPI23 a crescut clearance-ul endotoxinei, a scazut eliberarea de TNF, IL6 si IL10, a inlaturat neutropenia asociata si a impiedicat degranularea neutrofilelor.10
Ramane ca studii clinice viitoare sa confirme proprietatile remarcabile ale BPI in tratamentul sepsisului.
Analogii Lipidului A
Lipidul A este portiunea toxica cea mai importanta a LPS. Structura similara a lipidulului A si a lipidului X (monozaharid precursor al lipidului A), precum si toxicitatea mult mai mica a lipidului X sugereaza utilizarea lipidului X ca un inhibitor competitiv (antagonist de receptor) al lipidului A. În studii folosind modele animale de sepsis, lipidul X scade letalitatea indusa de LPS si blocheaza secretia macrofagica a TNF determinata de LPS.10
Monofosforil lipidul A (MPLA) este un alt derivat al lipidului A cu o toxicitate de 1000 de ori mai mica (la animale) decat LPS. MPLA a redus letalitatea la animalele care au primit doze letale de E. Coli.10 Se pare ca toxicitatea scazuta a MPLA, rezulta din incapacitatea de a induce nivele ridicate ale TNF, in contrast cu LPS sau lipidul A. Aceasta ipoteza nu s-a verificat in vivo deoarece nivelul TNF dupa administrarea MPLA e comparabil cu cel post LPS. Totusi, doar LPS induce soc si exitus sugerand ideea ca exista si alti factori, in afara TNF, raspunzatori pentru consecintele letale ale endotoxinemiei.10
b) Antagonistii citokinelor
Antagonizarea efectelor Tumor Necrosis Factor α (TNFα)
Citokinele reprezinta mediatori polipeptidici care moduleaza raspunsul gazdei fata de diverselor agresiuni. TNFα, unul dintre mediatorii proinflamatori ceimai importanti, este secretat, in principal, de sistemul monocit-macrofag. Nivelul seric de TNFα este crescut la 33% din pacienti aflati in stare critica.10
Presupunerea ca nivelul seric ridicat al TNFα ar fi stransa legatura cu severitatea afectiunii nu s-a verificat. În unele experimente s-au administrat TNFα (obtinut prin recombinare genetica) sau LPS (sub control riguros asupra eventualelor reactii adverse). S-a observat aparitia catorva semne si simptome intalnite in sepsis (febra, tahicardie, cresterea hormonilor de stres, instalarea unui status hipermetabolic). În nici un caz nu s-a ajuns intr-un stadiu sever, amenintator de viata. Se pare ca rolul TNF, asociat mortalitatii in sepsis, este accentuat de prezenta altor mediatori, de localizarea infectiei (generalizata sau localizata) si de durata actiunii asupra organismului-gazda.10
Desi in studiile folosind animale de laborator (soareci sau babuini), folosirea de anticorpi anti-TNFα s-a dovedit a fi benefica, letalitatea prin infectii severe nu a putut fi prevenita prin utilizarea acestora. Explicatia consta in faptul ca, alaturi de forma circulanta a TNFα, exista o alta forma, asociata membranei celulare, care ramane relativ inaccesibila anticorpilor anti-TNFα. Aceasta este biologic activa si reprezinta un precursor al formei circulante.
Trialurile clinice utilizand anticorpii anti-TNFα au esuat pana acum in incercarea de a imbunatati supravietuirea in sepsisul uman.10 Activitatea anticorpilor monoclonali anti-TNFα (de provenienta murina) a fost studiata intr-un trial cu 80 de pacienti cu sepsis sever ce au primit doze crescande de anticorpi. În urma tratamentului, nu s-au constat reactii adverse importante dar nici efecte benefice. Într-un trial urmator (NORASEPT), 971 de pacienti cu sepsis au fost tratati placebo sau cu una sau 2 doze de anticorpi. Dupa 28 de zile de urmarire, supravietuirea in grupul placebo si in cel care a primit tratament nu a fost diferita, doar pacientii cu soc au avut o supravietuire la 3 zile mai buna comparativ cu placebo.10
Alte investigatii s-au concentrat pe utilizarea fragmentelor Fab ale anticorpilor monoclonali anti-TNFα (de tip IgG) sau pe afinitatea mai mare a receptorilor solubili ai TNF in legarea si neutralizarea TNF circulant. Fragmentele sunt mai putin imunogene, au o interactiune minima cu receptorii Fc si au o penetrare tisulara mai buna. Nu s-au constatat imbunatatiri ale supravietuirii; in cel de-al doilea caz s-a constatat chiar o crestere a letalitatii in grupul pacientilor tratati.10
Antagonistii Interleukinei 1 (IL1
O alta citokina esentiala in patogenia sepsisului este interleukina 1 (IL1). Ea se prezinta sub 2 forme: IL1α si IL1β, aceasta din urma fiind crescuta, in mod obisnuit, in sepsis. Multe dintre efecte sunt similare TNFα. Nivelul seric de IL1 este ridicat la pacientii cu sepsis si administrarea (experimentala) de doze scazute de IL1 induce aparitia unei simptomatologii asemanatoare celei din sepsis.10
S-a detectat (in urina pacientilor leucemici) un antagonist de receptor al IL1 si anume IL1ra.10
Prin recombinare s-a obtinut o forma non-glicolizata a IL1ra, care blocheaza actiunea IL1. Administrata la iepuri imediat inainte de injectarea endotoxinei, a dus la cresterea spectaculoasa a supravietuirii de la 20% la 90%.10 La babuinii, care ulterior au fost injectati continuu cu E. Coli, a imbunatatit supravietuirea si hemodinamica si a redus severitatea lactacidemiei.
Într-un studiu multicentric, incluzand 99 pacienti cu sepsis, in care s-a utilizat IL1ra, a fost demonstrata o reducere semnificativa statistic a mortalitatii: 44% in grupul placebo fata 16% in grupul ce a primit doza inalta de IL1ra.10 Aceasta reducere a fost deci, dependenta de doza. S-a mai constatat, dupa 3 zile de tratament, o imbunatatire a starii pacientilor cu afectare severa dar aceasta observatie ramane sa fie confirmata de alte studii.
c) Imunoterapia
Granulocyte colony-stimulating factor (G-CSF)
Ideea utilizarii unor strategii terapeutice prin care raspunsul inflamator al organismului sa fie amplificat a aparut o data cu inregistrarea unor rezultate putin concludente in ceea ce priveste supresia, prin diverse metode, a raspunsului inflamator (anticitokine si alti agenti similari).
Probabil ca sistemul imunitar ar trebui considerat unul dintre multiplele sisteme care devin insuficiente in sepsis. Daca aceasta ipoteza s-ar verifica ar insemna ca strategia antiinflamatorie nu ar face decat sa compromita si mai mult sistemul imunitar. De aceea avand de-a face cu un organism imunocompromis (conform ipotezei de mai sus), folosirea unor agenti terapeutici prin care sa se obtina o hiperactivare a sistemului imun pare justificata.
Cel mai utilizat si mai cunoscut agent terapeutic din aceasta categorie este factorul stimulator al coloniilor de granulocite (G-CSF), o glicoproteina din familia factorilor stimulatori ai coloniilor care joaca un rol esential in determinarea numarului normal al PMN si a raspunsului acestora in bolile inflamatorii si infectioase (vezi tabel 13).
Tabel 13. Efectele G-CSF asupra functiei neutrofilelor (dupǎ DeBoisblanc, Guery si Nelson10)
|
Creste chemotaxia |
|
Creste fagocitoza |
|
Creste activitatea bactericida |
|
Creste activitatea fungicida |
|
Creste citotoxicitatea celulara dependenta de anticorpi |
|
Întarzie apoptoza |
G-CSF se regaseste in toate organele importante in concentratii mai mari decat cele din circulatie. La expunerea organismului la un anumit stimul, productia de G-CSF poate creste rapid. TNFα si IL1, doua dintre citokinele eliberate de endotoxina, actioneaza asupra celulelor stromale ale maduvei osoase crescand expresia ARNm si secretia de G-CSF.
Într-un model de sepsis, indus la soareci, G-CSF s-a dovedit eficace in cresterea ratei supravietuirii. În plus, asocierea cu Gentamicina s-a dovedit mult mai eficace comparativ cu grupul care nu a primit G-CSF sau care a primit doar G-CSF. În alt experiment s-a dovedit eficacitatea G-CSF fata de anticorpii anti-TNFα de tip IgG, supravietuirea la 2 zile fiind de 100% fata de doar 10%.10
Folosind un model canin s-a demonstrat ca exista diferente la utilizarea de doze diferite de G-CSF. La doze inalte (5mg/kg), supravietuirea este semnificativ mai mare fata de doze joase (0,1mg/kg) sau placebo, functia cardiovasculara se imbunatateste, creste clearance-ul endotoxinei si scade nivelul seric al TNFα.
G-CSF este inregistrat in SUA (NeupogenTM) pentru profilaxia si tratamentul afectiunilor febrile asociate cu neutropenie (consecutiva chimioterapiei din cancere nonmieloidale). Rezultatele preliminare ale trialurilor clinice sunt promitatoare. S-a infirmat temerea ca, eventuala activare a neutrofilelor, ar duce la dezvoltarea unui sindrom de detresa respiratorie. Un studiu multicentric, dublu-orb, placebo control cu 756 de pacienti cu pneumonie severa a demonstrat ca G-CSF, asociat tratamentului antibiotic, a dus la scaderea complicatiilor (ADRS, CID, Empiem) comparativ cu cei ce nu au primit G-CSF. Letalitatea a ramas, totusi, aceeasi. 10
Rolul imunoglobulinelor i.v.(IVIG)
Nou-nascutii,in special prematurii cu greutate mica la nastere,au un nivel scazut al imunoglobulinelor plasmatice, acest lucru crescand riscul de infectie. S-a demonstrat ca IVIG creste apararea imuna la si scade incidenta sepsisului la prematuri.20 Nu exista, inca, studii care sa confirme utilitatea pentru toti nou-nascutii cu sepsis. În general, se recomanda la prematurii cu greutate mica la nastere, cateterizati mai mult de 7 zile sau cu infectie dovedita. Doza recomandata este de 750mg/kgc. Utilitatea IVIG trebuie dovedita si la pacientii neutropenici cu soc septic.
Transfuzia de granulocite
Reprezinta o alternativa a imunoterapiei, benefica la nou-nascutii cu neutropenie severa, cu deviere importanta la stanga a formulei leucocitare. Doza recomandata este de 15ml/kgc20, timp de 1ora.
d) Alte strategii antiinflamatorii
Antiinflamatoriile nesteroidiene (AINS)
Metabolitii acidului arahidonic, care se sintetizeaza pe calea ciclooxigenazei (COX), in special, Tromboxan A2 si Prostaciclina, sunt crescuti in sepsis. Inhibarea ciclooxigenazei, cu agenti de genul Ibuprofenului (un inhibitor reversibil de COX) a dus la imbunatatirea schimbului de gaze si la inlaturarea hipotensiunii la pacientii cu sepsis dar nu a impiedicat dezvoltarea ADRS sau evolutia spre exitus.10
Antagonistii Factorului Activator Plachetar (PAF)
PAF are un rol fundamental legat de amplificarea productiei de TNFα si IL1. Antagonizarea PAF a dus la scaderea letalitatii in modele animale ale sepsisului.10
Într-un studiu cu 262 de pacienti cu sepsis sever determinat de Gram(-), tratati cu un antagonist al PAF (GinkolideB; BN 52021) nu a evidentiat o diferenta semnificativa statistica in ce priveste supravietuirea la 28 de zile.10
Antagonistii Bradikininei
Bradikinina este un vasodilatator potent ce contribuie la hipotensiunea asociata socului septic. Antagonizarea bradikininei imbunatateste rezultatul dupa sepsisul experimental cu Gram(-). Utilizarea unui antagonist al bradikininei (CP-0127) la 500 de pacienti cu prezumtie de sepsis nu a aratat o modificare in ce priveste supravietuirea.10
e) Proteina C activata
Sistemul alcatuit din proteina C si proteina S inhiba activarea factorilor V si VIII ai coagularii. Activarea proteinei C este mediata de catre trombina, dupa ce aceasta se leaga la trombomodulina, care este exprimata de celulele endoteliale si care serveste ca receptor pentru trombina. Dupa legare, trombina isi pierde functiile in procesul coagularii. Proteina S, un cofactor pentru proteina C activata, se regaseste sub o forma libera (care reprezinta 40%) si intr-o forma inactiva (60%). Ultima formeaza un complex impruna cu C4b-BP (C4b-Binding Protein).33
Sepsisul se asociaza cu reducerea activitatii proteinei C. Într-un studiu multicentric (PROWESS), tratamentul cu proteina C activata si-a dovedit eficienta in sepsis sever si soc septic, crescand supravietuirea la 28 de zile. Aceasta a dus la aprobarea, in noiembrie 2001, de catre Food and Drug Administration (FDA) a acestui tratament (Drotrecogin, Xigris)12. Exista date limitate privind utilizarea la nou-nascuti si copii. Proteina C activata a fost introdusa, in tratament, la aceasta categorie de varsta numai dupa ce studiile de la adulti au aratat o toxicitate redusa si un potential beneficiu. În ceea ce priveste riscul de sangerare, o reactie adversa destul de importanta, acesta se mentine la nivel similar ca la adulti.12
f) Manipularea oxidului nitric (NO)
Oxidul nitric (NO), produs sub actiunea NO-sintetazei calciu dependenta (NOS1) joaca un rol-cheie in diverse organe si sisteme datorita propritatilor de mesager biologic. O a doua forma a acestei enzime, calciu-independenta, (NOS2), se poate activa la 12 pana la 24 de ore de la debutul sepsisului, in diferite celule macrofage, celule musculare netede din peretele vascular, hepatocite si celule endoteliale.28
Aceasta din urma enzima, produce NO in cantitati mult mai mari decat izoforma constitutiva (calciu-dependenta): nanomoli fata de picomoli si contribuie in mod semnificativ la modificarile hemodinamice asociate socului septic.
Inhibitorii NOS
Pierderea responsivitatii vasculare in sepsis poate implica activarea NOS de catre mediatori precum TNF , IL1 si IFNγ.37 Au fost raportate cazuri in care se arata rolul benefic al inhibitorilor NOS in contracararea efectelor vasoplegice datorate NO in sepsis.37 Efectele hemodinamice benefice (restabilirea tensiunii arteriale) pot fi insotite,insa, si de efecte adverse (ischemie in teritoriul splanhnic si renal) datorita prezentei ubicuitare a NOS si blocarii non-selective a acesteia.37
Totusi, s-a aratat ca NO are si efecte benefice (in afara modificarilor hemodinamice negative), legate de modularea raspunsului imun in sepsis cu un important rol antiinflamator (vezi tabelul14)
Tabel 14. Roluri benefice atribuite NO (dupǎ Piper si Sibbald28
|
apararea impotriva microorganismelor intracelulare (HSV) |
|
inhiba replicarea virala |
|
inhiba activarea endoteliala |
|
inhiba expresia moleculelor de adeziune |
|
inhiba aderarea monocitelor (prin inhibarea NFKB*) |
*NF-KB = factor de transcriptie care regleaza genele tinta implicate in raspunsul de faza acuta (genele pentru IL1b, IL2, IL6, IFNg si TNFa
Inhibitia guanilat-ciclazei solubile (activate de NO) cu albastru de metilen reprezinta una dintre modalitatile terapeutice pentru diminuarea productiei excesive a NO.37
NO inhalator. Utilizarea locala a NO (datorita efectelor antiinflamatorii) s-a dovedit a fi utila la pacientii cu sindrom de detresa respiratorie acuta (ADRS) prin folosirea acestuia pe cale inhalatorie.
Evolutia pneumoniei severe din sepsis, care se insoteste de o importanta hipoxemie se pare ca este favorabila prin folosirea NO inhalator, care produce vasodilatatie pulmonara selectiva si reduce rezistenta pulmonara.9 Totusi trebuie administrat cu precautie atunci cand se asociaza cu concentratii ridicate de O2 datorita toxicitatii pulmonare a amestecului celor 2 gaze.9
g) Surfactantul exogen
Cercetari in domeniul fiziologiei surfactantului au dus la ideea utilizarii acestuia in sindromul de detresa respiratorie acuta din sepsis. În ADRS, edemul secundar afectarii membranei alveolo-capilare duce la inhibarea functiei surfactantului (prin proteinele plasmatice transvazate si prin alterarea functiei pneumocitelor de tipII)
Un studiu utilizand surfactant de origine bovina (Survanta) a aratat o crestere a compliantei pulmonare si scaderea complicatiilor.9 Eficacitatea surfactantului exogen depinde si de modalitatea de ventilatie folosita, care influenteaza distributia la nivel pulmonar. Astfel, studiindu-se 15 nou-nascuti la termen cu insuficienta respiratorie ce nu raspundeau la administrarea simpla, s-a dovedit ca ventilatia cu frecventa inalta ofera mai multe avantaje.9
7. Conduita in fata suspiciunii de sepsis neonatal
Exprima atitudinea diferita in fata unui nou-nascut suspectat de sepsis neonatal. Încadrarea nou-nascutului intr-un algoritm anume se face in functie de 3 parametri:
ndaca e nascut la termen sau e prematur
ndaca e simptomatic sau asimptomatic
ndaca mama a primit anterior nasterii tratament antibiotic (pana la cel putin 4h inaintea nasterii)
Factorii materni de risc la care se face referire inseamna, (in ordinea importantei estimate), colonizare cu GBS (Streptococul b hemolitic), amniotita, ruptura prematura de membrane > de 12-24h si febra (>38 C) in timpul travaliului.
Nou-nascutul simptomatic se refera la prezenta detresei respiatorii, apneei, somnolente, alimentatie dificila.
A. Nou-nascut la termen; simptomatic; cu tratament anterior
1. Se efectueaza culturi (in special hemocultura)
2. Se institue tratament
3. Reevaluarea stausului clinic si a rezultatului culturilor la 48h.
Daca hemocultura e negativa (-) si examenul LCR e normal (N) (adica cultura + celularitate) se studiaza posibilatatea intreruperii antibioticului sau continuarii pentru inca 72h.
Antibioticele se opresc sigur daca:
- culturile sunt (-)
- nu exista factori de risc materni (amniotita sau colonizare cu GBS)
- evolutia clinica nu corespunde infectiei.
Daca culturile sunt (+) sau nou-nascutul prezinta semne de sepsis sau exista facturi de risc materni importanti atitudinea de urmat este urmatoarea:
Tratament de 10zile (pentru hemocultura (+))
Tratamentul de 14-21 zile (pentru Cultura LCR(+)
B. La termen; simptomatic; fara tratament anterior
1. Culturi
2. Tratament
3. Reevaluare la 48h (status clinic si culturi)
Daca hemocultura (-) + LCR (N) se opreste antibioticul sau se continua pentru 72h. Antibioticele se intrerup daca culturile sunt (-) si evolutia clinica nu corespunde infectiei. Pentru hemoculturi (+), tratamentul dureaza 10 zile, iar, pentru culturi LCR (+), 14-21 zile.
C. La termen; asimptomatic; tratament anterior
1. Observare clinica atenta timp de 48h
2. Efectuare culturi (sange sau LCR) daca exista factori de risc materni (amniotita sau colonizare GBS)
D. La termen; asimptomatic; fara tratament anterior
1. Observarea atenta 24h daca exista factori materni de risc
2. Nu se recomanda efectuarea culturilor sau instituirea tratamentului
E. Prematur; simptomatic; tratament anterior
1. Culturi
2. Instituirea tratamentului
3. Reevaluare la 72h
Tratamentul se mentine de obicei 10 zile. mentinerea este indicata daca se pastreaza simptomatologia initiala si/sau daca se adauga alte semne si simptome. Antibioticele se opresc in cazul unei evolutii nesugestive pentru infectie si daca culturile sunt (-).
G. Prematur; simptomatic; fara tratament anterior
1. Culturi
2. Tratament
3. Reevaluare la 72h
Tratament este obligatoriu si dureaza 10 zile pentru hemoculturi (+) si 14-21 zile pentru culturi LCR (+).
H. Prematur; asimptomatic; tratament anterior
1. Culturi
2. Tratament
3. Reevaluare la 72h
Antibioticele se opresc daca nou-nascutul se mentine asimptomatic, evolutia clinica nu sugereaza infectia si culturile sunt (-).
I. Prematur; asimptomatic; fara tratament anterior
n Nou-nascutul > 1250g la nastere si 30 saptamani de gestatie nu se trateaza
n Pentru nou-nascutul < 1250g la nastere si <30 saptamani:
1. Culturi
2. Tratament
3. Reevaluare la 72h
4. STOP antibiotice daca se mentine asimptomatic sau evolutia clinica nu sugereaza infectie si culturile sunt(-)
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |