ABSORBTIA
Absorbtia este operatia de separare a amestecurilor gazoase (sistem omogen) bazata pe solubilitatea diferita a componentilor amestecului intr-un lichid sau amestec lichid omogen (solutie) corespunzator ales, numit absorbent.
Prin contactarea amestecului gazos cu absorbantul, unul sau mai multi componenti se dizolva, putand fi recuperate, daca este cazul, prin operatia inverse numita desorbtie.
Cand separarea amestecului gazos prin absorbtie (deci utilizarea unei faze lichide omogene ca absorbent) se face ca urmare a dizolvarii diferita a componentilor, operatia se numeste absorbtie fizica.
Cand separarea amestecului gazos are loc prin reactie chimica intre gazul dizolvat (component al amestecului gazos) si lichidul absorbant sau un component al acestuia (utilizarea ca absorbent a unui amestec lichid, in care unul din componenti este specie chimic activa cu componentul gazos dizolvat), operatia se numeste absorbtie chimica sau chemosorbtie (deci chemosorbtia este un proces dublu: dizolvare + reactie chimica reversibila sau ireversibila).
Operatia, fizica sau chimica, poate fi insotita sau nu de un efect termic, in acest caz fiind clasificata in absorbtie izoterma si absorbtie neizoterma.
Teoretic, procesul de dizolvare este insotit intotdeauna de effect termic, de degajare de caldura. Practic, functie de natura componentilor amestecului gazos, proprietatile fizice ale acestora si absorbantului si de concentratia initiala in componentii de separate a amestecului gazos, cand degajarea de caldura este mica, neglijabila, avand drept consecinta variatia temperaturii celor doua faze in lungul coloanei de absorbtie cu 3-5 oC, se considera absorbtie izoterma.
Amestecul gazos supus separarii este format din doi sau mai multi componenti si functie de absorbantul ales, se dizolva un component (celalalt sau ceilalti componentii poarta denumirea de inert), operatia numindu-se absorbtie monocomponent, sau mai multi componenti (ceilalti componenti care nu participa la transferal dintr-o faza in alta numindu-se inert), operatia numindu-se absorbtie multicomponent.
Absorbtia se efectueaza atat in utilaje tip coloana (cu talere sau umplutura), cat si-n utilaje specifice, denumirea generala fiind absorbere sau coloane de absorbtie, pentru cazul particular cel mai des utilizat industrial.
Absorbtia este o operatie unitara, un procedeu tehnologic, de indepartare a impuritatilor gazoase din fluxurile de materii prime si auxiliare, de separare si recuperare din fluxurile de produse intermediare, de purificare a produselor finite principale si secundare si de tratare a efluentilor gazosi industriali.
1. ECHILIBRUL GAZ-LICHID
Notiunea de echilibru poate fi definita ca starea stabila din care un sistem inchis nu mai evolueaza in mod spontan in nici o directie, nu mai are loc nici o schimbare si deci parametrii de stare ai sistemului (temperature, presiune si compozitie) sunt invariabili in timp. Ea reprezinta punctual final al oricarui proces natural si nu poate fi modificata daca in conditiile sistemului respective (parametrii de stare) nu intervin unele modoficari. Viteza cu care un sistem se apropie de starea de echilibru poate fi exprimata ca un efect combinat a doi factori: un factor potential care furnizeaza forta motoare (motrice) necesara desfasurarii procesului si un factor de rezistenta, care controleaza viteza cu care are loc procesul la un potential dat.
La echilibru, factorul potential sau forta motrice devine egala cu zero. Forta motoare sau diferenta de potential se exprima, in forma generala, ca diferenta intre potentialele chimice ale componentilor din cele doua faze in contact, la echilibru, aceste potentiale devin egale:
![]() (1)
(1)
In care ![]() reprezinta potentialul
chimic al componentului I in faza gazoasa, iar
reprezinta potentialul
chimic al componentului I in faza gazoasa, iar ![]() potentialul chimic al
aceluiasi component in faza lichida. Desi introducerea notiunii de potential
chimic permite definirea riguroasa a conditiei de echilibru, datorita
caracterului abstract al acestei notiuni, nu se poate utilize in mod direct la
obtinerea unor relatii intre parametrii de stare, in conditiile de echilibru.
potentialul chimic al
aceluiasi component in faza lichida. Desi introducerea notiunii de potential
chimic permite definirea riguroasa a conditiei de echilibru, datorita
caracterului abstract al acestei notiuni, nu se poate utilize in mod direct la
obtinerea unor relatii intre parametrii de stare, in conditiile de echilibru.
Pentru caracterizarea echilibrului se utilizeaza marimile: concentratia (exprimata molar sau masic, ca fractie sau raport), presiunea partiala (pi) sau fugacitatea (fi), ultimele doua dependente de concentratiile fazelor. La echilibru, aceste marimi devin egale:
![]() sau
sau ![]() (2)
(2)
Atunci cand intre cele doua faze in contact exista o anumita diferenta de presiuni partiale sau de fugacitate, intre faze are loc un transfer de masa, din gaz in lichid,avand drept rezultat modificarea parametrilor de stare ai sistemului. In final, daca contactul dintre faze a fost sufficient de intim si sufficient de indelungat, starea este caracterizata de incetarea transportului net de substanta (component), iar parametrii de stare raman la valori constante.
In functie de natura fortelor intermoleculare, in gaz si in lichid, amestecurile pot fi ideale si neideale.
Pentru o solutie ideala, relatia de echilibru este data de legea lui Raoult:
![]()
![]()
![]() (3)
(3)
In care: Pi - presiunea de vapori a componentului i la temperature sistemului;
pi - presiunea partiala a componentului i in faza gazoasa;
yi, xi - fractia molara a componentului i in faza gazoasa si respective in faza lichida;
Ki -
Aceasta relatie se utilizeaza pentru amestecurile gazoase formate din vapori si gaz.
Pentru solutii neideale, echilibrul
gaz-lichid, la temperature
![]()
![]()
![]() (4)
(4)
In care Hi
este
Legea lui Henry este valabila pentru presiuni partiale mai mici decat 1 atm si concentratii mici, dar nu foarte mici, ale fazei lichide. Relatia de echilibru redata de legea lui Henry, ecuatia (4), se poate reda si sub forma exprimarii concentratiei ca raport molar:
![]() (5)
(5)
Datorita domeniului restrans de valabilitate al relatiilor de echilibru prezentate este indicat ca in calculele de dimensionare a utilajelor de absorbtie sa se utilizeze date de echilibru obtinute din determinari experimentale, date ce sunt prezentate in literature sub forma de tabele, grafice (diagrame sau monograme) sau ecuatii empirice.
In cazul absorbtiei monocomponent izoterma si daca presiunea totala a sistemului nu variaza sensibil (datorita absorbtiei insasi si rezistentei dispozitivelor interne de contactare din utilajul de absorbtie), operarea se poate considera izoterma (la p=ct) si valoarea constantei de echilibru, Ki sau mi, pentru fiecare component, ramane aceeasi in lungul utilajului.
In cazul in care absorbantul este un amestec lichid, componentul dizolvat in lichidul principal influenteaza valoarea constantei de echilibru. De exemplu, pentru o concentratie a H2S in faza gazoasa, pi=0.2 barr, fractia molara la echilibru in faza lichida,, solutie apoasa de dietanolamina (DEA), este xi=0.38, pentru o solutie apoasa de DEA de 50% gv, si repectiv xi=0.56, pentru o solutie apoasa de DEA de concentratie 20.5% gv.
Cand in procesul de absorbtie, prin alegerea absorbantului corespunzator, se urmareste separarea simultana si selective a doi componenti din amestecul gazos, echilibrul gaz-lichid pentru unul din componenti este influentat de concentratia celuilalt component dizolvat in absorbent.
De exemplu, pentru eliminarea simultana si selectiva a H2S si CO2 din gazelle reziduale se utilizeaza ca absorbent solutia apoasa de DEA de concentratie 20.5% gv la temperature de 25oC.
Pentru o concentratie in faza
gazoasa ![]() barr , concentratia la
echilibru in faza lichida este
barr , concentratia la
echilibru in faza lichida este ![]() , daca absorbantul este lipsit de H2S, si
respective
, daca absorbantul este lipsit de H2S, si
respective ![]() daca absorbantul are o
concentratie
daca absorbantul are o
concentratie ![]() .
.
Spre deosebire de operatia de rectificare, unde amestecul de separate defineste implicit ambele faze intre care are loc transferal de masa (difuzie echimolara in contracurent), in cazul absorbtiei (difuzie peste un strat de inert), faza lichida adaugata (absorbantul) poate fi selectata, cu exceptia situatiilor in care se doreste din motive tehnologice obtinerea unei anumite solutii a componentului absorbit (HCl, HNO3, etc.) (fluxurile B de faza gazoasa).
Alegerea absorbantului se face pe baza urmatoarelor considerente:
Solubilitatea gazului. Aceata trebuie sa fie ridicata pentru a se obtine solutii de concentratie mare, ceea ce implica reducerea consumului de absorbent si a celui energetic pentru operatia de desorbtie (abur), in cazul ca gazul absorbit este valoros si se doreste obtinerea lui; in general, absorbantul se alege dintre substantele de natura chimica apropiata cu cea a gazului solubil;
Volatilitatea absorbantului. La temperature de lucru aceasta trebuie sa fie mica pentru a diminua pierderile cu gazul care iese din utilajul de absorbtie;
Vascozitatea absorbantului. Trebuie sa fie redusa pentru a permite operarea la viteze mari cu consum relative redus de energie de pompare;
Absorbantul trebuie sa fie neinflamabil, netoxic, necorosiv, termostabil, sa aiba temperatura de congelare scazuta, ieftin si usor de procurat.
2. METODE DE DIMENSIONARE A UTILAJELOR
DE ABSORBTIE
Dimensionarea de proces a utilajelor de absorbtie consta in determinarea:
o Diametrul coloanei, din considerente hidrodinamice;
o Numarul de trepte de contact sau a inaltimii stratului de contactare (umplutura), necesar realizarii separarii impuse, din considerente de cinetica a transferului de masa;
o Inaltimea coloanei, din considerente constructive.
Absorbtia poate avea loc in utilaje cu contactare in trepte (coloane cu talere) sau in utilaje cu contactare diferentiala (coloane cu umplutura).
In cele ce urmeaza se trec in revista metodele de dimensionare pentru absorbtia monocomponent izoterma.
2.1. Dimensionarea coloanelor cu talere
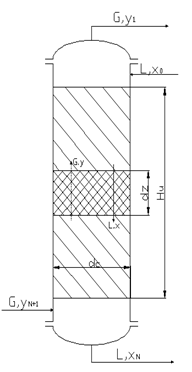
 In fig.1. este prezentat modelul fizic
al unei coloane de absorbtie cu talere. In ipoteza ca echilibrul gaz-lichid
este redat de legea lui Henry, prin cele doua modalitati de exprimare a
concentratiei, fractie molara (xn, yn) si respective
raport molar (Xn, Yn), setul celor doua relatii, relatia
de echilibru si cea de operare, se poate exprima astfel:
In fig.1. este prezentat modelul fizic
al unei coloane de absorbtie cu talere. In ipoteza ca echilibrul gaz-lichid
este redat de legea lui Henry, prin cele doua modalitati de exprimare a
concentratiei, fractie molara (xn, yn) si respective
raport molar (Xn, Yn), setul celor doua relatii, relatia
de echilibru si cea de operare, se poate exprima astfel:
(*) 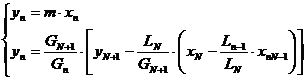
In care RE este o dreapta si RO o curba (Gn, Ln-1 - variabile).
(**) 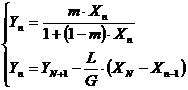
In care RE este o curba si RO este o dreapta.
Intrucat absorbtia se utilizeaza
pentru separarea unui component dintr-un amestec gazos cand acesta este in
concentratii relativ mici (comparative cu inertul) se prefera calculul
utilizand rapoartele molare, cand RO este o dreapta si cand RE, pentru domeniul
de operare, poate fi asimilata cu o dreapta: ![]() .
.
a) Calculul diametrului coloanei, dc
![]() In mod obisnuit diametrul coloanei se determina in functie de
debitul de gaz cu relatia:
In mod obisnuit diametrul coloanei se determina in functie de
debitul de gaz cu relatia:
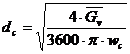 in
care:
in
care:
![]() este valoarea medie a
debitului de gaz in coloana:
este valoarea medie a
debitului de gaz in coloana:
![]() [Nm3/h],
[Nm3/h],
Iar wc este viteza gazului in coloana [m/s], care reprezinta:
![]()
wa fiind viteza maxima admisibila a gazului in sectiunea libera a coloanei, la care incepe antrenarea lichidului de pe talere, deci inecarea coloanei, calculata cu relatia:
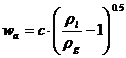
In care constanta dimensionala c [m/s], coeficientul de viteza sau de capacitate, depinde de tipul de taler, de distanta dintre talere (H), de densitatile fazelor si de tensiunea superficiala a lichidului (σ).
Aceasta
relatie este valabila pentru 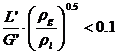 , in care L' si G' sunt debitele masice ale fazelor, si
, in care L' si G' sunt debitele masice ale fazelor, si ![]() dyn/cm.
dyn/cm.
O relatie mai generala este cea a lui Fair-Mathews:
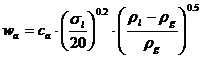
In
care ca, pentru diferite tipuri de talere, functie de parametrul de
curgere 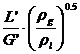 rezulta din grafice
specifice (L', G' reprezinta debitele masice ale fazelor).
rezulta din grafice
specifice (L', G' reprezinta debitele masice ale fazelor).
Orientativ, viteza gzului in coloana are valorile:
(0.05 - 0.1) m/s pentru coloane operate la presiune atmosferica;
(0.1 - 0.4) m/s pentru cele sub presiune;
(2 - 4) m/s pentru coloane operate in vid.
In cazul coloanelor care functioneaza cu debite mari de lichid absorbent (debitul de lichid variind mai putin in lungul coloanei) si cu un continut relativ ridicat de component solubil in amestecul gazos, diametrul coloanei se determina pe baza debitului de lichid din relatiile peste pragul deversor al talerului.
Deoarece lichidul de pe taler este intr-o puternica agitare, alimentarea deversorului se face de fapt cu o spuma [suspensie gaz(bula)-lichid(film)], de aceea in deversor trebuie sa se asigure un timp suficient de stationare pentru separarea lichidului din spuma (spargerea spumei), in caz contrar existand pericolul ca amestecul din deversor san u asigure o inchidere hidrauluica perfecta si o parte din gaz sa circule spre talerul superior prin deversor, diminuand eficacitatea talerului, si in acelasi timp, gazul de pe talerul superior sa fie antrenat mecanic de lichid spre talerul inferior, impurificand lichidul de pe acest taler. Alkinson recomanda pentru viteza lichidului in deversor valorile: 0.0635, 0.085 si 0.106 m/s, functie de distanta dintre talere (H), si anume: 0.45, 0.6 si 0.7 m.
Cunoscand viteza lichidului in sectiunea de deversare se poate calcula aria de deversare din ecuatia continuitatii:
![]()
In cazul in care se folosesc deversoare circulare (deversor cu tub deversor) experienta arata ca aria de deversare nu trebuie sa depaseasca 10-15% din aria sectiunii libere a coloanei.
Deci:
![]() , rezultand diametrul coloanei dupa sarcina maxima de lichid,
adica la baza coloanei, unde solutia este in component, cand
, rezultand diametrul coloanei dupa sarcina maxima de lichid,
adica la baza coloanei, unde solutia este in component, cand ![]()
In cazul cand se folosesc deversoare de tip curba, experienta arata ca lungimea pragului deversor (corzii), lp, nu trebuie sa depaseasca 0.8dc.
Deci, se procedeaza astfel:
Se fixeaza o valoare pentru ![]() , aproximand dc din sarcina maxima de gaz (la baza
coloanei cand
, aproximand dc din sarcina maxima de gaz (la baza
coloanei cand ![]() ) cu o viteza in coloana wc luata in domeniul recomandat, functie de
regimul de operare al coloanei (p).
) cu o viteza in coloana wc luata in domeniul recomandat, functie de
regimul de operare al coloanei (p).
Se calculeaza unghiul la centru, φ, din relatia:
![]()
Se calculeaza diametrul coloanei dupa sarcina
maxima de lichid (![]() ) din relatia:
) din relatia:
![]()
Pentru o proiectare corecta, se recomanda calculul dc in functie de ambele sarcini maxime de faza, de exemplu, pentru coloane cu diametrul mare, se calculeaza mai intai dupa sarcina maxima de lichid si apoi se verifica cu relatiile pentru sarcina maxima de gaz.
b) Determinarea numarului de talere (trepte de contact) reale
Numarul treptelor reale de contact (NR) se poate determina direct sau indirect, functie de natura ecuatiilor ce stau la baza dimensionarii, si anume:
Dimensionarea la echilibru, care determina numarul de trepte teoretice de contact (talere teoretice), NT, deci metoda indirecta, si apo determinarea NR, considerand abaterea de la echilibru exprimata ca eficienta a talerului sau eficienta globala a coloanei:
Dimensionarea pe baza cineticii transferului de masa, care determina concentratiile reale ale celor doua faze pe fiecare taler, diferite de concentratile de echilibru, si implicit,numarul de talere reale, NR, deci metoda indirecta.
Metodele de dimensionare, din punct de vedere al gradului de incredere, se pot clasifica in:
Metode simplificate, aproximative, in care RO este redata de ecuatia de conservare a masei (ecuatia de bilant de materiale) prin considerarea constantei debitelor celor doua faze in lungul coloanei;
Metode riguroase, exacte, in care Ro este redata atat de ecuatia de conservare a masei cat si a energiei ( ecuatii de bilant de materiale si termic)
In
functie de modul de exprimare, metodele de dimensionare se clasifica in grafice
si analitice. Alegerea metodei din acest punct de vedere se face in functie de
datele de echilibru, daca acestea pot fi redate sau nu printr-o relatie
analitica de forma generala: ![]() sau
sau ![]() .
.
In cazul absorbtiei monocomponent izoterma, prin utilizarea rapoartelor molare ca mod de exprimare a concentratiilor, toate metodele sunt riguroase, RO rezultand doar din ecuatia de bilant de materiale, deoarece debitele molare de gaz inert, G, si respective de lichid absorbent lipsit de component solubil, L, sunt realmente constante in lungul coloanei.
(*) Dimensionarea la echilibru
- Metoda analitica progresiva.
Consta in aplicarea pentru fiecare taler, pornind din varful coloanei, a urmatorului set de relatii:
RE: ![]()
RO: ![]()
Se dau (date cunoscute, de calcul):
GN+1, yN+1, y1, L0, x0.
Aplicand RE se calculeaza compozitia lichidului, X1, ce curge pe
talerul 1, in echilibru cu concentratia gazului, Y1, ce paraseste
acest taler; concentratia Y2 in gazul ce se ridica de pe talerul 2
rezulta din aplicarea RO. Calculul se continua pana cand compozitia gazului ![]() , valoarea NT fiind egala cu numarul de RE
aplicate.
, valoarea NT fiind egala cu numarul de RE
aplicate.
Aceasta metoda este aplicabila
pentru solutii diluate (concentratii relative mici ale componentului solubil in
cele doua faze), cand marimea m din RE poate fi considerate
- Metoda analitica cu ecuatie unica
Este
numita si metoda factorului de
absorbtie, aplicabila pentru concentratii mici, cand linia de echilibru este
sau poate fi considerate o dreapta, descrisa de relatia: ![]()
Ecuatia unica de calcul a NT, ingloband atat RE cat si RO scrise pentru fiecare taler, poarta denumirea de ecuatia Kremser-Brown-Saunders:
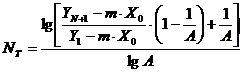
In
care 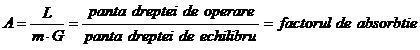 . In cazul particular A=x, cand DE este paralela cu DO, relatia
devine:
. In cazul particular A=x, cand DE este paralela cu DO, relatia
devine: ![]()
In mod curent se opereaza cu valori
ale factorului de absorbtie: ![]() .
.
- Metoda grafica
Reprezinta transpunerea grafica a relatiilor de echilibru si de operare, sub forma liniei (curbei sau dreptei) de echilibru si a dreptei de operare, si consta in trasarea liniei in trepte, in intervalul YN+1-Y1 (X0-XN), intre curba de echilibru si dreapta de operare.
Relatia
de operare sescrie sub forma: ![]() , reprezentand o dreapta de panta
, reprezentand o dreapta de panta ![]()
Intrucat
debitul de lichid absorbent ![]() , debitul minim de lichid absorbent se poate calcula cu
relatia:
, debitul minim de lichid absorbent se poate calcula cu
relatia:
![]()
In
cazul cand lichidul absorbant este lipsit de component solubil si se specifica
concentratia solutiei la iesirea din coloana ca fractie din cea maxim posibila,
cea de echilibru, se poate calcula debitul de lichid absorbent cu relatia: ![]() .
.
Metoda grafica este singura posibilitate cand datele de echilibru nu pot fi exprimate print-o relatie analitica.
In
cazul absorbtiei monocomponent, chiar cu exprimarea concentratiilor ca rapoarte
molare, se poate discuta de metoda analitica progresiva riguroasa doar daca
temperature nu este
In acest caz, se selecteaza datele initiale cele mai convenabile ca: debitul, compozitia si temperatura gazului bogat (Gn+1, yN+1, T G,N+1), debitul, compozitia si temperature absorbantului sarac (L0, x0, TL,0), presiunea din coloana (p), gradul de recuperare (absorbtie) a componentului (solutului) sau direct concentratia y1.
Etapele de calcul:
i) Din bilantul de materiale pe intreaga coloana se calculeaza concentratia solutiei la iesirea din coloana (absorbantului bogat):
![]()
ii) Se propune o temperature pentru gazul sarac de la varful coloanei:
![]()
iii) Se calculeaza temperature absorbantului bogat de la baza coloanei din ecuatia de bilant termic pe intreaga coloana:
 iv) In functie de temperature TL,N si concentratia
XN se citeste din grafic sau se calculeaza, din RE cu m
corespunzator lui TL,N, concentratia YN la echilibru cu XN.
iv) In functie de temperature TL,N si concentratia
XN se citeste din grafic sau se calculeaza, din RE cu m
corespunzator lui TL,N, concentratia YN la echilibru cu XN.
v) Din RO se determina concentratia lichidului pe talerul N-1, XN-1
vi) Din ecuatia de bilant termic pentru talerul (N-1) rezulta temperatura TL,N-1, prin incercari succesive.
![]() vii) Calculul se repeat din taler in taler pana cand Yn<Y1
iar temperature TG,1 rezulta din bilantul termic trebuie sa coincida
cu cea propusa la punctual (ii); in caz contrar, calculul se reia cu o noua
presupunere pentru TG,1. Determinarea NR se face
utilizand o eficienta
vii) Calculul se repeat din taler in taler pana cand Yn<Y1
iar temperature TG,1 rezulta din bilantul termic trebuie sa coincida
cu cea propusa la punctual (ii); in caz contrar, calculul se reia cu o noua
presupunere pentru TG,1. Determinarea NR se face
utilizand o eficienta ![]() .
.
(**) Dimensionarea pe baza cineticii transferului de masa
Numarul de talere reale (trepte de contact), NR, se obtine direct prin considerarea impreuna cu relatiile de echilibru si de operare, a relatiilor de cinetica a transferului de masa.
![]()
![]() sau
sau ![]()
Valoarea fortei motoare medii depinde de ? curgerii fazelor pe taler:
- Modelul amestecarii perfecte pentru faza lichida
- Modelul curgerii tip piston pentru faza gazoasa
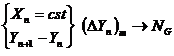
- Modelul amestecarii perfecte pentru faza gazoasa
- Modelul curgerii tip piston pentru faza lichida
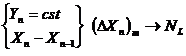
In cazul primei variante:
![]() [RE]
[RE]

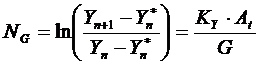
Pentru calculul analitic, relatia de cinetica a transferului de masa se poate explicita sub forma:
![]()
Pentru metoda analitica, relatia de cinetica a transferului de masa se poate scrie sub forma:
![]() , in care diferentei de concentratie se asociaza segmente.
, in care diferentei de concentratie se asociaza segmente.
- Metoda analitica progresiva - consta in aplicarea RE, RO si RC pentru fiecare taler, asemanator (*).
- Metoda grafica
Consta in trasarea RC in diagrama de echilibru, linia de cinetica (curba sau dreapta daca KY este constant in lungul coloanei, deci in intervalul de separare impus) fiind localizata intre linia de echilibru si dreapta de operare, numarul de talere reale rezultand din trasarea liniei in trepte intre dreapta de operare si linia cinetica.
Utilizarea metodelor de dimensionare pe baza cineticii transferului de masa implica calculul c.t.t.m:
 ;
; 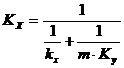
Rezulta ca, pentru gazele foarte
solubile rezistenta totala la transferal de masa este practice egala cu
rezistenta in filmul de gaz (KY=ky), iar pentru gazele
greu solubile, rezistenta la transferal de masa este localizata in filmul de
lichid ![]() .
.
Experimental s-a constatat ca, chiar in cazul gazelor cu solubilitate mare, rezistenta filmului de lichid nu poate fi neglijata complet. De exemplu, in cazul absorbtiei NH3 in apa, mai mult de 20% din rezistenta totala se datoreaza filmului de lichid.
Rezulta ca o importanta deosebita in procesul de absorbtie il are valoarea constantei Henry, solubilitatea descreste cu temperature sit aria ionica (I).
![]() ;
; ![]()
Valoarea numerica a solubilitatii determina in mare masura importanta rezistentei filmului de gaz in transferal de masa.
Pentru o estimare rapida a acestui lucru se poate utiliza urmatoarea relatie dedusa pe baza teoriei penetratiei:
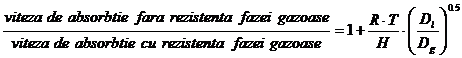
Valorile coeficientilor partiali de transfer de masa, cptm, se determina din relatii criteriale, empirice (deduse din date experimentale), prezentate in literature.
In plus, pentru coloanele cu talere, se prezinta urmatoarele relatii:
- coeficientul partial de transfer de masa (cptm) in filmul de gaz, kg.
Andrew, pentru talerele cu clopotei,
propune: 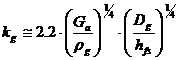 , in care Ga este debitul masic raportat la aria
efectiva a talerului (aria sectiunii libere a coloanei - 2 aria deversorului)
si hfs este inaltimea, in m, a fantei submersata in lichidul de pe
taler. Pentru alte tipuri de talere, hfs se poate inlocui cu 0.5 din
inaltimea stratului de amestec lichid-gaz (stratul de spuma) de pe taler.
, in care Ga este debitul masic raportat la aria
efectiva a talerului (aria sectiunii libere a coloanei - 2 aria deversorului)
si hfs este inaltimea, in m, a fantei submersata in lichidul de pe
taler. Pentru alte tipuri de talere, hfs se poate inlocui cu 0.5 din
inaltimea stratului de amestec lichid-gaz (stratul de spuma) de pe taler.
Asano, pentru acelasi tip de taler, propune:
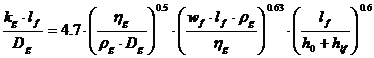
In care: lf - latimea fantei [m];
wf - viteza gazului in fanta (egala cu cea din gatul clopotului) [m/s];
h0 - inaltimea partii deschise din fanta prin care circula gazul [m];
hlf - inaltimea lichidului degazat de deasupra marginii superioare a fantei [m].
Pentru talere sita, Asano propune:
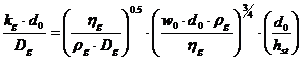
In care: d0 - diametrul orificiului [m];
w0 - viteza gazului in orificiu [m/s].
- coeficientul partial de transfer de masa (cptm) in filmul de lichid, kl.
Andrew, pentru coloanele cu
clopotei, propune: 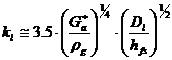 , adica
, adica 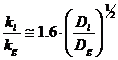 .
.
Asano propune, pentru talerele cu clopotei relatia:
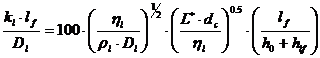 .
.
Pentru talerele sita, Asano propune:
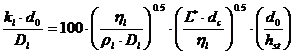
De regula cptm iau valori intre urmatoarele limite:
- ![]() m/s
m/s
- ![]() m/s
m/s
c) Determinarea inaltimii coloanei
Inaltimea, Ic, a coloanei de absorbtie cu talere se calculeaza cu relatia:
![]()
In care: H - distanta dintre talere [m];
(1m+1m) - distante libere sub ultimul taler (N) si deasupra primului taler (1) pentru a se asigura distributia gazului si inchiderea hidraulica si respective pentru separarea (prin sedimentare sau prin import cu sicane) fazei lichide antrenata de gaz;
Hf, hc - inaltimea fundului si respectiv a capacului coloanei [m].
 2.2
Dimensionarea coloanelor cu umplutura
2.2
Dimensionarea coloanelor cu umplutura
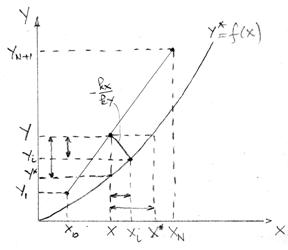 Se prezinta modelul fizic al unei
coloane de absorbtie cu umplutura si reprezentarea absorbtiei in diagrama de
echilibru.
Se prezinta modelul fizic al unei
coloane de absorbtie cu umplutura si reprezentarea absorbtiei in diagrama de
echilibru.
a) Calculul diametrului coloanei, dc
Diametrul coloanei cu umplutura se calculeaza din conditia punctului de inecare a coloanei (functie de viteza de inecare a fazelor).
In apropierea vitezei de inecare, performanta coloanei este mai mare datorita bunei umectari a umpluturii si distributiei mai uniforme a gazului.
Totusi, in proiectare se considera o
viteza admisibila a gazului de ![]() sau
sau ![]() din viteza de inecare,
functie de relatia de calcul a vitezei de inecare.
din viteza de inecare,
functie de relatia de calcul a vitezei de inecare.
Cele mai des utilizate metode si relatii pentru calculul vitezei de inecare sunt: metoda Hoffing - Lockhardt (relatie completata cu o diagrama) si metoda Kafarov.
Metoda Kafarov, bazata pe prelucrarea datelor experimentale obtinute in cazul coloanelor cu umplutura din inele Rasching, utilizeaza relatia:
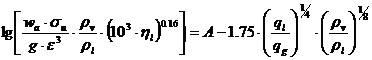
In care: σu - suprafata specifica a umpluturii [m2/m3];
wa - viteza de inecare [m/s]
ηl - vascozitatea lichidului [kg/ms]
ql, qg - vitezele masice ale celor doua faze [kg/m2h]
A=0.22 pentru absorbtie si respectiv 0.125 pentru desorbtie.
![]()
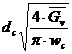
Pentru a se evita tendinta de canalizare si de iesire a lichidului din umplutura spre peratii coloanei alegerea dimensiunii umpluturii trebuie sa tina seama de conditia:
![]()
b) Determinarea inaltimii umpluturii
(*) Dimensionarea la echilibru
Calculul inaltimii stratului de umplutura necesar separarii impuse se face utilizand metoda inaltimii echivalente:
![]()
In care: Nt - se determina prin una din metodele prezentate la 2.1;
Ht - se calculeaza cu ajutorul unor relatii empirice, in functie de caracteristicile umpluturii, debitelor celor doua faze in contracurent si proprietatile fizice ale acestora.
Relatia lui Ellis:
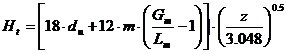
In relatia lui Ellis ![]() , Hu se propune si prin incercari succesive, pana
cand
, Hu se propune si prin incercari succesive, pana
cand ![]() este egala cu cea
propusa, se determina inaltimea echivalenta a talerului teoretic.
este egala cu cea
propusa, se determina inaltimea echivalenta a talerului teoretic.
(**) Dimensionarea pe baza cineticii transferului de masa
Cinetica transferului de masa se poate exprima direct, prin coeficientii de transfer de masa, sau indirect, prin numarul unitatilor de transfer.
Debitul molar de component A, dnA, transferat pe elemental de inaltime dz rezulta din relatiile:
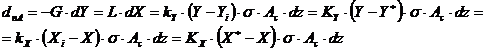
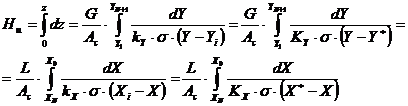
In relatia de mai sus, coeficientii
de transfer reprezinta valorile locale, calculate pentru difuzia peste un strat de inert, iar σ
reprezinta aria suprafetei de contact (de transfer de masa) raportata la un m3
de umplutura, adica aria suprafetei udate a umpluturii (![]() ).
).
Valorile concentratilor la interfata, Xi, Yi, se determina graphic, la intersectia cu curba de echilibru a dreptelor de panta -kX/kY duse de pe dreapta de operare, sau analytic utilizand relatiile:
 , pentru diverse valori date lui X in intervalul
, pentru diverse valori date lui X in intervalul ![]() .
.
Cazuri particulare
- cptm valori medii pe coloana:
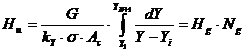
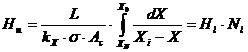
- cptm constante in lungul coloanei si CE poate fi asimilata cu o dreapta, deci cptm constant in lungul coloanei:
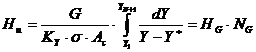
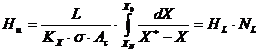
In acest caz, inaltimea umpluturii se obtine direct din relatiile de forma:
![]()
In cazul in care CE nu poate fi asimilata cu o dreapta pentru intreg domeniul de separare, se imparte coloana in mai multe zone pe care se poate face aproximatia amintita.
In cazul cand ![]() , se poate utiliza si o metoda combinata:
, se poate utiliza si o metoda combinata:
 sau
sau ![]() , deoarece
, deoarece ![]() , cand DO DE.
, cand DO DE.
In cazul utilizarii coloanelor cu umplutura o problema deosebita o ridica cunoasterea valorii ariei interfaciale efective, σ.
Valorile relative ale ariei interfaciale effective:
- aria
geometrica a umpluturii sau aria uscata, σu ![]()
- aria udata sau
irigata, σ1 ![]()
- aria efectiva
in absorbtia controlata de faza lichida, σ ![]()
- aria efectiva
in absorbtia controlata de faza gazoasa, σ![]()
- aria efectiva
in absrorbtia insotita de reactie chimica, ![]()
Pentru calculul ariei interfaciale effective, in cazul lichidelor organice si a apei, Semmelbauer a propus relatia:
![]()
In care:
β=0.0061 pentru inele Raschig si 0.0076 pentru sei Berl
![]() ;
; ![]() , [σl]=N/m2.
, [σl]=N/m2.
Aceasta relatie are urmatoarele limite de aplicabilitate:
- pana la punctual de inecare al coloanei
- pentru: ![]()
![]()
![]()
- pentru: ![]()
![]()
![]() .
.
Aria udata, σ1, in absenta efectului Marangoni (σl), aceasta depinde de viteza lichidului se de proprietatile fizice ale acestuia.
Dupa Hoftyzer este posibil ca mai mult de jumatate din debitul de lichid sa curga peste numai 5% din suprafata umpluturii, σu, iar pe de alta parte, la debitul integral de lichid, numai 50% din σu, este irigata. Sub o anumita viteza a lichidului, aria udata scade, in timp ce viteza gazului nu influenteaza aceasta arie
Pentru estimarea rapida a ariei
udate se poate folosi relatia: ![]() .
.
Deoarece debitul de inecare a
coloanei este aproximativ invers proportional cu suprafata specifica a
umpluturii, ![]() , folosirea unor umpluturi fine de mare eficacitate duce la
scaderea rapida a productivitatii coloanei.
, folosirea unor umpluturi fine de mare eficacitate duce la
scaderea rapida a productivitatii coloanei.
c) Calculul inaltimii coloanei
Pentru a se asigura o
distributie uniforma a lichidului pe umplutura si pentru a evita curgerile prin
canale preferentiale, stratul de umplutura necesar separarii impuse se divide
in substraturi de inaltime cuprinsa in domeniul ![]() ; intre aceste substraturi de umplutura se introduce
redistribuitoare de lichid.
; intre aceste substraturi de umplutura se introduce
redistribuitoare de lichid.
Din aceste motive, inaltimea coloanei cu umplutura se calculeaza cu relatia:
![]()
3. SCHEME TEHNOLOGICE DE SEPARARE PRIN ABSORBTIE
In operatile de absorbtie intalnite in practica industriala unde are loc separarea unuia sau mai multor componenti dintr-un gaz (gaz bogat) intr-un lichid (..sau amestec) numit absorbent, in urma procesului de absorbtie rezulta, conform schemei, un gaz sarac si un absorbant bogat, ultimul fiind trimis la o coloana de desorbtie sau stripare in scopul regenerarii absorbantului si recuperarii componentelor absorbite in prima coloana.
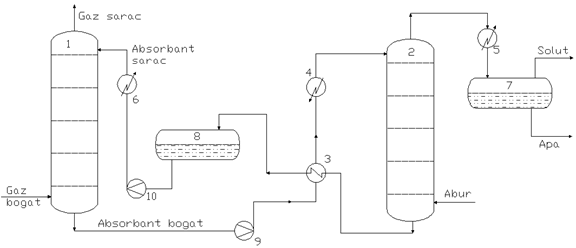
Fig. Schema tehnologica generala a unui process de separare prin absorbtie
1 - coloana de absorbtie; 2 - coloana de stripare; 3 - racitor-incalzitor; 4 - incalzitor absorbent bogat; 5 - condensator-racitor; 6 - racitor absorbent sarac; 7 - vas separare solute; 8 - vas stocare (tampon) absorbent sarac; 9 - pompa alimentare absorbent bogat; 10 - pompa alimentare absorbent sarac.
In cele mai multe cazuri, pentru realizarea procesului de absorbtie-desorbtie se folosesc coloane cu talere de diverse tipuri: talere cu clopotei, talere perforate (sita), talere cu supape, etc.
a) Procedeul de separare a CO2 din gaze prin absorbtie in apa
Este primul procedeu de purificare a
gazelor cu presiuni ridicate si concentratii mari de CO2, cum sunt
gazele de la sinteza amoniacului si unele gaze de zacamant cu presiuni de ![]() atm, care uneori
contin intre 30-90% gv CO2 (restul fiind metan, azot, etc.). El a
fost treptat inlocuit cu ale procedee mult mai eficiente, care folosesc absorbanti
cu solubilitate mult mai mare decat cea a apei si mult mai selectivi.
atm, care uneori
contin intre 30-90% gv CO2 (restul fiind metan, azot, etc.). El a
fost treptat inlocuit cu ale procedee mult mai eficiente, care folosesc absorbanti
cu solubilitate mult mai mare decat cea a apei si mult mai selectivi.
Cu toate acestea, in cazurile cand
presiunea partiala a CO2 este mai mare de 4 atm (de ex. in cazul
gazelor de la sinteza NH3, ![]() atm si concentratia CO2
este de 25% vol.) procedeul de absorbtie cu apa se mai foloseste datorita
urmatoarelor avantaje:
atm si concentratia CO2
este de 25% vol.) procedeul de absorbtie cu apa se mai foloseste datorita
urmatoarelor avantaje:
- simplitatea schemei tehnologice ( nu necesita schimbatoare de caldura, coloana de regenerare, refierbator si condensator);
- procedeul nu necesita consum de caldura;
- absorbantul este extreme de ieftin, nu reactioneaza cu CO2, O2 sau alte impuritati, prezinta o selectivitate evidenta pentru CO2 in amestec cu H2, N2, CH4, etc.
Procedeul prezinta urmatoarele dezavantaje:
- capacitate de absorbtie mica a apei fata de CO2, ceea ce necesita cantitati mari de absorbant, respective consum ridicat de energie pentru pompare;
- nu realizeaza grade mari de separare a CO2 si CO2 recuperat nu este de puritate avansata;
- in cazul gazelor de la sinteza NH3 conduce la pierderi mari de H2 si alti constituenti valorosi din fluxul gazos.
Schema tehnologica se concepe functie de scopul propus: purificarea gazului sau recuperarea si imbutelierea CO2 din gaz. De regula puritatea CO2 rezultat prin absorbtie in apa este direct legata de compozitia gazului supus purificarii si de gradul de separare (de absorbtie) a CO2 impus (dorit); cu cat gradul de absorbtie este mai mare (fixat), cu atat puritatea CO2 este mai mica.
Date comparative privind cheltuielile cu utilitati la recuperarea CO2 de puritate avansata din gaze de zacamant:
|
Conc. CO2 in gazul de alimentare |
Shema tehnologica adoptata |
Gradul de recuperare CO2 |
Cheltuielile cu utilitatile [lei/t CO2] |
|
80% vol. |
Fractionare - Absorbtie in apa - detenta |
96,4 |
53 |
|
Fractionare - absorbtie in solutie K2CO3 (calda) - stripare |
99,25 |
51 |
|
|
Absorbtie in apa - detenta |
90,08 |
115 |
|
|
60% vol. |
Absorbtie in apa - detenta |
92,65 |
165,9 |
|
Absorbtie in solutie K2CO3 (calda) - stripare |
96,81 |
173,8 |
|
|
30% vol. |
Absorbtie in apa - detenta |
86,59 |
218,2 |
|
Absorbtie in solutie K2CO3 (calda) - stripare |
94,08 |
181,8 |
In cazul schemelor tehnologice ce utilizeaza pentru recuperarea CO2 detenta, pentru recuperarea partiala a energiei necesara pomparii absorbantului, se prevede o turbina recuperatoare: turbine cu actiune (turbine Pelton) 50-60%; turbine cu reactiune (turbine Francis) 80%.
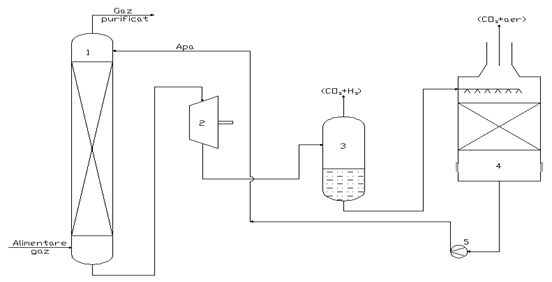
Schema tehnologica a procedeului de absorbtie in apa a CO2
1 - Coloana de absorbtie; 2 - Turbina recuperatoare de energie; 3 - Vas de degazare;
4 - Turn de degazare la presiune atmosferica; 5 - Popma de alimentare absorbent (apa).
Coloana de absorbtie (1) este cu
umplutura de inele Raschig confectionate din aluminiu, este operata la presiuni
de ![]() atm, substraturile de
umplutura sunt prevazute cu acelasi tip de corpuri de umplere, dar de
dimensiuni si materiale diferite (
atm, substraturile de
umplutura sunt prevazute cu acelasi tip de corpuri de umplere, dar de
dimensiuni si materiale diferite (![]() m,
m, ![]() , 3 substraturi,
, 3 substraturi, ![]() atm).
atm).
Turnul de degazare (4) este prevazut cu un strat de umplutura mult mai eficace decat simplul vas de detenta (3), operarea sa la presiunea atmosferica poate realize o eliminare practic completa a CO2 din apa.
Calculul de proces al coloanei de absorbtie (1), al vasului de detenta (3) si al turnului de degazare (4) necesita cunoasterea datelor de echilibru ale sistemului CO2 - H2O.
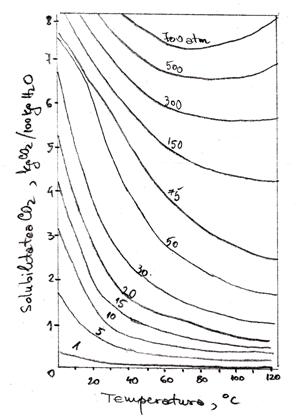
Solubilitatea pentru sistemul CO2 - H2O, functie de temperature si presiune
Studiile efectuate au aratat ca absorbtia CO2 in apa este controlata de rezistenta filmului de lichid. Din acest motiv, in literatura sunt prezentate relatii de calcul specifice pentru cptm in filmul de lichid:

![]() ;
; ![]() ;
; 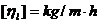 ;
; ![]()
![]() .
.
b) Procedeul de separare a SO2 prin absorbtie in apa
Bioxidul de sulf este putin solubil in apa, absorbtia in apa fiind insotita de o reactie de hidroliza, cu ecuatia globala:
![]()
Si de tendinta de hidratare conform reactiei:
![]()
Care creste cu descresterea temperaturii.
Absorbtia SO2 in H2O este controlata de rezistenta ambelor filme de fluide. Procedeul de recuperare a SO2 prin absorbtie in apa poate fi aplicat cu rezultate satisfacatoare numai in cazul gazelor cu un continut ridicat de SO2 (10-15%), in acest caz desorbtia SO2 se face prin stripare cu abur, SO2-ul stripat fiind uscat, comprimat si lichefiat.
Conform ecuatiei de hidroliza,
solutia apoasa reprezinta un amestec de echilibru format din SO2,
ioni de hidrogen si ioni de ![]() . Deci, solubilitatea SO2 in apa poate fi marita
prin reducerea concentratiei ionilor de hidrogen, lucru usor de realizat prin
adaugarea unei baze. Pe acest principiu se bazeaza precedeul Battersea, care
foloseste ca absorbent o solutie alcalina diluata, de regula se adauga o
cantitate foarte mica de carbonat de calciu sub forma de suspensie, procedeul
putand fi aplicat si pentru purificarea gazelor reziduale (de cocs) cu un
continut relative scazut de SO2 (0.05-3%).
. Deci, solubilitatea SO2 in apa poate fi marita
prin reducerea concentratiei ionilor de hidrogen, lucru usor de realizat prin
adaugarea unei baze. Pe acest principiu se bazeaza precedeul Battersea, care
foloseste ca absorbent o solutie alcalina diluata, de regula se adauga o
cantitate foarte mica de carbonat de calciu sub forma de suspensie, procedeul
putand fi aplicat si pentru purificarea gazelor reziduale (de cocs) cu un
continut relative scazut de SO2 (0.05-3%).
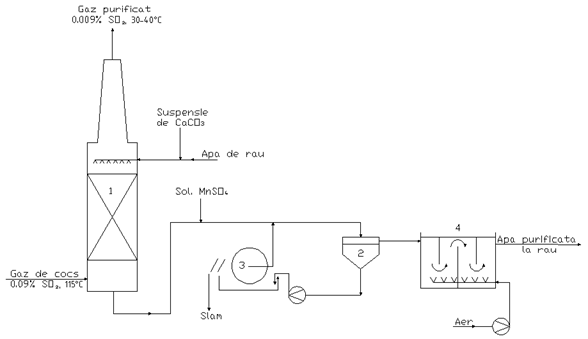
Schema tehnologica a procedeului Battersea
1 - Coloana de absorbtie; 2 - Decantor; 3 - Filtru rotativ; 4 - Reactor de oxidare.
Pentru o tona de gaze de ardere se utilizeaza 20 t apa de rau si 30 kg CaCO3. Reactia de oxidare cu aer, in reactorul (4), in scopul epurarii apei reziduale in vederea deversarii la canal sau in rau, se realizeaza in prezenta de catalizator, solutie apoasa de sulfat de Mn. Ratia de aer necesara reactiei este de 4.3 Nm3/1000Nm3 gaz.
c) Procedeul de separare a NH3 prin absorbtie in apa
Problema separarii NH3 din gaze prin absorbtie se pune atat in cazul unor fluxuri gazoase ce apar in procesul de fabricare prin sinteza a NH3 si in cazul gazelor de la hidrofinarea unor fractiuni petroliere dar mai ales in cazul gazelor rezultate in procesul de cocsificare si gazificare a carbunelui, acestea reprezentand inca o sursa importanta de (principala) de NH3.
In acest ultim caz, gazele mai contin pe langa NH3 si alti compusi cu azot (N2, HCN, oxizi de azot si piridine) in functie de natura carbunilor, temperatura de cocsificare, de cantitatea de vapori de apa adaugata, etc.
Concentratia componentilor cu azot in gazele tipice de cocserie:
-
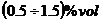 azot liber;
azot liber;
- 1.1% vol NH3;
-
![]() HCN;
HCN;
- 0.004% vol baze piridinice;
- 0.0001% vol oxizi de azot.
Prin absorbtia NH3 in apa, partial se elimina, HCN si oxizi de azot.
Amoniacul fiind un gaz foarte solubil in apa, el se poate separa cu usurinta prin absorbtie intr-o coloana cu talere sau cu umplutura folosind ca absorbent apa, obtinandu-se o solutie apoasa amoniacala concentrate sau diluata, in functie de compozitia gazului, presiunea din coloana, ratia de absorbent si numarul de talere, ce poate fi utilizata ca atare in diverse scopuri sau se supune fractionarii in scopul recuperarii NH3 pur.
Gazele de cocserie contin si anumite cantitati de gaze acide ca: HCl, H2S, HCN, CO2 si acizi organici; acesti acizi volatili reactioneaza cu NH3 in timpul racirii si condensarii partiale a gazului de la cocsificare formand saruri de amoniu (in principal clorura de amoniu), numite "saruri legate", care, ca urmare a solubilitatii lor in apa se separa partial in procesul de absorbtie, in timp ce sarurile de amoniu ale acizilor slabi (carbonatul si bicarbonatul, sulfura si hidrosulfura de amoniu), usor disociabile, sunt numite "saruri libere".
Pentru recuperarea NH3 din gaze se folosesc trei procedee:
- Procedeul indirect (Europa), se obtine o gama larga de produse: solutie apoasa amoniacala diluata si concentrate, NH3 pur, saruri de NH4 ale acizilor slabi si tari;
- Procedeul direct, se obtine un singur produs si anume, sulfatul de amoniu;
- Procedeul semidirect (USA), o combinatie a celor doua procedee anterioare, in care tot NH3 sau o parte din el se transforma in sarea de amoniu a unui acid tare, iar NH3 ramas nereactionat se prelucreaza conform procedeului indirect.
Se prezinta schema tehnologica a procedeului indirect de eliminare a NH3 din gazele de cocserie.
Schema tehnologica a procedeului indirect de separare a NH3 din gazele de cocserie
1 - Exhaustor; 2 - Filtru electric; 3 - Coloana primara de absorbtie; 4 - Coloana secundara de absorbtie; 5 - Rezervor tampon; 6 - Coloana de fractionare;
7 - Condensator partial; 8 - Reactor (saturator); 9 - Vas stocare lapte de var.
Gazul racit, preluat de exhaustorul (1), trecut prin filtrele electrice (2) pentru eliminarea cetii de gudron, se alimenteaza in cele doua coloane de absorbtie, primara (3) si secundara (4), legate in serie, in care circula in contracurent o solutie apoasa diluata de de NH3 si respective apa. De la varful coloanei secundare (4) gazul, practice lipsit de NH3, se trimite la instalatia de desulfurare. Solutia amoniacala diluata ce paraseste blazul coloanei primare (3) se uneste cu o parte din apa amoniacala de la faza de separare a gudronului din gazul de cocserie in rezervorul tampon (5), de unde este pompata la varful coloanei de fractionare (6), aportul de caldura in coloana efectuandu-se prin injectie direct cu abur la baza coloanei. In conditiile din coloana, sarurile de amoniu ale acizilor slabi din solutie (10 g/l saruri libere) se disociaza in partea de sus a coloanei, in timp ce "sarurile legate" ale acizilor tari (6 g/l saruri legate) se descompun in parte de jos a coloanei prin adaugare de lapte de var din vasul de stocare (9).
Vaporii de la varful coloanei (6), care contin NH3, gaze acide si vapori de apa, sunt condensati partial in condensatorul (7), unde condenseaza cea mai mare parte din vaporii de apa, apa condensate si saturate cu NH3 si gaze acide la temperatura de condensare fiind recirculata ca reflux la varful coloanei. Gazele necondensate sunt trimise la un sistem de reactie (saturator) (8) cu acid sulfuric, unde amoniacul din gaz este absorbit si transformat in sulfat de amoniu. Acest sistem de reactie este identic pentru toate cele trei procedee. Uneori, vaporii de la varful coloanei (6) sunt condensati si prelucrati in continuare in vederea obtinerii unei solutii amoniacale concentrate dar impure; se poate obtine si o solutie amoniacala concentrate pura daca inaintea condensarii vaporilor se separa gazele acide. Din baza coloanei (6) rezulta o apa reziduala lipsita de NH3, dar bogata in saruri de calciu, ce este eliminate la canalizare.
Avantajele procedeului:
- flexibilitatea procedeului, ceea ce confera obtinerea unei game largi de produse;
- independenta relativa a diferitelor faze ale procedeului;
- asigura o indepartare totala a gudronului din gaz.
Dezavantajul procedeului:
- necesitatea recircularii unor debite mari de solutii, ceea ce ridica cheltuielile de investitie si de operare (dimensiunile utilajelor, energie de pompare si consum mare de abur.
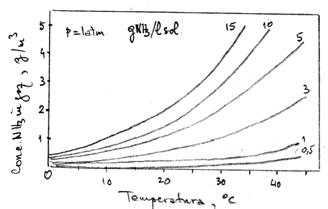
Date de echilibru pentru sistemul NH3 - H2O
Date de echilibru lichid - vapori (NH3 - H2O)
![]() atm
atm
|
t [°C] |
-33.2 |
-20 |
10 |
27.4 |
46.2 |
68.4 |
79 |
84.8 |
91.5 |
|
x |
1 |
0.667 |
0.416 |
0.344 |
0.21 |
0.102 |
0.061 |
0.041 |
0.021 |
|
y |
1 |
- |
0.996 |
0.98 |
0.921 |
0.739 |
0.555 |
0.421 |
0.232 |
![]() atm
atm
|
t [°C] |
18.5 |
39 |
100.9 |
123.7 |
149.3 |
160.5 |
166.5 |
172.8 |
|
x |
1 |
0.71 |
0.344 |
0.21 |
0.102 |
0.061 |
0.041 |
0.021 |
|
y |
1 |
0.998 |
0.922 |
0.809 |
0.544 |
0.367 |
0.26 |
0.14 |
Calduri diferentiale ale solutiilor de amoniac lichid:
|
Concentratia [% gr NH3] |
0 |
6 |
10 |
14 |
20 |
24 |
30 |
36 |
40 |
46 |
50 |
|
Caldura diferentiala [kJ/kg NH3 dizolvat] |
808 |
755 |
715 |
671 |
602 |
552 |
472 |
390 |
330 |
230 |
163 |
d) Procedeul Estasolvan
Este un procedeu care se poate utilize fie numai pentru eliminarea H2S din gaze foarte sarace in hidrocarburi C2+ (de ex. din gazul metan), fie pentru eliminarea H2S simultan cu absorbtia si recuperarea de hidrocarburi in cazul purificarii gazelor bogate cu continut mare de C2+.
Se bazeaza pe absorbtia fizica a H2S si a hidrocarburilor in tributilfosfat (TBF), (C4H9)3PO4, folosit ca absorbent.
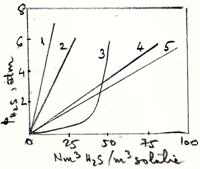
Date de echilibru
H2S - absorbent lichid; 1 - apa; 2 - hidrocarburi; 3 - sol DEA 20%; 4 - carbonat de propilena; 5 - TBF
Avantajele absorbantului utilizat:
- TBF are o mare putere de solubilizare a H2S si in general a compusilor cu sulf, deci de sulfurare a gazelor;
- TBF prezinta o mare selectivitate pentru H2S in prezenta de CO2, ceea ce permite o indepartare avansata a compusilor cu S, simultan cu o eliminare redusa a CO2; la gaze cu raport H2S/CO2 ridicat, procedeul pentru obtinerea unui gaz acid cu un continut redus de CO2, apt pentru obtinerea sulfului prin procedeul Claus;
- TBF permite absorbtia simultana a gazelor acide si a hidrocarburilor, absorbantul actionand ca un agent de purificare a gazelor dar si ca absorbent al hidrocarburilor, procedeul putand fi utilizat pentru desulfurarea atat a gazelor bogate cat si a celor sarace in hidrocarburi;
- TBF are densitate, vascozitate si presiune de vapori mici;
- TBF nu are tendinta de spumare, nu este toxic si se produce la scara industriala (plastifiant, solvent si agent antispumant)
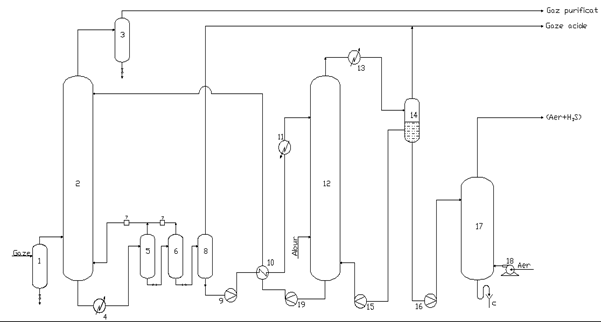
Schema tehnologica a procedeului ESTASOLVAN
pentru desulfurarea gazelor sarace in C2+
1 - Separator picaturi; 2 - Coloana de absorbtie; 3 - Vas detenta; 4 - Racitor;
5,6,8 - Vas degazare prin detenta; 7 - Compresor; 9,15,16,19 - pompa;
10 - Racitor - incalzitor; 11 - Incalzitor; 12 - Coloana de desorbtie;
13 - Condensator; 14 - Vas separare; 17 - Coloana de stripare; 18 - Suflanta.
Gazele impurificate cu H2S, dupa
trecerea prin vasul de separare de picaturi (1), sunt alimentate in coloana de
absorbtie (2) la ![]() atm. Pe la varful
coloanei este eliminate gazul purificat si apoi trecut in vasul de detenta (3)
si valorificat functie de compozitia sa.
atm. Pe la varful
coloanei este eliminate gazul purificat si apoi trecut in vasul de detenta (3)
si valorificat functie de compozitia sa.
Absorbantul bogat in H2S si metan
(<C2+) paraseste baza coloanei de absorbtie (2), se raceste in
racitorul (4) si intra apoi in doua trepte successive de degazare, (5) si (6),
prin detenta, in scopul eliminarii metanului absorbit in coloana (2) ca urmare
a pi ridicate a acestuia in gazul de alimentare. Mentinand in
treapta a doua de degazare (6) o anumita presiune (![]() atm) este posibil sa se reduca continutul de metan la 2% din
totalul gazului dizolvat in TBF. Gazul de la partea superioara a celor doua
vase de degazare (detenta) se comprima cu compresoarele (7) si se recircula in
coloana de absorbtie (2) sub punctual de introducere a gazului de alimentare.
atm) este posibil sa se reduca continutul de metan la 2% din
totalul gazului dizolvat in TBF. Gazul de la partea superioara a celor doua
vase de degazare (detenta) se comprima cu compresoarele (7) si se recircula in
coloana de absorbtie (2) sub punctual de introducere a gazului de alimentare.
Absorbantul bogat rezultat din vasul de detenta (6) se degazeaza in continuare in vasul de detenta (8) la presiunea atmosferica. Pe la partea superioara rezulta o parte din gazelle acide si putin metan, iar pe la partea inferioara absorbantul partial regenerat, care este poluat cu pompa (9), trecut prin schimbatorul de caldura (10) si preincalzitor (11) si apoi introdus la varful coloanei de desorbtie (12), desorbtia facandu-se prin injectare directa cu abur. Produsul de varf al coloanei de desorbtie (12) se condenseaza partial in condensatorul (13) si apoi alimentat in vasul separator (14) unde, pe la varf se separa gazul acid iar la baza condensatul, care o parte se alimenteaza cu pompa (15) la baza coloanei (12) si o parte, cu ajutorul pompei (16), in varful coloanei de stripare (17), striparea facandu-se cu aerul furnizat de suflanta (18). In acest mod se elimina complet H2S din condensate, amestecul de (aer+H2S) rezultat la varful coloanei de stripare (17) fiind utilizat la instalatia Claus.
Absorbantul complet regenerat de la baza coloanei (12) este preluat de pompa (19), trecut prin schimbatorul (10) si apoi introdus la varful coloanei de absorbtie(2). Prin racirea absorbantului bogat in racitorul (4) este posibila mentinerea unui nivel de temperature in vasul (8) sufficient de scazut incat solutia partial regenerate de la baza vasului (8) sa asigure in preincalzitorul (10) o racier suficienta a solutiei regenerate in coloana (12).
e) Procedeul Purisol
Este o licenta Lurgi (
Se disting trei cazuri de aplicare a acestui procedeu:
- reducerea continutului ridicat de CO2 din gaze la valori relative scazute;
- eliminarea globala a componentilor acizi pana la concentratii reziduale moderate, folosind pentru regenerarea absorbantului NMP un simplu vas de vaporizare prin detenta;
- eliminarea selectiva a H2S.
f) Procedeul Selexol
Licenta Allied Chemical Corp., se aplica pentru eliminarea compusilor cu sulf si a CO2 din diverse surse de gaze (gaze de cocserie, gaze de rafinarie si gaze naturale) prin absorbtie fizica in dimetileterpolietilenglicol, denumit commercial absorbent Selexol.
Absorbantul are o mare capacitate de absorbtie pentru compusii cu sulf fiind capabil sa actioneze in acelasi timp si ca agent de deshidratare.
Se obtin gaze purificate sub 1 ppm sulf total si un continut de apa de 0.112 g/Nm3.
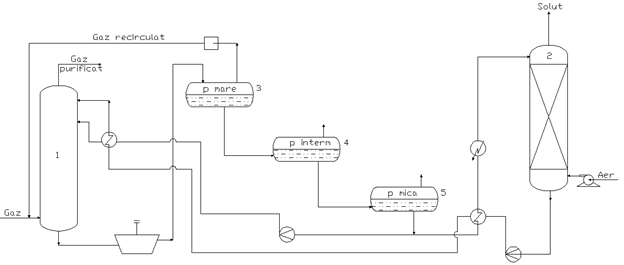
Schema tehnologica a procedeului SELEXOL
1 - Coloana de absorbtie; 2 - Coloana de desorbtie; 3,4,5 - Vas degazare.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |