COROZIUNEA GENERALIZATA
1. Generalitati
Coroziunea generalizata sau uniforma este forma cea mai des intalnita de coroziune, care este caracterizata printr-un atac chimic sau electrochimic care afecteaza intreaga suprafata expusa in mediu. In timp, metalul supus acestui tip de coroziune se subtiaza si eventual se rupe. Principala ei caracteristica este faptul ca reactia sau procesul de coroziune implicat decurge cu o viteza aproximativ constanta pe intreaga suprafata a materialului metalic expus intr-un mediu dat. Acest tip de coroziune apare fie cand pe suprafata metalului exista un strat superficial protector care s-a format in mod natural, fie cand metalul se dizolva complet in urma expunerii intr-un mediu coroziv. In urma expunerii metalului intr-un anumit mediu coroziv, este probabil ca suprafata lui sa se acopere cu produsi de coroziune, care, pot avea un caracter mai mult sau mai putin protector fata de metalul de baza. Cand ei sunt neprotectori fata de metalul de baza, metalul se va afla intr-o stare activa in mediul apos respectiv.
In general, coroziunea generalizata se produce pe suprafete metalice omogene din punct de vedere al compozitiei chimice si microstructurii, astfel incat accesul ionilor din mediu la metalul de baza sa fie uniform si nerestrictionat. Orice gradient in concentratia speciilor din mediu sau variatii aparute in compozitia acestuia pot schimba modul de degradare al metalului si implicit nu va mai avea loc o coroziune uniforma. Principala caracteristica a coroziunii generalizate sau uniforme este faptul ca procesul de dizolvare al metalului (reactia anodica) ca si alte reactii de reducere asociate (de exemplu a ionilor de oxigen sau hidrogen) au loc in locuri aleatoare de pe suprafata metalica, imprastiate la intamplare pe intreaga suprafata expusa.
Examinata la nivel micro, coroziunea generalizata consta intr-un complex de reactii electrochimice care au loc intre zonele microanodice si microcatodice locale adiacente.
In majoritatea mediilor apoase aflate la temperaturi si presiuni ridicate, indiferent de pH-ul lor, procesele care au loc sunt de natura electrochimica, ele constand in doua sau mai multe reactii partiale care implica un transfer de electroni sau sarcini. Pentru ca o reactie electrochimica sa aiba loc, este necesara prezenta unui anod, a unui catod, a electrolitului si inchiderea circuitului electric. De exemplu, in cazul coroziunii uniforme care are loc la interfata metal/ mediu acid, au loc urmatoarele reactii:
M Mn+ + ne- (1) reactia de oxidare anodica concomitent cu
2H+ + 2e- H2 (2) reactia de reducere catodica.
Dupa cum se observa din ecuatiile reactiilor de mai sus, coroziunea are loc la anod, unde metalul sau aliajul este oxidat, fapt care cauzeaza dizolvarea totala sau partiala a anodului.
Alte reactii posibile in acest sistem electrochimic metal/ mediu apos pot fi:
O2 + 4H+ + 4e- 2H2O (3) reactia de reducere a oxigenului in solutii acide
O2 + 2H2O + 4e- 4OH- (4) reactia de reducere a oxigenului in solutii neutre sau bazice
Fe3+ + e- Fe2+ (5) reactia de reducere a fierului
Fe2+ +2e- Fe (6) reactia de depunere a Fe.
Curentul total care "curge" intre aceste zone este denumit curent de coroziune, care poate fi convertit in pierdere de metal, aplicand legea lui Faraday:
![]() (1) in care:
(1) in care:
m[mg]-masa de substanta depusa sau eliberata in solutie; Q[C]-cantitatea de electricitate care trece prin electrolit; i[A]-curentul electric care trece prin electrolit; t[s]-timpul; k-echivalentul electrochimic al substantei depuse care are expresia (2):
![]() (2) in care:
(2) in care:
A - greutatea atomica a substantei depuse;
n - valenta substantei depuse.
Spre deosebire de alte forme de coroziune, viteza coroziunii uniforme poate fi usor evaluata utilizand testele de pierdere in greutate si folosind ecuatiile (3) si (4), in care vitezele de coroziune pot fi exprimate intr-o varietate de moduri, cele mai uzuale fiind (mils/ an) sau (mm/ an):
1mils/ an = (534W/ DAT) (3) si
mm/ an = (87600W/ DAT) (4) in care:
W - pierderea in greutate(mg);
D - densitatea probei (g/cm3);
A - aria probei (cm2 sau in2);
T - timpul de expunere (ore).
In consecinta, durata de viata a structurilor si componentelor metalice, care sufera o coroziune uniforma poate fi estimata destul de precis.
Sistemele de transport a caldurii din centralele CANDU, deci inclusiv circuitul secundar, folosesc tevi din otel carbon, care este ductil, relativ usor de sudat si inspectat. Materialelor utilizate pentru executia sistemelor de transport a caldurii le sunt impuse unele cerinte specifice atat in vederea limitarii coroziunii (cum ar fi, de exemplu, continutul maxim de Cr) cat si pentru a minimiza productia si transportul de radioactivitate (cum ar fi, de exemplu un continut cat mai redus de Co in material).
In cazul oricarui circuit de racire exista doua elemente de baza care influenteaza coroziunea metalului din care este executat acesta: metalul care vine in contact cu agentul de racire si chimismul propriu-zis al fluidului circulant prin circuit. In vederea asigurarii unei coroziuni cat mai uniforme a otelurilor carbon utilizate la executia circuitului secundar, este necesara crearea acelor conditii de chimism al mediului apos care sa asigure formarea cu preponderenta a unor filme aderente, protectoare de magnetita si eliberarea unei cantitati minime de produsi de coroziune solubili sau sub forma de suspensii. Referitor la chimismul apei din sistemele de transport ale caldurii, exista doua cerinte de baza:
prima este mentinerea unei concentratii coborate de oxigen dizolvat care sa asigure viteze coborate de coroziune ale aliajelor de Zr si otelurilor carbon, iar
a doua o constituie mentinerea unei alcalinitati adecvate pentru asigurarea unor viteze coborate de coroziune ale otelurilor carbon.
In acest context, controlul oxigenului este un factor important in monitorarea coroziunii. Continutul de oxigen este, deobicei, redus prin mijloace mecanice la nivele foarte coborate in timpul perioadelor de operare neintrerupta. Pentru a reduce si mai mult continutul de oxigen, sunt folosite suplimentar mijloace chimice, deci substante chimice consumatoare de oxigen. Primul si probabil cel mai utilizat "consumator" de oxigen a fost sulfitul, care ulterior a fost inlocuit cu hidrazina. Avantajul acesteia din urma fata de sulfit consta in faptul ca fiind un compus organic, ea nu va contribui la cresterea cantitatii de suspensii solide prezente in sisteme si nici nu va da nastere la gaze cu caracter acid.
Pe baza datelor din literatura si a experientei in operare a centralelor nuclearo-electrice, a reiesit ca hidrazina (N2H4) este un "slab" consumator de oxigen. Totusi, in ciuda capacitatii ei limitate de a reactiona cu oxigenul, ea contribuie la reducerea marcanta a coroziunii materialelor prezente in circuitul secundar. In acelasi timp, desi ea reactioneaza destul de greu cu oxigenul, totusi ea are o capacitate recunoscuta de a forma filme pasive de oxid, in special pe componentele din otel carbon. Pe baza acestor caracteristici, ea se incadreaza, in principal, in categoria inhibitorilor de coroziune de tip pasivant si in plan secundar in categoria substantelor consumatoare de oxigen.
Se stie ca controlul pH-ului mediului apos din circuitul secundar joaca un rol important in micsorarea si uniformizarea coroziunii materialelor structurale ale acestui circuit. In acest scop, in CNE-urile CANDU600 este utilizat tratamentul cu amine volatile(AVT), acestea fiind ciclohexilamina si morfolina. La jumatate din centralele nuclearo-electrice PHWR din SUA, este utilizata o tehnologie mai noua de reglare a pH-ului mediului apos din circuitele secundare utilizand doar morfolina, iar la altele este utilizata monoetanolamina(MEA) in locul ciclohexilaminei ca agent de reglare al pH-ului [10]. In acest context, in ultima vreme, a mai fost testata actiunea pasivanta si a altor substante, cum ar fi carbohidrazida, hidrochinona, dietilhidroxilamina (DEHA), metil-etil-cetona (MEK) [11].
2.Cinetica coroziunii uniforme a otelurilor carbon
2.1.Cinetica coroziunii otelurilor in solutia (AVT +N2H4)
Avand in vedere ca mediul specific circuitului secundar consta in tratarea cu amine volatile(AVT) si hidrat de hidrazina(N2H4) a apei demineralizate, in asa fel incat pH-ul solutiei rezultate sa fie cca. (9,7 0,1), in prima instanta a fost utilizata aceasta solutie pentru filmarea probelor. Pentru a atinge nivelul de oxigen maxim permisibil in circuitul secundar - maxim 5mg/kg apa - s-a executat o dezoxigenare suplimentara prin eliminarea la fierbere a unui volum de solutie. In centralele nucleare, degazarea mecanica se realizeaza, deobicei, prin purjare de abur. Fluidul de degazat se amesteca foarte bine cu aburul epuizat de la turbina, astfel incat majoritatea gazelor prezente in el vor fi indepartate prin orificiile de evacuare prevazute. Cand acest sistem de degazare functioneaza bine, poate fi atins un nivel de oxigen de maxim 5mg/l. In scopul desavarsirii degazarii, degazarea mecanica trebuie completata cu cea chimica, care utilizeaza agenti chimici reducatori ca: hidrazina, hidrochinona, etc.
In figura 1[53] sunt prezentate curbele variatiei vitezelor de coroziune functie de timp pentru cele trei tipuri de oteluri carbon autoclavizate circa 65 zile in solutia (AVT + N2H4) in conditii normale de operare ale circuitului secundar, adica: [(260 10)oC si (5,9 0,5)MPa].
Se observa ca ecuatiile corespunzatoare acestor variatii sunt cele ale unor parabole, exponentii timpului variind intre (-0,7068) si (-0,75). Curbele aferente variatiei vitezelor de coroziune in cazul otelurilor SA106 si SA508 sunt aproape suprapuse, iar cea corespunzatoare otelului SA516 este situata sub ele, mergand aproape paralel cu ele.

|
Viteza de coroziune (g/m2/zi) |
Ecuatia cinetica |
Valorile constantelor cinetice |
|
Otel carbon SA106gr. B |
y = 2,498 t -0,7068; R2 = 0,8334 |
K = 2,498;n= - 0,7068 |
|
Otel carbon SA 516 |
y = 1,9755 t-0,7505; R2 = 0,9343 |
K =1,9755;n=- 0,7505 |
|
Otel carbon SA 508 |
y = 2,842 t-0,7499; R2 = 0,8815 |
K =2,8422;n= - 0,7499 |
Fig. 1[53] Variatia vitezelor de coroziune ale celor trei tipuri de oteluri carbon autoclavizate in mediu de (AVT + hidrazina)
Un alt parametru cinetic, la fel de interesant ca si variatia vitezei de coroziune in timp, este concentratia de ioni de Fe2+ eliberati in solutie, care determina in mare parte cantitatea de produsi de coroziune transportati prin circuit. In acest context, in figura 2[53] este prezentata variatia vitezei de eliberare a metalului in solutie functie de perioada de autoclavizare.
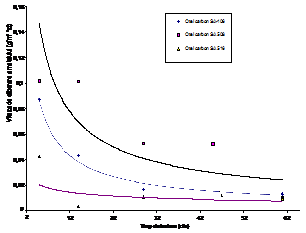
|
Viteza de eliberare a metalului (g/m2/zi) |
Ecuatia cinetica |
Valorile constantelor cinetice |
|
Otel carbon SA106gr.B |
y = 0,3232t-0,8095; R2 = 0,9617 |
K= 0,3232;n= - 0,8095 |
|
Otel carbon SA 516 |
y = 0,0386 t-0,4002; R2 = 0,2046 |
K =0,0386; n= - 0,4002 |
|
Otel carbon SA 508 |
y = 0,4733 t-0,728; R2 = 0,6118 |
K =0,4733; n= - 0,728 |
Fig.2[53] Variatia vitezelor de eliberare ale ionilor Fe2+ de catre otelurile carbon autoclavizate in solutia (AVT +hidrazina)
Din figura se observa ca in decursul a 30 zile, viteza de eliberare a metalului scade cu cresterea perioadei de autoclavizare in cazul tuturor celor trei tipuri de oteluri carbon, in final toate cele trei curbe atingand un palier. Curba aferenta otelului SA516 a atins foarte rapid un palier, in timp ce in cazul otelului SA508 a existat o tendinta mai lenta de scadere a vitezei de eliberare a metalului.
Acest comportament confirma faptul ca reglarea cu AVT a pH-ului solutiei in jurul valorii 9,7, reduce drastic vitezele de coroziune ale otelurilor carbon, hidrazina avand in plus rolul de a consuma oxigenul conform reactiilor (7) si (8).
N2H4
+ O2 ![]() N2 + 2H2O (7)
N2 + 2H2O (7)
N2H4
+ 6Fe2O3 ![]() 4Fe3O4 + N2 + H2O (8)
4Fe3O4 + N2 + H2O (8)
De aceea, in centralele nucleare a fost adoptata metoda degazarii intense a agentului termic care circula prin instalatiile confectionate din otel carbon, fiind recomandata folosirea ambelor tipuri de degazari: mecanica si chimica, aplicate consecutiv.
|
|
Fig.3[53] Variatia vitezelor de coroziune ale celor trei tipuri de oteluri carbon in mediu apos tratat numai cu AVT |
|
Tip material |
DG = k1.tn |
|
SA 516 |
27.413 ∙ t -0.658 |
|
SA 106 |
17.978 ∙ t -0.592 |
|
SA 508 |
23.844 ∙ t -0.678 |
Pentru a evidentia rolul hidrazinei in asigurarea unei comportari optime la coroziune a celor trei oteluri carbon, a fost executata autoclavizarea probelor prelevate din otelurile respective la parametrii de operare ai circuitului secundar, in solutie AVT de pH 9,7, degazata doar prin eliminarea la fierbere a unui volum prestabilit de solutie. Variatiile vitezelor de coroziune si respectiv a cantitatilor de produsi de coroziune aderenti, aferente celor trei tipuri de oteluri carbon, sunt prezentate in figurile 3 si 4[53].
|
|
Fig.4[53] Variatia cantitatii de produsi de coroziune aderenti formati post- autoclavizare in solutie AVT |
|
|
Tip material |
DG = k1.tn |
DG = k2 .t + k3 |
|
SA 516 |
1721 ∙ t 0.431 | |
|
SA 106 |
8.215 ∙ t 0.67 |
0.786 t + 65.712 |
|
SA 508 |
27.711 ∙ t 0.311 | |
|
|
Fig.5[53] Variatia cantitatii de produsi de coroziune aderenti formati pe cele trei tipuri de oteluri carbon in urma autoclavizarii in solutia (AVT + N2H4) |
|
Tip material |
DG = k1.tn |
|
SA 516 |
1908 ∙ t 0.369 |
|
SA 106 |
28.025 ∙ t 0.256 |
|
SA 508 |
14.788 ∙ t 0.412 |
Comparand curbele variatiei vitezelor de coroziune caracteristice otelurilor autoclavizate in solutia (AVT + N2H4) (figura 1[53]) cu cele obtinute in solutia AVT(figura 3[53]) si respectiv cu curbele corespunzatoare otelurilor autoclavizate in solutia continand alaturi de AVT, hidrochinona(HQ)-(AVT+HQ)- (figura 5[55]), constatam alura lor asemanatoare, cu urmatoarele diferente:
a) exponentii timpului din ecuatiile cinetice ale vitezelor de coroziune, variaza astfel:
in cazul testelor executate in solutia AVT ei sunt cuprinsi intre (-0,57) si (-0,58);
in cazul testelor executate in solutia (AVT + N2H4), ei variaza in domeniul [(-0,7)
in cazul testelor executate in solutia (AVT + HQ), ei variaza in domeniul [(-0,63)
b) viteza de coroziune cea mai mare a avut-o otelul SA516, iar cea mai mica otelul SA508; curbele corespunzatoare variatiei vitezelor de coroziune ale otelurilor SA516 si SA106 sunt paralele, toate tinzand sa atinga dupa 50 de zile o viteza de coroziune practic constanta.
Avand in vedere ca alaturi de viteza de coroziune, un alt parametru important in aprecierea unei coroziuni uniforme este cantitatea de produsi de coroziune aderenti, este interesant sa comparam ecuatiile cinetice ale curbelor din figurile 4 si 5, corespunzatoare autoclavizarilor executate intr-un mediu intens degazat (fig.5) si respectiv ceva mai putin degazat(fig.4). In acest caz, remarcam ca in cazul autoclavizarilor efectuate in solutia (AVT+N2H4), cantitatea de produsi de coroziune aderenti asculta de o lege de variatie cubica, singurul otel care nu respecta intrutotul regula fiind SA106, a carui curba este situata pe grafic deasupra celorlalte doua, care sunt aproape integral suprapuse. In schimb, in cazul autoclavizarilor efectuate in solutia ceva mai oxigenata, tratata doar cu AVT, se observa o imprastiere mai mare a tuturor curbelor si in plus, cantitatea de produsi aderenti formati pe otelul carbon SA106 asculta de o functie putere pana la cca.40zile, dupa care variatia acestei marimi are loc linear.
Pornind de la premiza ca cercetatorii canadieni au incercat cu succes inlocuirea N2H4 cu hidrochinona (HQ) la tratarea apei din circuitul secundar, au fost executate teste de autoclavizare similare, in conditiile de operare ale circuitului secundar, in solutia (AVT + HQ), perioade de timp comparabile.
Pe baza datelor gravimetrice inregistrate dupa descalarea periodica a probelor, au fost trasate curbele si ecuatiile cinetice corespunzatoare, descriind variatia in timp a tuturor parametrilor cinetici si anume: pierderile datorata coroziunii, cantitatea de produsi de coroziune total formati, cantitatea de produsi de coroziune aderenti, dintre care prezentam grafic variatia vitezelor de coroziune (fig.6[55]) si respectiv variatia vitezelor de eliberare ale metalului in solutie (fig.7[55]).

|
Viteza de coroziune (g/m2/zi) |
Ecuatia cinetica |
Valorile constantelor cinetice |
|
Otel carbon SA 106gr.B |
y=2,4374 t -0,6684; R2 = 0,9736 |
K = 2,4374;n= - 0,6684 |
|
Otel carbon SA 516 |
y = 2,2813 t-0,6299; R2 = 0,9696 |
K =2,2813;n= - 0,6299 |
|
Otel carbon SA 508 |
y = 2,6552 t-0,6953; R2 = 0,9948 |
K =2,6552;n= - 0,6953 |
Fig.6[55] Variatia vitezelor de coroziune ale celor trei tipuri de oteluri carbon autoclavizate in mediu de (AVT+hidrochinona)
Comparand ecuatiile curbelor vitezelor de coroziune, corespunzatoare celor trei oteluri carbon din figura 6[55], observam ca cele trei curbe au aluri foarte apropiate, viteze de coroziune ceva mai mari prezentand probele de otel SA 516 si SA 508.
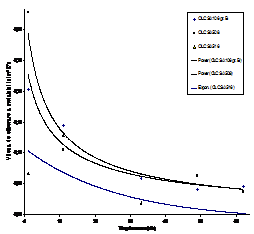
|
Viteza de eliberare a metalului (g/m2/zi) |
Ecuatia cinetica |
Valorile constantelor cinetice |
|
Otel carbon SA 106gr. B |
y = 0,6142t-0,5931; R2 = 0,9445 |
K = 0,6142;n = - 0,5931 |
|
Otel carbon SA 516 |
y = 0,136e-0,037t; R2 = 0,5903 |
K= 0,136; n = -0,037 |
|
Otel carbon SA 508 |
y = 0,9228t-0,6918; R2 = 0,9526 |
K =0,9228;n = - 0,6918 |
Fig.7[55] Variatia vitezei de eliberare a metalului in cazul celor trei tipuri de oteluri carbon autoclavizate in mediu de (AVT+hidrochinona )
Examinand curbele din figura 7[55], in care sunt reprezentate variatiile vitezelor de eliberare ale metalului in solutie, se observa ca dupa 50 de zile, aceasta caracteristica ramane practic constanta in cazul tuturor celor trei tipuri de oteluri carbon. Pentru a stabili rolul substantelor consumatoare de oxigen (cum este hidrazina, hidrochinona, etc), probe prelevate din cele trei oteluri carbon au fost expuse in paralel in medii apoase tratat doar cu amine volatile si respectiv in solutii tratate cu N2H4 si respectiv cu HQ.
In cazul pierderii prin coroziune, ecuatiile si implicit curbele cinetice corespunzatoare otelurilor carbon autoclavizate in solutia AVT difera net de cele aferente probelor autoclavizate in solutia AVT tratata cu N2H4 si respectiv cu HQ. Diferenta rezida in faptul ca, in timp ce in mediile in care au existat si alti adjuvanti in afara de AVT, exponentii timpului au variat intre 0,25 in cazul folosirii N2H4 si respectiv 0,33 in cazul utilizarii HQ, in mediul tratat cu AVT, acestia au fost egali cu 0,42.
Stiind ca pierderea in greutate prin coroziune se regaseste in produsii de coroziune total formati, era normal ca si ecuatiile corespunzatoare variatiei acestui parametru sa difere de cele aferente produsilor de coroziune total formati doar prin factorii preexponentiali. Faptul este explicabil prin aceea ca tot ceea ce s-a pierdut prin coroziunea metalului de baza a dat nastere la produsi de coroziune, care, nefiind vehiculati prin circuite datorita operarii in regim static in autoclave, sa se redepuna partial pe probe, partial pe peretii autoclavei.
Straturile de produsi de coroziune aderenti tind sa se formeze destul de rapid pe otelurile SA 508 si SA 106 - dupa 14 zile pe primul si dupa cca.30 de zile pe al doilea-. Pe otelul SA 516, insa, stratul de produsi de coroziune aderenti nu atinge nici dupa 60 de zile o grosime-limita stationara, datorita, probabil, unui echilibru dinamic instabil existent la interfata film/solutie, in cadrul caruia procesele chimice continua sa aiba loc. Curbele variatiei cantitatii de produsi de coroziune aderenti corespunzatoare otelului SA 516 se prezinta destul de asemanator in mediul AVT si respectiv (AVT + HQ), diferentele aparand in cazul autoclavizarilor efectuate in solutia (AVT + N2H4) dupa depasirea perioadei de 30 de zile, cand acest parametru incepe sa scada.
Curbele corespunzatoare variatiei vitezei de eliberare a metalului in solutie tind sa atinga un palier dupa cca.30 de zile in cazul tuturor otelurilor carbon studiate, diferenta constand in perioada de timp dupa care viteza de eliberare devine practic constanta.
Incercand sa corelam ponderea caracterului pasiv al filmelor formate post-autoclavizare cu concentratia ionilor Fe2+ din solutie (tabelul 1[55]), folosind datele referitoare la cinetica de coroziune a otelurilor carbon autoclavizate in mediul AVT netratat si respectiv tratat cu N2H4, s-au remarcat urmatoarele:
in toate solutiile, concentratia ionilor Fe2+ eliberati in cele trei tipuri de solutii a fost mica(sub 20mg/l), concentratie care concorda cu datele gasite in literatura;
se poate conchide ca toate otelurile carbon autoclavizate in cele trei medii s-au acoperit cu filme relativ pasive, in special dupa 30 de zile;
variatia valorilor concentratiei ionilor de Fe2+ in decursul ciclurilor de autoclavizare sustine ipoteza unui echilibru dinamic permanent la interfata proba/ solutie, chiar si dupa formarea unor filme relativ pasive pe probe, cu atat mai mult cu cat mediul apos din autoclava a fost static [55].
Tabelul 1[55]. Continutul de Fe2+ determinat in solutiile prelevate
post-autoclavizare, dupa diferite perioade de timp
|
Nr. cicluri |
Per. testare (zile) |
Continutul in Fe2+(mg/l) |
||
|
AVT |
AVT + N2H4 |
AVT + HQ |
||
Principalii compusi chimici identificati in filmele superficiale prin difractie de raze X sunt inserati in tabelul 2[55]. Din tabel se observa ca, indiferent de tipul solutiei de autoclavizare, compusul majoritar identificat in filmele superficiale a fost Fe3O4, fapt care sustine caracterul protector al acestora.
In fig.8a,b,c[55] sunt prezentate micrografiile filmelor formate pe otelurile carbon autoclavizate in solutiile (AVT + N2H4 ) si respectiv AVT.
Tabelul 2[55] Compozitia chimica a filmelor de pe probele de otel carbon autoclavizate in diferite medii apoase, determinate prin difractie de raze X
|
Tipul otelului |
Sol. testare |
Principalii compusi (%gr) |
||||
|
Fe3O4 |
Fe2O3 |
a- Fe2O3 H2O |
FeO |
a- Fe |
||
|
SA-106 | ||||||
|
SA-508 |
AVT+N2H4 |
urme | ||||
|
SA-516 |
urme | |||||
|
SA-106 |
| |||||
|
SA-508 |
AVT | |||||
|
SA-516 |
urme | |||||
|
SA-106 |
urme | |||||
|
SA-508 |
AVT+HQ |
urme | ||||
|
SA-516 |
urme | |||||
|
|
a) |
|
|
b) c) |
Fig.8a,b,c[55] Micrografiile filmelor formate pe otelurile carbon autoclavizate 70 zile in solutii de pH 9,7 reglate cu (AVT +N2H4)(a)
si respectiv AVT(b, c) ( x 500)
2.2.Utilizarea metodelor electrochimice clasice in studiul coroziunii generalizate
Principalul avantaj al metodelor electrochimice este acela ca ofera rapid informatii calitative si cantitative referitoare la cinetica reactiilor de la interfata metal/solutie.
Astfel, predictia comportarii la coroziune generalizata se poate face din punct de vedere termodinamic pe baza inregistraririi variatiei potentialelor in circuit deschis in solutii de diverse pH-uri si corelarea valorilor respective cu procesele aferente inscrise in diagramele potential-pH. Desi aceasta metoda de determinare a rezistentei la coroziune nu este una cantitativa, ea poate furniza, totusi, indicii privind probabilitatea unor reactii metal/ mediu. Masuratorile de potential au fost facute la temperatura camerei, iar rezultatele au fost reprezentate sub forma diagramelor Ecor/timp. Alura curbelor de evolutie a potentialului de coroziune da informatii calitative despre caracteristicile filmelor superficiale formate pe suprafata metalelor. Se stie ca forma curbei potential/ timp variaza functie de procesele de coroziune care au loc la interfata metal/mediu; in acest context, daca potentialul tinde spre valori mai negative, este probabila aparitia unor zone in care au loc procese de coroziune. Variatiile bruste de potential spre valori mai electronegative si revenirea la valori mai pozitive indica faptul ca are loc ruperea stratului pasiv de pe suprafata metalului urmata de refacerea acestuia. In general, diferentele de potential sunt destul de vizibile, astfel incat se va putea face o distinctie intre cele doua situatii. Intrucat experimentele de acest tip au fost efectuate la temperatura camerei, aceasta prognozare a comportarii unui metal intr-un mediu apos de un anumit pH va fi valabila doar in acele conditii. Atunci cand rezultatele determinarilor experimentale facute la temperatura camerei vor fi extrapolate pentru ceea ce se intampla la temperatura inalta, va apare un mare grad de incertitudine datorat faptului ca atat procesele de coroziune cat si vitezele lor vor fi diferite in noile conditii. De aceea, numai informatiile obtinute on-line in instalatiile nucleare, referitoare la variatia acestor parametri electrochimici specifici materialelor de interes nuclear, vor contribui la intemeierea unei baze de date reale si utile pentru prognozarea comportarii la coroziune la temperatura ridicata a materialelor respective. Pentru a ilustra diferentele intre caracteristicile electrochimice ale probelor neacoperite si respectiv filmate, in fig.9[55] este prezentata variatia potentialelor in circuit deschis la temperatura camerei, in mediul specific circuitului secundar, in cazul probelor de otel carbon SA516 autoclavizate si respectiv neacoperite. Pe baza formei curbelor prezentate in fig.9, se poate presupune ca dupa o perioada de timp, la interfata film/solutie, au fost initiate niste reactii concurente de rupere/refacere a filmului superficial, aceste procese fiind posibile deoarece filmul format pe otelul autoclavizat nu a fost complet lipsit de porozitate si aderent.

Fig.9[55] Variatia potentialului de coroziune in circuit deschis in cazul
otelului SA516 filmat si respectiv neacoperit
Tabelul 3[55] Sumarul caracteristicilor electrochimice aferente filmelor formate pe otelurile carbon in cele trei medii reprezentative
|
Tip OL |
Tip sol. |
Date din pante Tafel |
Date din valorile Rp |
|||||||
|
E (I=0) |
bc |
ba |
Icor. |
Vcor. |
E (I=0) |
Rp |
Icor. |
Vcor. |
||
|
AVT+ HQ | ||||||||||
|
AVT+ N2H4 | ||||||||||
|
AVT | ||||||||||
Folosind o alta metoda - cea a polarizarii potentiodinamice liniare -au fost determinati parametrii electrochimici caracteristici proceselor de coroziune. Pe baza valorilor obtinute din pantele Tafel si rezistentele de polarizare, au putut fi calculate vitezele de coroziune care sunt prezentate in tabelul 3[55]. Filmele superficiale create in urma autoclavizarii otelurilor carbon sunt relativ stabile in mediul specific circuitului secundar, ceea ce demonstreaza ca ele confera o oarecare protectie metalului de baza neacoperit. Gradul de stabilitate al acestor filme este ilustrat in figurile 10 si 11, in care sunt prezentate curbele potentiodinamice aferente unor oteluri carbon neacoperite si respectiv autoclavizate diferite perioade [55].
In general, probelor autoclavizate le sunt caracteristice valori mai mici ale densitatilor curentilor de pasivare si respectiv valori mai electropozitive ale potentialelor de coroziune, ceea ce indica o rezistenta mai buna la coroziune a probelor filmate comparativ cu cele neacoperite.
In figura 11[55] sunt prezentate comparativ curbele potentiodinamice corespunzatoare otelului carbon SA106 autoclavizat 40 si respectiv 60 zile. Vitezele de coroziune determinate din pante Tafel si din rezistentele de polarizare difera cu cca.10mpy, aceasta diferenta fiind reflectata pe curba PD printr-o diferenta egala cu un ordin de marime intre curentii de pasivare.
Diferenta de la simplu la dublu intre vitezele de coroziune ale probelor de otel carbon filmate si respectiv neacoperite este reflectata pe curbele potentiodinamice printr-una egala cu cca. un ordin de marime intre curentii de pasivare.
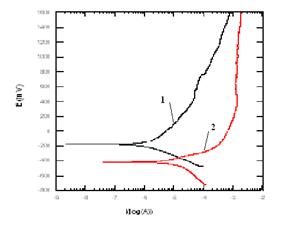
Fig.10[55] Curbele potentiodinamice aferente probelor din otel SA516 neacoperit(curba 1) si respectiv filmat in solutia (AVT + N2H4)(curba 2)
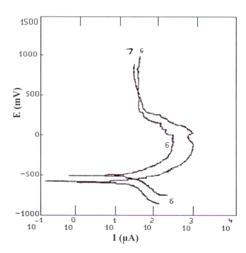
Fig.11[55] Curbele PD aferente otelului SA106 autoclavizat in solutia (AVT+N2H4) avand pH 9,7 urmatoarele perioade: 40 zile (curba 6) si respectiv 60 zile (curba 7)
2.3.Utilizarea metodei impedantei electrochimice pentru evaluarea rezistentei la coroziune generalizata
Masuratorile de impedanta executate in solutia (0,001M borat de sodiu + 0,05M acid boric), pe cele trei tipuri de oteluri carbon, autoclavizate in mediul specific circuitului secundar - (AVT + N2H4) - , au relevat urmatoarele caracteristici (figura 12[55]):
filmele formate pe cele trei tipuri de oteluri carbon au caracteristici structurale si electrochimice foarte asemanatoare, fapt evidentiat prin valorile impedantelor totale;
filmele formate post-autoclavizare pe cele trei oteluri carbon sunt comparabile din punct de vedere al caracterului protector fata de metalul de baza;
filmul de pe otelul SA106 avand un caracter partial capacitiv, are un caracter mai protector comparativ cu filmele formate pe celelalte doua oteluri carbon.
Softul de impedanta ZSimp permitand compararea grafica a curbelor experimentale cu cele fitate si alocarea de circuite echivalente, faciliteaza intelegerea mai profunda a proceselor de coroziune care au loc la interfata metal/ solutie. Spre exemplificare, in figura 13 sunt prezentate curbele Bode si cele corespunzatoare unghiurilor de faza aferente otelului SA508 autoclavizat cca.130 zile in conditiile specifice circuitului secundar.
Suprapunerea aproape integrala a curbelor fitate peste cele corespunzatoare valorilor masurate, pledeaza pentru veridicitatea circuitelor echivalente alocate.
|
|
a) b) c) |
Fig.12[55] Curbele Bode(a), ale unghiurilor de faza(b) si Nyquist(c) aferente otelurilor carbon filmate in solutia (AVT + N2H4) (0,5h mentinere in electrolit): - SA 106; x -SA 508; Q - SA 516 |
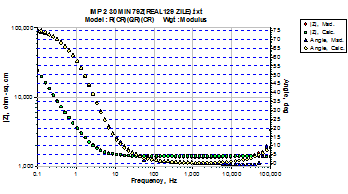
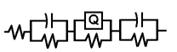
Fig.13[55] Curba Bode, a unghiului de faza si circuitul echivalent corespunzator otelului carbon SA508 autoclavizat 130 zile in solutia AVT clasica, dezoxigenata
Stiind ca filmele superficiale formate post-autoclavizare pe suprafetele probelor de otel carbon poseda diverse grade de porozitate, au fost executate masuratori de impedanta dupa diverse perioade de mentinere in electrolitul tip acid boric/ borax, a probelor: 1/2ora, 6 si 24 ore. In fig.14a,b,c[55] sunt prezentate curbele Bode inregistrate dupa perioadele de timp respective in cazul otelurilor: SA 106, SA 508 si SA 51
Examinand aceasta figura, observam ca:
a) curbele inregistrate imediat dupa imersie si dupa 6 ore sunt paralele, suprapunandu-se pe mari portiuni;
b) curbele inregistrate dupa 24 ore sunt paralele cu celelalte doua inregistrate dupa perioade mai scurte de stationare in electrolit, dar deplasate spre impedante mai mici.
Pe baza curbelor prezentate in fig.14[55] si a parametrilor caracteristici extrasi din masuratorile de impedanta, se poate conchide ca in decursul stationarii probelor filmate in electrolit, ionii din solutie au patruns prin imperfectiunile retelei stratului superficial de compusi, tinzand sa ajunga la metalul de baza.
|
|
Fig.14a, b,c [55] Curbele Bode aferente otelurilor carbon autoclavizate: SA106(a), SA508(b) si SA516(c), mentinute in electrolit urmatorii timpi: (♦) ½ ora; (■)6 ore; (▲)24 ore |
|
|
|
|
|
Cu alte cuvinte, atunci cand filmul superficial este partial imperfect, in decursul mentinerii probei in electrolit are loc doparea retelei, care este cu atat mai avansata cu cat filmul este mai imperfect si perioada de stationare a probei in electrolit mai lunga. Aceasta dopare estompeaza imperfectiunile initiale ale retelei, creand cai de scurtcircuitare si facand-o mai conductiva.
Pornind de la premiza ca, cu cat filmele sunt mai imperfecte, cu atat ionii din electrolit patrund mai adanc in ele, s-a urmarit gradul de imperfectiune al filmelor prin mentinerea acestora in electrolitul din celula perioade de timp cat mai mari, cuprinse intre 0,5 si 24 de ore.
Astfel, curbele EIS corespunzatoare filmelor create pe cele trei oteluri carbon autoclavizate cca.60 zile in solutia (AVT+N2H4), mentinute 24 de ore in electrolitul din celula electrochimica sunt prezentate in figura 15a,b,c[55].
|
|
a) b) c) |
Fig.15[55] Curbele Bode(a), ale unghiurilor de faza(b) si Nyquist(c) inregistrate dupa mentinerea timp de 24 ore in electrolit a urmatoarelor oteluri carbon autoclavizate 60 zile in solutia (AVT + N2H4): - SA 106; x -SA 508; Q -SA 516 |
Principalele caracteristici ale curbelor EIS din figura 15[55] sunt:
filmele formate pe cele trei oteluri carbon in conditiile normale de operare ale circuitului secundar, sunt asemanatoare din punct de vedere al gradului lor de compactare;
cel mai putin poros pare a fi filmul format pe otelul SA106, care are un caracter capacitiv incipient, iar caracterul rezistiv cel mai pronuntat este caracteristic otelului SA51
Examinand alura curbelor EIS aferente filmelor formate pe otelurile carbon autoclavizate in cele doua medii apoase, care au diferit prin continutul de oxigen, s-au constatat urmatoarele:
otelul SA508 s-a acoperit cu filme cu caracteristici foarte apropiate, aproape identice, indiferent de mediul in care a fost executata autoclavizarea;
la extrema cealalta se situeaza filmele formate pe otelul SA106, care au caracteristici electrochimice diferite, functie de mediul in care a fost executata autoclavizarea;
otelul SA516 autoclavizat in cele doua tipuri de solutii s-a acoperit cu filme pasive tip duplex, avand impedante usor diferite.
Deci, coreland rezultatele investigarii caracteristicilor filmelor cu conditiile concrete in care acestea au luat nastere post-autoclavizare, putem concluziona urmatoarele:
a) curbele cinetice care descriu variatia vitezelor de coroziune a tuturor otelurilor carbon in timp corespund unor parabole, indiferent de tipul solutiei in care au fost autoclavizate;
b) filmele cele mai subtiri (maxim 2mm) au fost obtinute pe otelurile carbon autoclavizate in solutia (AVT+N2H4), iar cele mai groase (maxim 5mm) in solutia AVT. De aici reiese rolul hidrazinei si respectiv al hidrochinonei care, pe langa reglarea pH-ului, asigura consumarea oxigenului remanent in mediul apos, actionand totodata si ca inhibitori de coroziune;
c) pornind de la premiza ca filmele superficiale de pe probe reprezinta produsii de coroziune aderenti, cinetica formarii lor in timp a prezentat un deosebit interes. Ingrosarea lor in timp a urmarit o cinetica cubica, indiferent de solutia utilizata in decursul autoclavizarii. Din punct de vedere compozitional, componenta majoritara in filme a fost magnetita, care fiind un compus stabil, poate asigura protectia metalului de baza. Concentratia de magnetita in filmele superficiale a diferit functie de mediul in care a fost executata autoclavizarea si de tipul otelului carbon testat;
d) caracterul mai mult sau mai putin protector al filmelor superficiale a fost apreciat din doua puncte de vedere:
e) un alt parametru cinetic, care poate fi corelat cu starea pasiva a otelurilor carbon este viteza eliberarii metalului in mediu. In timp, acest parametru a tins - dupa cca. 30 de zile - spre o valoare limita foarte coborata, cuprinsa intre 0,02 si 0,04g/m2.zi, valoare confirmata si prin determinarile prin spectrofotometrie U.V. a concentratiilor ionilor Fe2+ din solutiile prelevate post-autoclavizare. Aceasta comportare - coroborata cu variatia celorlate marimi gravimetrice - ne indreptateste sa afirmam ca in urma autoclavizarilor executate in conditiile de operare ale circuitului secundar, pe suprafetele otelurilor carbon s-au format filme relativ compacte si protectoare fata de metalul de baza, care constituie o bariera in calea eliberarii in solutia adiacenta interfetei a ionilor de fier;
f) coroborand datele cinetice cu compozitia, grosimea si uniformitatea filmelor superficiale si cu ponderea caracterului pasiv al acestora, s-a stabilit ca hidrochinona este aproape la fel de eficienta ca hidrazina;
g) rezultatele experimentale prezentate in acest capitol, corelate cu datele din literatura, au condus la concluzia ca otelurile carbon, autoclavizate la parametrii normali de operare ai circuitului secundar si in solutii tratate cu amine volatile(AVT) si cu alti aditivi care creaza un nivel redus de oxigen in mediu (ca: hidrazina, hidrochinona, etc), sufera o coroziune generalizata, ale carei caracteristici pot fi determinate calitativ si cantitativ.
3. Mecanisme aplicabile coroziunii generalizate a otelurilor carbon
Mecanismul corodarii aliajelor feroase in mediu apos este cunoscut de multa vreme, el diferind de la un sistem la altul, functie de cele doua componente ale acestuia: pe de o parte, tipul aliajului feros si pe de alta parte, compozitia chimica a mediului apos si hidrodinamica acestuia.
Se stie ca aliajele feroase contin fier in stare elementara sau in starea de valenta "0". Indata ce coroziunea incepe, fierul incepe sa piarda electroni, oxidandu-se si dand in prima instanta ionul Fe+ sau Fe (I). Acesta este foarte instabil, asa incat oxidarea continua rezultand ionul Fe2+ sau Fe (II), care devine un component al produsilor de coroziune din apa. O parte din produsii reactiilor de coroziune sunt incorporati in filmele superficiale de oxizi, compuse deobicei din Fe3O4, iar o alta parte din produsii de coroziune sunt eliberati ca specii solubile. Aceste specii dizolvate includ, probabil, ioni de hidroxizi ferosi si alte specii feroase, care pot fi usor coordinate cu ajutorul unor substante antiscala. Cand produsii de coroziune "proaspeti" sunt expusi in conditii oxidante, oxidarea continua rapid, fierul fiind convertit direct la ionul feric sau Fe (III). Reducerea suspensiilor care contin Fe (III) la speciile solubile care contin Fe (II), are loc foarte lent in sistemele dezaerate, din cauza pH-ului inalt si a temperaturii existente. Deoarece ionii Fe2+ sunt oxidati foarte rapid in apele oxigenate cu pH inalt, prezenta lor in mediu constituie o indicatie a unei coroziuni active [56].
Coroziunea componentelor din otel carbon apartinand instalatiilor nucleare este complexa, in literatura fiind prezentate mai multe mecanisme[59-61]. Desi au fost propuse mai multe mecanisme, este, in general, acceptat faptul ca coroziunea conductelor de alimentare este initiata prin atacul separat sau simultan al oxigenului si respectiv al apei asupra suprafetelor de otel carbon de catre fiecare dintre cei doi agenti agresivi, conform reactiilor:
Fe(s) + O2(aq) + H2O(l) -> Fe2+(aq) + 2OH- (aq) (9a)
Fe(s) + 2H2O(l) ![]() Fe2+(aq) + 2OH- (aq) + H2(aq) (9b)
Fe2+(aq) + 2OH- (aq) + H2(aq) (9b)
Ionul Fe2+(aq) exista in diferiti produsi de coroziune, forma chimica in care se va gasi depinzand de potentialul redox si de pH-ul solutiei cu care vine in contact otelul carbon. De exemplu, daca pH-ul solutiei este cuprins intre 7 si 9, iar conditiile din mediu sunt reducatoare sau solutia este suficient dezaerata, va predomina compusul Fe(OH)2(s), desi in conditii normale acest compus este metastabil[60, 62]. Cu cat solutia din conducta de alimentare va deveni mai oxidanta, iar temperatura mai inalta (>373K) sau ambele conditii anterior mentionate vor fi indeplinite, Fe(OH)2(s) se va transforma in Fe3O4(s), care va contine ionul de Fe in ambele stari de valenta: (+2) si (+3).
In conditii mai oxidante, ionii Fe2+ se vor transforma in ioni Fe3+(aq), rezultand astfel alti produsi de coroziune incluzand:hematita [a-Fe2O3(s)], maghemita[g-Fe2O3(s)], lepidocrocita[g-FeOOH(s)]si goethita [a-FeOOH(s)].
Toti acesti produsi de coroziune, exceptand Fe(OH)2(s), au fost identificati in depunerile formate in faza vapori in circuitul secundar al unei CNE CANDU[63]. Prezinta interes, deci, atat modul de formare al acestor produsi "in-situ", cat si masura in care prezenta lor poate influenta procesul ulterior de coroziune al conductelor din otel carbon.
Oxizii si oxi-hidroxizii de fier constituie majoritatea produsilor de coroziune din circuitul secundar al unei CNE CANDU si implicit din depunerile formate pe acesta. Studiile efectuate prin tehnica Mossbauer [63] au demonstrat ca compusul principal al depunerilor este Fe3O4(s), alaturi de el fiind identificati si alti oxizi de fier ca lepidocrocita [g-FeOOH(s)] si hematita [a-Fe2O3(s)], insa in cantitate mai mica. Aparitia a diversi produsi de coroziune a condus la concluzia existentei diferitelor mecanisme posibile ale proceselor de coroziune in aceste sisteme.
Se stie ca adausul de hidrazina si morfolina in apa de alimentare este utilizat pentru a minimaliza coroziunea si reduce transportul produsilor de coroziune, hidrazina adaugandu-se atat pentru a consuma oxigenul rezidual dizolvat, cat si pentru a mentine conditii reducatoare in mediul apos din circuitul secundar.
Morfolina, care este folosita ca o solutie tampon pentru mentinerea pH-ului solutiei in apropierea valorii corespunzatoare minimului de solubilitate pentru Fe3O4(s), reduce la minim concentratia ionilor de fier eliberati. Totusi, analiza prin tehnica M ssbauer a produsilor de coroziune colectati din diferite puncte situate pe traseul ciclului aburului, sugereaza ca conditiile redox din unele parti ale sistemului pot sa nu fie suficient de reducatoare. Deci nu se poate stabili o strategie optima actionand doar asupra pH-ului apei de alimentare, in special atunci cand oxizii sunt mai putin stabili sau cand au viteze rapide de dizolvare.
O alta observatie interesanta reiesita din studiile M ssbauer efectuate pe produsii de coroziune prelevati din centralele rusesti a fost absenta oricaror oxihidroxizi de fier [g- FeOOH(s)] in buclele din circuitul primar si secundar al centralelor VVER [65].
Astfel, in bucla din circuitul primar au fost gasiti urmatorii oxizi: Fe3O4(s) (54%),a-Fe2O3(s) (17%) si g-Fe2O3(s) (27%), in timp ce cea din circuitul secundar a continut doar a-Fe2O3 (s) (60%) si g-Fe2O3(s) (40%).
In general, oxihidroxizii de fier au fost gasiti in sectiunile mai "reci" (in care temperatura era sub 150oC) si mai oxice ale buclei (de exemplu in condensoare, in tancurile de decontaminare ale condensatului din apropierea condensoarelor si la iesirea din turbinele de joasa presiune). In sectiunile mai "fierbinti"(incalzitoarele de inalta presiune, boilere), compozitia depunerilor aparute in urma coroziunii este dominata de oxizii de fier, ca: a-Fe2O3(s) si Fe3O4(s), cu urme de g-Fe2O3(s), gasite doar pe suprafetele de pe circuitul de evacuare al buclei din primar, de exemplu pe ambele separatoare de abur si in turbinele de inalta presiune.
Din cele aratate pana aici este evident ca exista o corelatie intre temperatura portiunii din bucla de pe care a fost recoltata proba si compozitia produsilor de coroziune depusi.Aceasta corelatie susmentionata l-a facut pe Moskvin[66] sa propuna urmatorul mecanism pentru procesul de formare al depunerilor de produsi de coroziune, care consta in urmatoarele trei etape:
prima etapa consta in tranzitia fierului metalic sau a oxizilor de fier solizi in forme ionice, adica Fe2+(aq), Fe3+(aq), FeOH+(aq), etc;
a doua etapa consta in hidroliza speciilor ionice, care are drept rezultat formarea oxihidroxizilor de fier;
a treia etapa o constituie formarea de depuneri care rezulta prin degradarea termica (deshidratarea) oxihidroxizilor, cu formarea a-Fe2O3(s) si g-Fe2O3 (s).
In reactoarele care au doua bucle, cea de-a treia etapa are loc rapid atunci cand oxihidroxizii sunt eliminati, in timp ce in cazul sectiunilor mai reci din reactoarele cu o singura bucla, pe aceste suprafete s-au format doar depuneri de g-FeOOH(s). Mecanismul prezentat de Moskvin[66] este relevant, in particular, pentru distributia produsilor de coroziune in circuitul secundar din centralele CANDU.
Observatii similare a facut si Sawicki[63], care a examinat compozitia depunerilor formate in diferite puncte situate de-a lungul buclei din circuitul secundar al CNE Darlington, pe parcursul exploatarii acesteia in stare stationara. Examinarile lui au relevat aparitia unui compus majoritar de g-FeOOH(s) si unei concentratii mici de goethita (a-FeOOH (s)) pe suprafetele unde a existat o separare a umiditatii (de exemplu sistemul bifazic din condensoare, tevile care leaga separatorul de umiditate de turbinele de presiune coborata, de canalele de golire ale incalzitorului din stadiul al doilea si de pompa de extractie a condensatului). Pe aceste suprafete - mai reci si mai oxice decat cele din restul circuitului secundar - apare justificata prezenta unor concentratii mari de oxihidroxizi de fier[66].
Totusi, data fiind diversitatea compozitiei depunerilor de pe parcursul conductelor de alimentare, nu s-a putut ajunge la un consens referitor la faptul ca acesti produsi au luat nastere doar pe suprafetele mai reci, dupa care au fost transportati de-a-lungul conductelor spre suprafetele mai calde. Acest lucru ar fi posibil daca vitezele reactiilor de conversie a acestor oxizi ar fi mult mai lente decat timpul de viata al oxidului in circuit. Acest punct de vedere ridica, de asemenea, chestiunea daca spectroscopia M ssbauer a depunerilor a furnizat o descriere precisa a chimismului suprafetei conductei de pe care s-a colectat depunerea; in acest context, s-ar putea presupune ca depunerile - mai degraba decat sa se formeze acolo -, ar putea fi aduse pe acea suprafata. Variatia compozitiei oxizilor formati de-a-lungul conductelor de alimentare va influenta, de asemenea, asupra cantitatii totale de fier transportat in circuit.
De asemenea, o crestere in concentratia oxigenului dizolvat poate conduce la o crestere a potentialului de coroziune al conductelor de alimentare si deci la o crestere in concentratia fierului transportat prin circuit. In oricare din aceste cazuri, solubilitatea depinde de tipul speciei dominante: Fe(II) sau Fe(III). Deci, chimismul fierului prezent in solutia din conducta de alimentare este intr-o stare stationara metastabila - in cazul cel mai bun - si respectiv intr-o stare tranzitorie nepredictibila-in cazul cel mai rau.
Definirea si modelarea parametrilor solutiilor corespunzatoare unui pH si potential redox particular este destul de dificila. De exemplu, potentialul redox al unei solutii oxigenate aflate in contact cu o depunere care contine Fe3O4(s) si g-FeOOH (s) poate fi descris mai bine printr-un potential mixt decat printr-un potential la echilibru. Intr-un proces la echilibru, potentialul in solutie a fost determinat de concentratia la echilibru a speciilor Fe(II)(aq) si Fe(III)(aq), care la randul lui este controlat de solubilitatile celor doua specii conform modelului potentialului mixt; potentialul de coroziune va fi functie de vitezele redox de dizolvare, adica va fi potentialul la care suma curentilor anodici va egala suma curentilor catodici corespunzatori reactiilor de oxidare si reducere. In acest mod vor putea fi calculate concentratiile de fier care rezulta in urma diferitelor reactii redox care au loc in timpul tranzitiilor metastabile (stari intermediare).
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |