Coroziunea implanturilor metalice
Coroziunea este o ractie chimica nedorita a metalelor la contactul cu mediul inconjurator, provocand degradarea continua a acestuia in prezenta oxizilor, hidroxizilor si a altor compusi. Lichidul din tesuturile corpului omenesc contine apa, oxigen dizolvat, proteine si diferiti ioni precum clorura si hidroxidul. Prin urmare, corpul omenesc este un mediu foarte agresiv pentru metalele folosite in implanturi. Rezistenta la coroziune a substantelor metalice folosite in implanturi este un aspect important al biocompatibilitatii.
Aspecte electrochimice
Starea multor metale in care actioneaza cea mai mica energie intr-un mediu oxigenat sau hidratat este cea de oxid. Coroziunea are loc atunci cand atomii de metal ionizeaza si intra in solutie, sau se combina cu oxigen sau alte substante pentru a forma un compus care este eliminat sau se dizolva. Mediul corpului uman este foarte agresiv cand este vorba despre coroziune, deoarece nu este numai lichid, dar contine si ioni de clorura si proteine. O multitudine de reactii chimice diferite au loc atunci cand un metal este introdus intr-un mediu apos, ca in Figura 5-10.
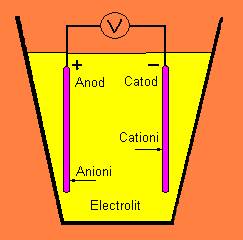
Figura 5-10. Celula electrochimica.
Electrolitul, care contine ioni in solutie, are rolul de a completa circuitul electric. In corpul uman, ionii necesari se gasesc in numar mare in fluidele din corp. Anionii sunt ioni negativi, care migreaza spre anod, iar cationii sunt ioni pozitivi care migreaza spre catod. Componenta electrica V in Figura 5-10 poate fi un voltmetru cu care se poate masura potentialul produs ; sau poate fi o baterie, iar in acest caz celula este o celula electroplacata ; poate fi un tesut de rezistenta atunci cand celula electrochimica este de fapt o celula ce provoaca coroziunea nedorita de un biomaterial in corp. In corp, o sursa electrica conducatoare externa poate fi prezenta sub forma unui stimulator cardiac, sau a unui electrod cu rol in stimularea cresterii oaselor. La anod, sau electrodul pozitiv, metalul oxideaza. pot avea loc urmatoarele reactii ale metalului M:
M → M+n + ne-1 (5-2)
La catod, sau electrod negativ, urmatoarele reactii de reducere sunt importante :
M+ + e- → M (5-3)
M2+
+
2H3O+ + 2 e- → H2↑ + 2H2O (5-5)
1/2 O2 + H2O + 2 e- → 2OH- (5-6)
Fie, ca exemplu, coroziunea unui metal cum ar fi fierul. Ionul metalic se duce in solutie in forma ionizata dupa cum urmeaza :
Fe + 2H2O → Fe2+ + H2↑ +2OH- (5-7)
In prezenta oxigenului, se poate forma rugina in reactiile urmatoare :
4Fe2+ + O2 + 2H2O → Fe3+ + 4OH- (5-8)
4 Fe3+ + 12OH- → 4Fe(OH)3↓ (5-9)
Daca este putin oxigen disponibil, Fe3O4, magnetita, poate forma un precipitat mai mult decat un hidroxid feric.
Tendinta metalelor de a intra in coroziunese se exprima cel mai simplu prin seria electrochimica standard a potentialelor Nernst, ca in tabelul 5-10. Aceste potentiale sunt obtinute prin masuratori electrochimice in care un electrod este un hidrogen standard format de o bula de hidrogen de-a lungul unui strat de platina pulverizat fin. Potentialul acestui electrod de referinta este considerat a fi zero. Metalele nobile sunt acelea cu potential mai mare decat electrodului de hidrogen standard ; metalele de baza au potential mai mic.
Daca doua metale similare sunt prezente in acelasi mediu, cel care este cel mai negativ in seria galvanica va deveni anod, si va avea loc coroziunea bimetalica (sau galvanica). Coroziunea galvanica poate fi mult mai rapida decat coroziunea unui singur metal. In consecinta, implanturile din metale diferite (metale mixte) trebuie evitata. Actiunea galvanica poate sfarsi cu o coroziune cu un singur metal, daca avem de a face cu lipsa omogenitatii in metal sau in mediul in care se afla acesta.
Tabelul 5-10. Seria electrochimica standard
|
Reactie |
ΔE0 (volti) |
|
Li ↔ LI+ Na ↔ Na+ Al ↔ Al+ Ti ↔ Ti2+ Fe ↔ Fe2+ H2 ↔ 2H+ Ag ↔ Ag+ Au ↔ Au+ |
-3,045 -2,714 -1,66 -1,63 -0,44 0,000 +0,799 +1,68 |
Diferenta de potential E observata de concentratia ionilor metalici in solutie conform ecuatiei Nernst,
E = E0 + (RT / nF) ln [Mn+] (5-10)
in care E0 este potentialul electrochimic standard, T este temperatura absoluta, F este constanta lui Farraday, 96 485 coulombi / moli, iar n numarul de ioni.
Ordinea nobilitatii observata in practica poate diferi de cea prezisa termodinamic. Motivul este faptul ca unele metale devin acoperite cu un strat pasivator de produsi de reactie, care protejeaza metalul de un atac ulterior. Reactia de disolutie poate fi puternic ireversibila astfel incat o bariera de potential trebuie depasita. In acest caz, coroziunea poate fi oprita chiar daca devine favorabila energetic. Intr-un final, reactiile de coroziune pot continua incet : cinetica nu este determinata de termodinamica.
Diagramele Pourbaix ale coroziunii
Diagrama Pourbaix reprezinta regiuni de coroziune, pasivitate si imunitate, care depind de un potential de electrod si pH. Diagramele Pourbaix deriva din ecuatiile nernst si din solubilitatea produselor de degradare si a constantelor de echilibru ale reactiei. De dragul definirii, aria de coroziune este aleasa arbitrar la o concentratie mai mare de 10-6 g atom per litru (molar) sau mai mult metal in solutie. Aceasta este echivalenta cu 0,06 mg/litru pentru metale cum ar fi fierul sau cuprul, si 0,03 mg/litru pentru aluminiu.
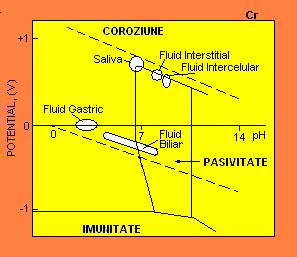
Figura 5-11. Diagrama Pourbaix pentru Cr prezinta regiuni asociate diferitelor fluide ale corpului.
(Conform J.H.Dumbleton si J.Black, An Introduction to Orthopaedic Materials, Charles C.Thomas,Springfield, 1975)
Imunitatea se defineste ca echilibrul dintre metal si ionii sai la mai putin de 10-6 molar. In regiunea imuna, coroziunea este imposibila din punct de vedere energetic. Imunitatea se mai numeste si protectie catodica. In domeniul pasivizarii, constituentul solid stabil este un oxid, un hidroxid, un hidrat sau o sare a unui metal. Pasivitatea se defineste ca echilibrul dintre un metal si produsii sai de reactie (oxizi, hidroxizi etc.) la o concentratie de 10-6 molar sau mai putin. Aceasta situatie este folositoare daca produsii de reactie sunt aderenti. In domeniul biomaterialelor, pasivitatea poate fi sau nu adecvata : distrugerea unui strat pasiv poate cauza o crestere a gradului de coroziune. Starea de echilibru poate avea loc daca produsii de reactie sunt indepartati de fluidul din tesut. Materialele actioneaza diferit in refacerea unui strat pasiv care a fost afectat. Acest strat de
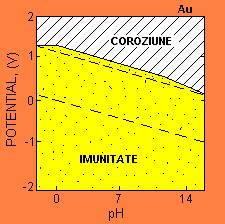
Figura 5-12. Diagrama Pourbaix pentru un metal imun : aurul. (Dupa M.Pourbaix,
Atlas of
Electrochemical Equilibria in Aqueous Solutions, NACE, Houston/CEBELCOR,
material poate proteja materialul de baza daca acesta este ferm aderent sau nonporos ; in acest caz coroziunea ulterioara este impiedicata. Pasivizarea poate fi cauzata si de o polarizare concentrata datorata unui "zid" de ioni langa electrozi. Acest lucru rareori poate avea loc in corp de vreme ce ionii sunt permanent completati. Reactiile de depolarizare catodica pot participa la pasivizarea unui metal prin intermediul unei bariere de energie care impiedica cinetica. Cateva exemple sunt ecuatiile (5-5) si (5-6).
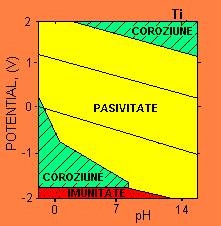
Figura 5-13. Diagrama Pourbaix pentru un metal pasiv : titaniul. (Dupa M.Pourbaix,
Atlas of Electrochemical Equilibria
in Aqueous Solutions,
NACE, Houston/CEBELCOR,
In figurile 5-11 la 5-14 exista doua linii diagonale. Linia de sus (oxigenul) reprezinta limita superioara a stabilitatii apei si este asociata cu solutiile bogate in oxigen sau electrolti alaturi de materiale oxidante. In regiunea de deasupra liniei, oxigenul evolueaza conform ecuatiei 2H2O → O2 + 4H+ + 4e-. In corpul uman, saliva, fluid intracelular, si lichidul interstitial ocupa regiuni langa linia de oxigen, de vreme ce ele sunt saturate cu oxigen. Linia diagonala inferioara (hidrogenul) reprezinta limita inferioara a stabilitatii apei. Hidrogenul gazos evolueaza conform ecuatiei (5-5). Coroziunea apoasa are loc in regiunea dintre cele doua linii diagonale din diagrama Pourbaix. In corpul uman, urina, bila, tractul gastrointestinal inferior si secretiile glandelor netubulare ocupa regiunea de deasupra liniei de hidrogen.
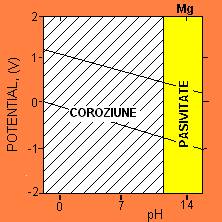
Figura 5-14. Diagrama Pourbaix pentru Mg. Regiunea hasurata : coroziune ; regiunea nemarcata : pasivitate. (Dupa M.Pourbaix, Atlas of Electrochemical Equilibria in Aqueous Solutions, NACE, Houston/CEBELCOR, Brussels,1974)
Semnificatia diagramei lui Pourbaix este urmatoarea. Diferite parti ale corpului au pH diferit si concentratii de oxigen diferite. Astfel, un metal care se comporta bine (este imun sau pasiv) intr-o parte a corpului poate suferi o coroziune accentuata in alta parte. Mai mult, pH-ul isi poate schimba dramatic valoarea in tesuturi care pot fi ranite sau infectate. In particular, un lichid obisnuit din tesut are pH de aproximativ 7,4, dar intr-o rana poate scadea la 3,5, iar in infectie poate creste la 9,0.
Diagramele Pourbaix sunt folositoare, dar nu spun intreaga poveste ; sunt limitate. Ele sunt realizate in functie de echilibrul dintre metal, apa si produsii de reactie. Prezenta altor ioni, ex. cloruri, pot avea comportament foarte diferit, iar moleculele mari pot si ele sa schimbe situatia. Prezicerea "pasivitatii" poate fi uneori optimista, daca nu este luata in considerare probabilitatea reactiei.
3 Probabilitatea de coroziune si curbe de polarizare
Regiunile din diagrama Pourbaix specifica daca coroziunea va avea loc, dar nu determina probabilitatea. exprimata ca o densitate a curentului electric (curent pe unitatea de arie) depinde de potentialul la electrozi asa cum este aratat si in curbele de polarizare din figura 5-20. Din aceste curbe, se poate calcula numarul de ioni eliberati in tesut pe unitatea de timp, precum si grosimea metalului inlaturat de coroziune intr-un timp dat. Un experiment alternativ este acela in care masa pierduta a unui specimen de metal din cauza coroziunii este masurata in functie de timp.
Probabilitatea coroziunii depinde si de factorii sinergetici, cum ar fi cei de origine mecanica. De exemplu, oboseala, deformarea repetataa unui metal intr0un mediu coroziv, ce produce accentuarea coroziunii si microafectiunilor cauzate de oboseala. De vreme ce mediul corpului uman presupune atat aplicarea unei forte mecanice repetitiv cat si prezenta unui mediu chimic agresiv, testarea la oboseala a materialelor folosite pentru implant ar trebui facuta intotdeauna in conditiile unui mediu fisiologic : solutia lui Ringer la temperatura camerei. In coroziunea prin macinare frecarea de o parte si de alta distruge stratul de pasivizare, provocand coroziune accelerata. In ingropare, coroziunea este accelerata in local. Metalele inoxidabile sunt vulnerabile la acest proces. Coroziunea localizataare loc daca metalul sau mediul nu sunt omogene. Legaturile dintre grupari intr-un metal pot fi suspectate de inceput de coroziune din cauza nivelului ridicat de energie. Fisurile sunt vulnerabile la coroziune, de vreme ce mediul chimic din fisura poate fi diferit de mediul inconjurator. Suprafata de contact dintre surub si suprafata osoasa de exemplu poate suferi coroziune in fisuri.
4. Coroziunea metalelor disponibile
Alegera unui metal pentru implantare ar trebui sa se faca in functie de proprietatile corozive discutate mai sus. Metalele folosite curent precum biomaterialele includ aurul, aliajele Co-Cr, metalul inoxidabil tipul 316, titanul, aliajul Ni-Ti si amalgamul Ag-Hg.
metalele nobile sunt imune la coroziune si ar fi materiale ideale daca rezistenta la coroziune ar fi singura conditie. Aurul este foarte des utilizat in coroanele dentare, oferind performanta superioara si longevitate. Cu toate acestea, aurul nu este folosit in aplicatii ortopedice din cauza densitatii sale mari, rezistenta insuficienta si costul mare.
Titanul este un metal de baza din seria electrochimica; cu toate acestea, formeaza un strat pasivizant robust (Figura 5-18), ramanand pasiv in conditii fiziologice. Curentii de coroziune in conditii normale saline sunt foarte slabi : 10-8 A/cm2. Implanturile de titan raman in aparenta neschimbate. Ti ofera o rezistenta la coroziune superioara, dar nu este la fel de dur si rezistent ca otelul.
Aliajele Co-Cr ,ca si Ti, sunt pasive in corpul uman. Sunt folosite foarte des in aplicatiile ortopedice.
Metalele inoxidabile contin indeajuns crom pentru a avea rezistenta la coroziune prin pasivizare. Stratul pasiv nu este la fel de robust ca in cazul Ti sau aliajului Co-Cr. Doar cele mai rezistente la coroziune dintre metalele inoxidabile sunt potrivite pentru implanturi. Acestea sunt tipurile austenitice 316, 316L, 317 (AISI) si 10TiMoNiCr175, 2MoNiCr175 (STAS) care contin Mo. Chiar si acestea sunt vulnerabile la coroziunea in fisurile din jurul suruburilor.
Amalgamul dentar este un aliaj de Hg, Ag, si Sn. Cu toate ca fazele sunt pasive la pH neutru, potentielul transpasiv pentru etapa 2 este un pic exagerat, din cauza cuplurilor galvanice interfazice sau potentialelor, datorate aerisirii diferite sub placa dentara. De aceea, amalgamul adesea corodeaza si este cel mai activ material coroziv folosit in stomatologie.
5. Minimalizarea coroziunii: studii de caz
Cu toate ca investigatiile de laborator sunt esentiale in alegerea metalului, evaluarea clinica continua este de asemena esentiala. Coroziunea unui implant in mediu clinic se poate manifesta prin simptome precum dureri locale sau imflamarea portiunii cu implant, fara dovada de infectie ; craparea sau ruperea implantului observate pe radiografii, o excretie excesiva de ioni metalici. Prin operatie, se poate observa o decolorare gri-negru a tesutului inconjurator si fasii de metal pot fi gasite in tesut. De asemenea coroziunea este cauza esuarii mecanice a implanturilor ortopedice, mai ales din cauza oboselii si prezentei mediului salin, care accentueaza oboseala. Urmeaza cateva cazuri specifice :
Cazul 1. Ruperea unui implant total de sold dupa 1.5 ani de uzura.
Dupa radiografie, s-a observat fractura la nivel de radacina femurala superioara. Implantul femural a fost indepartat prin operatie si analizat. Era fabricat din metal inoxidabil turnat. Cimentarea implantului nu a fost alegerea cea mai buna, dar adecvata. Alegerea materialului a fost considerata proasta pentru asemenea aplicatie pretentioasa. Metalele inoxidabile turnate sunt mecanic inferioare celor forjate. Astfel, doar cateva zgarieturi facute la implantare pot provoca coroziunea fisurilor.
cazul 2. Radiografia bratului unui pacient. O placa osoasa (figura 5-21) a fost lasata acolo 30 de ani.
Suruburile isi pierdusera forma din cauza coroziunii. Iar efectul iritant al coroziunii a dat nastere proliferarii osoase. Placa era din vanadiu, considerat potrivit im 1920, dar abandonat in prezent.
Cazul 3. radiografia unei artroplastii a aratat ca implantul fusese facut din fier normal (figura 5-22) pentru a suda trohantreul osteotomizat.
Cartilajul fusese facut din CoCrMo. Surubul a fost indepartat si era puternic corodat. Tehnica sablonarii este foarte rar folosita azi, iar chirurgii de azi nici nu s-ar gandi sa foloseasca un cui comun.
Cazul 4. Un pacient s-a plans de dureri si imposibilitatea de a-si misca umarul.
Suruburile au fost indepartate si examinate. Unul era de CoCrMo iar celalalte din otel inoxidabil. Coroziunea bimetalica avusese loc. Asemenea cazuri pot fi evitate Asemenea cazuri pot fi evitate prin eforturi mai ale chirurgilor in a evita metalele mixte.
Cazul 5. O fisura adanca intr-un implant la sold a fost obesvata la radiografie (figura 5-24).
Dupa inlaturarea metalului s-a descoperit prezenta unei coroziuni avansate. Metale diferite fusesera implantate neintentionat.
Experienta in implanturi ortopedice sugereaza ca procesul de coroziune poate fi incetinit astfel :
1. Folosirea unor metale adecvate.
2. Evitarea implantarii unor metale diferite in aceeasi zona. In procesul fabricarii, sa se foloseasca aliaje formate din elemente din aceeasi clasa, de acelasi tip.
3. Modelul sa fie realizat astfel incat cavitatile si fisurile sa fie inlaturate.
4. In chirurgie, a se evita transferul de metale de la instrumente in tesut sau implant. Daca nu au fost luate precautii, a se evita contactul dintre instrumentele de metal si implant.
5. A fi constient de faptul ca un metal care rezista la coroziune intr-o regiune a corpului, poate intra in coroziune intr-o alta zona a corpului.
Experienta in implanturile dentare a dus la urmatoarele concluzii in ceea ce priveste incetinirea coroziunii :
1. A se evita folosirea de metale diferite In apozitie sau, daca se poate, in aceeasi cavitate bucala.
2. A se folosi o baza izolatoare in aplicarea de implanturi metalice pentru a micsora conductia electrca inainte de finalizarea implantului.
3. A se evita conditiile e duc la formarea placii, avind in vedere ca zonele acoprite cu placa vor prezenta pH redus. Aceasta poate duce la coroziune.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |