Energia este definita drept capacitatea de a furniza caldura sau lucru si putem formal scrie:
Energie = Caldura + Lucru
Energia la randul ei poate fi cinetica sau potentiala. Energia cinetica este energia miscarii (cantitatea de energie cinetica a unui corp de masa m ce se misca cu viteza v este data de relatia Ec=1/2(mv2)). In contrast, energia potentiala reprezinta energia stocata intr-un obiect ca urmare a pozitiei sale relative in raport cu un sistem de referina, sau intr-o simpla molecula ca urmare a legaturilor chimice intre atomii componenti. Energia termica este energia cinetica a miscarii moleculare pe care noi o masuram gasind temperatura unui obiect, mediu, etc. Un obiect sau mediu este perceput ca rece atunci cand atomii si/sau moleculele lui se misca incet. Dimpotriva este perceput cald, daca atomii si/sau moleculele lui se misca rapid. Caldura reprezinta cantitatea de energie cinetica transferata de la un obiect (mediu) la altul ca rezultat al diferentei de temperatura dintre ele.
A) Stari initiale si finale. Pentru a introduce notiunea de stare vom considera o reactie chimica simpla. In cursul reactiei dintre hidrogen si oxigen care duce la formarea apei apare o modificare: legaturile care unesc atomii de hidrogen dispar si se formeaza noi legaturi care unesc atomii de hidrogen si oxigen.
2H2 + O2 2H2O
Reactia este insotita de degajare de caldura. Starea initiala este caracterizata de faptul ca atomii de hidrogen si oxigen se gasesc uniti in molecule de hidrogen si oxigen ce sunt gaze. Starea finala este caracterizata de faptul ca oxigenul este legat de hidrogen in molecula apei care este lichida. Caldura degajata in urma reactiei este de fapt diferenta energetica intre starea initiala si starea finala.
B) Factori ce influenteaza trecerea de la starea initiala la starea finala: Pentru a masura diferenta energetica intre stari trebuiesc cunoscuti urmatorii factori:
- starea de agregare a substantelor care intra in reactie;
- starea de agregare a substantelor care ies din reactie;
- temperatura la care are loc reactia;
- daca reactia decurge la volum constant (mai ales daca reactantii se gasesc sub forma gazoasa);
- daca reactia decurge la presiune constanta;
- cantitatile de substante implicate in reacte.
Tinand cont de de cele enumerate in cazul reactiei de formare a apei putem scrie:
2H2(g)+ O2(g) 2H2O(l) 25 oC
si putem afirma ca 2 moli de hidrogen gazos reactioneaza cu 1 mol de oxigen gazos pentru a forma doi moli de apa lichida Daca reactia are loc intr-o incinta cu volumul V (de exemplu in bomba calorimetrica) la temperatura de 25 oC atunci reactia de formare a apei se formuleaza astfel:
2H2(g)+ O2(g) 2H2O(l) 25 oC , V- constant
Caldura ce insoteste o reactie chimica se poate masura cu calorimetrul, ale carui componente sunt prezentate in Figura 51. Bomba calorimetrica este un vas cu pereti grosi care este cufundata intr-o incinta izolata termic de exterior si care contine apa. Cunoscand caldurile specifice ale materialului bombei si ale apei ,variatia temperaturii fiind masurata cu termometrul, se poate estima caldura degajata in urma reactiei din bomba calorimetrica cu ajutorul relatiei:
Q = mc∆t
Caldura calculata in urma desfasurarii unei reactii in bomba calorimetrica corespunde caldurii de reactie la volum constant.
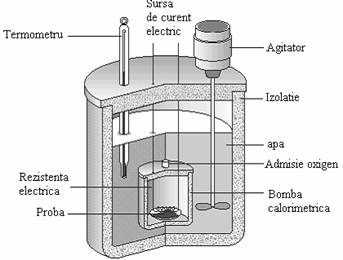
Figura 51. Componentele unui calorimetru
Am vazut ca efectul termic ce insoteste ruperile si refacerile de legaturi chimice poate fi masurat in conditiile in care reactia are loc intr-o incinta cu volum V. Dar masuratoarea ne da doar diferenta intre starea sistemului inainte si dupa reactie si nu ne spune nimic despre incarcarea energetica a sarii initiale si finale. Fizicienii au aratat ca un ansamblu de molecule aflate la o temperatura T are o anumita energie care este compusa din contributiile mai multor energii, unele dintre ele fiind masurabile, altele greu masurabile cum ar fi:
- energia de legatura a atomilor in molecula;
- energia de formare a nucleului;
- energia de vibratie a legaturilor din molecula;
energia de translatie;
- energia electronilor in molecula;
- energia de rotatie si altele.
Suma tuturor acestor energii este notata cu E si se numeste energie interna. Intr-o reactie chimica noi masuram de fapt diferenta intre energia interna a starii finale si energia interna a starii initiale.
∆E = Efinal - Einitial
Daca revenim la reactia intre hidrogen si oxigen atunci ceea ce masuram noi este:
∆E = 2E H2O(l) - ( 2EH2(g)+EO2(g))
Pentru reactia dintre oxigen si hidrogen aceasta variatie a fost masurata in bomba calorimetrica si este de:
∆E = -564.1 kJ
Deoarece masurarea s-a facut in calorimetru, reactia a avut loc la volum constant iar ∆E depinde numai de energia interna a produsilor de reactie si a reactantilor.
Marea majoritate a reactiilor chimice au loc la presiune constanta (in vase deschise) si nu la volum constant (in calorimetru). Caldura de reactie la presiune constanta este diferita de cea la volum constant. Daca reactia intre oxigen si hidrogen are loc intr-un vas deschis, atunci asupra sistemului intial compus din amestecul celor doua gaze se exercita presiunea atmosferica adica asupra sistemului se exercita lucru mecanic. Daca reactia ar decurge cu marirea volumului, atunci sistemul ar exercita lucru asupra atmosferei. In ambele cazuri continutul energetic al starii finale ar fi afectat:
- in primul caz starea finaa ar fi mai bogata in energie;
- in cel de-al doilea caz mai saraca in energie.
Ne imaginam urmatorul experiment: intr-un cilindru cu piston (care nu are nici o greutate) se afla 2 moli de H2 si 1mol de H2 (starea initiala). Reactia are loc obtinandu-se 2 moli de H2O in stare lichida (starea finala). Locul ocupat initial de volumul reactantilor este ocupat de aer. Astfel pistonul se va deplasa in jos pana la limita volumului apei. Prin urmare atmosfera executa asupra sistemului un lucru de compresie notat p ∆V (Figura
Daca revenim la cazul apei atunci constatam ca reactia are loc cu reducere de volum (consideram volumul molar de 22.4 l, iar densitatea apei lichide o consideram 1g/cm3 si deci 36 g de apa ) iar aceasta reducere de volum este de
Vf - Vi = (0.036 l - (2 x 22.4 l l
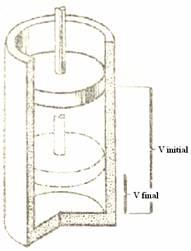
Figura 52. Lucrul de tip presiune volum (p∆V) la presiune constanta
Asadar starea finalar este mai bogata in energie exact cu lucrul p∆V (1atm x (0.036 - (2 x 22.4 + 22.4) si tinand cont de faptul ca 1atm x 1 l = 101.3 J ) care va avea valoarea de -7.3kJ
Deoarece majoritatea reactiilor au loc in vase deschise, la presiune constanta, in ele este implicat intotdeauna un lucru mecanic de tip presiune volum. Daca reactiile au loc intre lichide sau solide si variatia volumului este mica atunci lucrul este nesemnificativ, daca insa volumul se modifica lucrul de tip presiune volum devine important. Energia interna la care se adauga lucrul de tip presiune volum se numeste entalpie. In cazul proceselor care au loc la presiune constanta, modificarea entalpiei este legata de modificarea energiei interne prin relatia:
∆H = ∆E + p∆V
In cazul reactiei dintre oxigen si hidrogen la 25 oC, ∆H este
∆H = ∆E + p∆V = -564,1 kJ - 7.3kJ =-571,4 kJ
si se utilizeaza notatia ∆H298 .Reactia are loc in conditii standard adica la o atmosfera si la 25 C (298 K). Prin urmare prin ∆H se va intelege energia ce insoteste o reactie ce are loc la presiune constanta. Ea se raporteaza de obicei la un mol de substanta produsa in reactie. In cazul apei ∆H va fi 571.4/2= 285,6 kJ/mol. In general pentru o reactie caldura masurata la presiune constanta este calculata cu relatia
∆Hreactie = ∆Hprodusi - ∆H reactanti
Reactiile care decurg cu ∆H<0 se numesc reactii exoterme, iar cele care decurg cu ∆H>0 se numesc reactii endoterme. In reactiile exoterme caldura este cedata mediului, in reactiile endoterme caldura este absorbita(sau furnizata) din mediu.
A) Entalpia de formare: Pentru a putea compara diferite experimente termochimice s-a cazut de acord sa se stabileasca o serie de stari standard.
Pentru elemente:- starile standard sunt acele forme fizice ale elementului care sunt stabile la 1 atm si 25 C.
Pentru compusi:- starea standard este acea stare fizica (solida , lichida sau gazoasa) care se indica prin indice la formula compusului si care e stabila la 1 atm si 25 C.
Spre exemplu: pentru apa, starea standard este starea lichida H2O(l), pentru hidrogen starea sa standard este starea gazoasa H2(g), pentru Br2 starea sa standard este lichida Br2(l)
Variatia de entalpie care are loc atunci cand se formeaza un mol dintr-un compus in starea sa standard, din elementele corespunzatoare in starea lor standard se numeste caldura de formare sau entalpie de formare.
Entalpia de formare a substantelor elementare in starea lor standard este considerata prin conventie 0. Asadar valoarea pe care am obtinut-o in cele doua experimente pentru efectul termic ce insoteste formarea apei din elemente reprezinta chiar entalpia de formare a apei. Entalpiile de formare se noteaza cu ∆Hof (sau ∆Hof 298) Pentru reactia dintre oxigen si apa scriem:
2H2(g)+ O2(g) 2H2O(l) 25 oC , 1 atm ∆H = -571,4 kJ
dar deoarece entalpia de formare se raporteaza la 1 mol de substanta, valoarea lui ∆H se va imparti la 2, astfel ca entalpia de formare a apei este ∆Hof = - 285,7 kJ/mol
Valorile caldurilor de formare (∆Hof) pentru diversi compusi se gasesc tabelate si sunt date in ANEXA
B) Utilitatea caldurilor de formare (a entalpiilor de formare) rezulta evident din formularea legii lui Hess care afirma ca: "modificarea totala a caldurii de reactie este independenta de numarul si tipul etapelor prin care trece reactia" sau intr-o formulare echivalenta : "caldura absorbita sau degajata intr-o reactie chimica este constanta si este determinata numai de starea initiala si de starea finala a sistemului, indiferent de calea de reactie.
Aplicabilitatea legii si utilitatea ei va fi ilustrata de urmatorul exemplu:
C(s)+ O2(g) CO2(g) ∆H1 = -393.2 kJ (1)
dar carbonul se poate intai oxida pana la monoxid de carbon ca apoi acesta sa se oxideze la dioxid de carbon conform reactiilor:
C(s)+1/2 O2(g) CO(g) ∆H2 = -110.4 kJ (2)
CO(g)+1/2 O2(g) CO2(g) ∆H3 = -282.2 kJ (3)
C(s)+1/2 O2(g) + CO(g)+1/2 O2(g) CO(g) + CO2(g) ∆H2 + ∆H3
Daca se aduna reactiile 2 si 3 se observa ca suma caldurilor de reactie reprezinta tocmai caldura de ardere a unui mol:
∆H2 + ∆H3 = ∆H1
O consecinta a legii lui Hess este legea lui Lavoisier-Laplace: "in reactiile reversibile, caldura reactiei directe este egala cu caldura reactiei inverse".
Exemplu: CH4(g) = C(g) + 4H (g) ∆H = 1665 kJ
C(g) + 4H (g) = CH4(g) ∆H = -1665 kJ
O importanta deosebita ce decurge din aceasta lege consta in posibilitatea estimarii energiei legaturilor chimice
C) Energia legaturilor - Prin energia legaturii intelegem energia medie necesara pentru a rupe toate legaturile de un anume tip dintr-un mol de molecule in stare gazoasaa pentru a forma atomi aflati in stare gazoasa.
Doua exemple vor ilustra forta afirmatiei de mai sus:
a) Energia legaturii O-H din molecula apei este egala cu jumatate din entalpia reactiei:
H2O(g)→ 2H(g) + O(g) ∆H = 924.4kJ
deci EO-H = ˝ (∆H) = 462.2 kJ
b) Energia legaturii C-H din molecula de metan este egala cu a patra parte din entalpia reactiei:
CH4 (g)→ 4H(g) + C(g) ∆H = 1665 Kj
deci EC-H = 1/4(∆H) = 416 kJ
D) Caldura de dizolvare: De cele mai multe ori la dizolvarea unui solid (edificiu cristalin) intr-un solvent se constata ca solutia se raceste sau se incalzeste.Prin urmare dizolvarea este insotita de absorbtie sau degajare de caldura: "caldura degajata sau absorbita la dizolvarea unui mol de substanta intr-o cantitate foarte mare de solvent se numeste caldura molara de dizolvare"
E) Caldura de neutralizare: in cazul in care se neutralizeaza solutii de acizi tari cu solutii de baze tari indiferent care ar fi ei are loc reactia:
H3O+ + OH- 2H2O +Q
Caldura degajata atunci cand un ion-gram de hidroniu reactioneaza in solutie diluata cu un ion-gram de ioni hidroxid pentru a forma o molecula gram de apa se numeste caldura de neutralizare.
Caldura de neutralizare este intotdeauna aceeasi: -57,27 kJ/echivalent de acid sau baza.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |