Echilibrul de schimb ionic
Echilibrul de schimb ionic are o mare importanta teoretica si practica. Cand un schimbator de ioni continand ionii A vine in contact cu o solutie continand contraionii B, ionii A vor difuza in solutie si o cantitate echivalenta de contraioni B vor difuza in interiorul particulei de schimbator. Acest schimb continua pana ce este atinsa starea de echilibru, conform ecuatiei reversibile 1.8:
![]() (1.8)
(1.8)
Starea de echilibru nu depinde de sistemul initial. In starea de echilibru ambele faze, solutia si schimbatorul contin ambele tipuri de ioni. Schimbul ionic se desfasoara strict stoiechiometric. Raportul concentratiilor celor doua specii de contraioni A si B in schimbatorul de ioni e diferit de cel din solutie. Schimbatorul de ioni prefera anumite specii de contraioni altora. Echilibrul procesului de schimb ionic poate fi caracterizat prin izoterma de schimb ionic.
Izoterma de schimb ionic descrie, sub forma unei functii sau diagrame, la o temperatura data ca fiind constanta, dependenta compozitiei chimice a schimbatorului de ioni de compozitia mediului de contactare (conditiile experimentale). Pentru schimbatori de ioni e preferabil sa se precizeze concentratiile in ambele faze - schimbator de ioni si solutie. Astfel izotermele de schimb ionic pot fi scrise in forma:
![]() sau
sau ![]() (1.9)
(1.9)
in care: ![]() este concentratia componentului i in milimoli pe gram de
solvent (molalitate),
este concentratia componentului i in milimoli pe gram de
solvent (molalitate), ![]() este concentratia
componentului i in milimoli pe gram de
solid gonflat,
este concentratia
componentului i in milimoli pe gram de
solid gonflat, ![]() concentratia
solutului i in moli pe litru (molaritate) de solutie iar
concentratia
solutului i in moli pe litru (molaritate) de solutie iar ![]() este concentratia in moli pe litru de rasina gonflata.
este concentratia in moli pe litru de rasina gonflata.
Coeficientul de
distributie a speciei
ionice i, este definit ca raportul concentratiilor speciei in schimbator
si respectiv in solutie. Poate fi definit un coeficient de
distributie molala, (![]() ) respectiv molara (
) respectiv molara (![]() )
)
![]() (1.10)
(1.10)
![]() (1.11)
(1.11)
Coeficientii de distributie corespund unui punct pe izoterma de sorbtie (schimb ionic) fiind raportul dintre valorile de pe ordonata si respectiv de pe abscisa ale concentratiilor componentului i in schimbator si respectiv in solutie. Numai in cazul unei izoterme liniare coeficientul de distributie este independent de concentratie.
Echilibrul mai poate fi descris de asemeni in termeni cantitativi ca factor de separare respectiv coeficient de selectivitate. De regula aceste cantitati variaza cu datele experimentale. Orice valoare specifica a unuia dintre acesti factori corespunde unui punct pe suprafata izotermei de schimb.
Metode empirice de descriere a echilibrului
In decursul timpului s-au cristalizat mai multe metode cu suport teoretic partial prin care sa se exprime cantitativ echilibrul de schimb ionic(Inglezakis si colab, 2002). Asupra acestora se prezinta aspectele considerate in continuare.
. Diagrama de echilibru
Utilizand concentratia molara a componentului i in cele doua faze (solutie si schimbator) si transformandu-le in fractii molare se poate ridica diagrama de echilibru a speciei i considerand pe abscisa fractia echivalenta a componentului i in faza lichida si pe ordonata pe cea a componentului i in schimbator.
De regula fractia ionica echivalenta a contraionului A in schimbator (sau fractia molara in cazul competitiei intre ioni cu
valente egale) e reprezentata ca functie de fractia
ionica echivalenta in solutie, in timp ce celelalte variabile sunt
mentinute constante. Fractia
ionica a speciei i in lichid (![]() ) e definita prin relatia(1.12) unde
) e definita prin relatia(1.12) unde![]() este concentratia totala in faza lichida.
Pentru faza schimbator aceeasi fractie (
este concentratia totala in faza lichida.
Pentru faza schimbator aceeasi fractie (![]() sau
sau ![]() ) are exprimarea data de relatia (1.13) sau (1.14)
) are exprimarea data de relatia (1.13) sau (1.14)
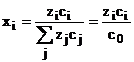 (1.12)
(1.12)
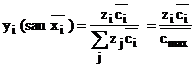 (1.13)
(1.13)
 (1.14)
(1.14)
In absenta unei reactii chimice prin care ionii isi pierd identitatea suma concentratiilor molare echivalente e intotdeauna o constanta:
![]()
In mod similar suma concentratiilor in faza schimbator sau suma incarcarii fazei schimbator este intotdeauna egala cu capacitatea de schimb:
![]() (1.16)
(1.16)
sau ![]()
Utilizand fractiile echivalente relatia electroneutralitatii devine:
![]() in solutie si
in solutie si ![]() in schimbator (1.17)
in schimbator (1.17)
Posibile de diagrame de echilibru sunt reprezentate in figura 1.15. De aici se pot deosebi sase tipuri de izoterme si anume:
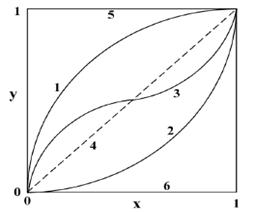
Figura 1.15- Forme ale diagramei de echilibru la schimbul ionic
(1) O izoterma convexa cu ![]() ; izoterma are o curbura
negativa si se afla deasupra diagonalei. In acest caz incarcarea fazei schimbator este
intotdeauna mai mare decat concentratia relativa a speciei in faza
lichida; ea se produce cand ionul
care trebuie retinut are o afinitate mai mare pentru rasina
decat ionul aflat initial in rasina .
; izoterma are o curbura
negativa si se afla deasupra diagonalei. In acest caz incarcarea fazei schimbator este
intotdeauna mai mare decat concentratia relativa a speciei in faza
lichida; ea se produce cand ionul
care trebuie retinut are o afinitate mai mare pentru rasina
decat ionul aflat initial in rasina .
O izoterma concava cu ![]() . Izoterma are o
curbura pozitiva si se afla sub diagonala cand ionul
care trebuie retinut este mai putin preferat decat cel continut
initial de aceasta;
. Izoterma are o
curbura pozitiva si se afla sub diagonala cand ionul
care trebuie retinut este mai putin preferat decat cel continut
initial de aceasta;
O izoterma in forma de S cu regiuni separate de preferinta sau nonpreferinta; Izotermele pot avea puncte de inflexiune datorita variatiei selectivitatii schimbatorului cu compozitia fazei lichide referitoare la specia ce se retine .
O izoterma liniara y = x; in acest caz nici unul din cei doi contraioni A si B nu este preferat, cand ionii au aceeasi valenta sau unul dintre ei se afla in concentratie foarte mare in solutia de alimentare.
O izoterma "orizontala"
y =1. Aceasta este asa numita izoterma ireversibila. Pentru
orice concentratie a solutiei ![]() concentratia
relativa a fazei schimbator este y=1.
concentratia
relativa a fazei schimbator este y=1.
O a doua izoterma "orizontala" y=0; acest caz indica faptul ca acolo nu exista sorbtie
Intr-un sistem ipotetic in care schimbatorul de ioni nu prefera pe A sau B, fractiile ionice echivalente in schimbator sunt aceleasi cu cele din solutie. Din aceasta cauza izoterma de schimb ionic este chiar diagonala diagramei. Originea si punctul final al oricarei izoterme trebuie sa se afle in colturile din stanga jos si respectiv dreapta sus ale diagramei deoarece la echilibru absenta contraionilor din solutie implica si absenta acestor ioni din schimbator. Pe de alta parte selectivitatea schimbatorului de ioni necesita devierea izotermei din pozitia de diagonala. Selectivitatea astfel necesita o izoterma neliniara. Din pacate acest factor a fost uneori scapat din vedere la analiza performantelor coloanelor cu schimbatori de ioni.
1.2. Aplicarea legii actiunii maselor la o problema de schimb ionic
Echilibrul schimbului ionic e adesea considerat in forma analoaga echilibrului chimic. Deci starea de echilibru e tratata prin intermediul legii actiunii maselor desi aceasta este definita exclusiv pentru sisteme omogene si nu sisteme heterogene.
In termenii unei reactii chimice si in completa analogie cu o reactie stoiechiometrica omogena, schimbul ionilor "A" (initial in schimbator) cu "B" (initial in solutie) se poate scrie astfel:
![]()
Constanta de echilibru la temperatura constanta si concentratii ale speciilor A si B exprimate molal numita si coeficientul de selectivitate molal se scrie conform relatiei (1.18):
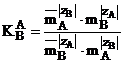 (1.18)
(1.18)
Utilizarea concentratiilor molare sau a fractiilor molare ionice ale componentilor participanti la reactie face ca exprimarea constantei de echilibru sa ia forma relatiei (1.19) (numita si relatia coeficientului de selectivitate molara) respectiv (1.20) (numita si relatia coeficientului de selectivitate fractional)
 (1.19)
(1.19)
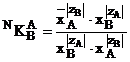 (1.20)
(1.20)
Pentru contraioni
cu valente egale (![]() )valorile coeficientilor de selectivitate sunt identice (1.21).
)valorile coeficientilor de selectivitate sunt identice (1.21).
![]() (
(![]() )
)
Pentru contraioni cu valente diferite, valorile numerice ale coeficientilor de selectivitate depind de alegerea modului de exprimare a concentratiei. Legatura dintre acestea este data de relatia (1.22).
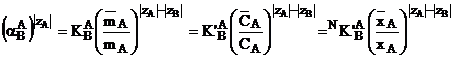
In
anumite situatii, indeosebi compozitia fazei lichide, impune utilizarea
unui coeficient de selectivitate corectat. Aceasta corectie include corectia pentru coeficientii de activitate din
solutie. Rezulta astfel ca pentru coeficientul de selectivitate
molala exprimarea corectata este cea data de relatia (1.23) in care![]() (i=A, i=B) este coeficient de activitate molal al speciei i.
(i=A, i=B) este coeficient de activitate molal al speciei i.
 (1.23)
(1.23)
Relatiile dintre constanta de echilibru si activitatile contraionilor in schimbatorul de ioni si in solutie depind in mod esential de definitia activitatilor si astfel de modelul pe care este bazata tratarea. O relatie simpla exista numai daca sorbtia electrolitului si modificarea umflarii pot fi neglijate. In acest caz constanta de echilibru este:
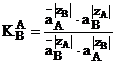
Relatiile (1.23) si (1.24) arata, la prima vedere, ca valorile numerice ale constantei de echilibru depind de alegerea starii standard. Multa confuzie a fost creata prin faptul ca acest fapt a fost pierdut uneori din vedere. Diferenta esentiala intre factorul de separare si coeficientul de selectivitate este ca cel din urma contine ca exponenti valentele ionice. Astfel factorul de separare este complet diferit de coeficientul de selectivitate daca valentele contraionilor competitori nu sunt egale.
1.3. Coeficient de distributie si factor de separare
Distributia ionilor A si B intre cele doua faze poate fi descrisa prin intermediul coeficientilor de distributie sau factorilor de separare. In anumite aplicatii practice, echilibrul este mai convenabil exprimat in termenii coeficientilor de distributie ai contraionilor cu concentratii exprimate molal si respectiv molar:
![]() si
si ![]()
Coeficientii de
distributie cresc cu dilutia solutiei (scade m si C). Mai
mult, daca schimbatorul de ioni prezinta selectivitate
(izoterma neliniara si astfel ![]() coeficientii depind de fractiile molare
echivalente. Utilizarea coeficientului de distributie e avantajoasa
daca speciile se afla in schimbator si respectiv in
solutie in cantitati foarte mici (de ex
coeficientii depind de fractiile molare
echivalente. Utilizarea coeficientului de distributie e avantajoasa
daca speciile se afla in schimbator si respectiv in
solutie in cantitati foarte mici (de ex ![]() ,
,![]() si in consecinta
si in consecinta ![]() ). In aceste cazuri schimbul se produce numai pe o
portiune scurta a izotermei aproape de origine. Uzual aceasta
sectiune scurta e practic liniara astfel ca in intervalul
considerat coeficientul de distributie e independent de
). In aceste cazuri schimbul se produce numai pe o
portiune scurta a izotermei aproape de origine. Uzual aceasta
sectiune scurta e practic liniara astfel ca in intervalul
considerat coeficientul de distributie e independent de ![]() .
.
Preferinta schimbatorului
pentru un contraion din doi este exprimata prin factorul de separare. Aceasta cantitate este utila in
aplicatii practice ca de ex in aprecierea
performantelor coloanelor de schimb ionic. Factorul de separare ![]() este dat de:
este dat de:
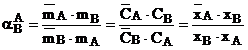 (1.25)
(1.25)
Factorul de separare este un raport al
concentratiilor celor doi contraioni in schimbator si in
solutie. Daca ionul A este preferat, valoarea factorului de separare![]() e mai mare decat unitatea si daca B este preferat
factorul e mai mic decat unitatea. Valoarea numerica a factorului de
separare (adimensional) nu este afectata de alegerea unitatilor
pentru concentratie. Factorul de
separare de obicei nu este constant el depinde de concentratia totala
a solutiei, temperatura si fractia molara echivalenta,
e mai mare decat unitatea si daca B este preferat
factorul e mai mic decat unitatea. Valoarea numerica a factorului de
separare (adimensional) nu este afectata de alegerea unitatilor
pentru concentratie. Factorul de
separare de obicei nu este constant el depinde de concentratia totala
a solutiei, temperatura si fractia molara echivalenta,
![]() . Pentru reactia
de schimb inversa factorul de separare este exprimat prin relatia (1.26)
. Pentru reactia
de schimb inversa factorul de separare este exprimat prin relatia (1.26)
![]() (1.26)
(1.26)
1.4 Constanta termodinamica de echilibru
Aceasta marime
termodinamica este, in unele cazuri, utilizata in studii teoretice. Ea este
definita prin legatura dintre variatia entalpiaei libere a reactiei de schimb
ionic(![]() ) si constanta de echilibru (
) si constanta de echilibru (![]() ) a acesteia (1.27)
) a acesteia (1.27)
![]() (1.27)
(1.27)
In contrast cu factorul de separare, coeficientul de selectivitate si coeficientul de distributie care se refera toate la niste conditii experimentale date si astfel corespund unui singur punct specific pe suprafata izotermei, constanta de echilibru este o caracteristica integrala a intregii suprafete a izotermei si este o constanta care depinde numai de temperatura. In consecinta constanta de echilibru da informatii despre distributia exacta a contraionilor indiferent de conditiile experimentale (Ahmad si colab, 2006).
1.5. Aproximarea Langmuir a izotermei de schimb ionic
Pentru descrierea echilibrului de schimb ionic poate fi folosita metoda Langmuir. Relatia Langmuir a fost initial derivata pentru adsorbtia gazelor pe o suprafata solida. Este bazata pe un model cu urmatoarele presupuneri de baza :
Viteza de adsorbtie a unui ion i este proportionala cu numarul de "locuri goale".
![]() (1.28)
(1.28)
Contrar cu aceasta viteza de desorbtie este proportionala cu incarcarea momentana cu specie i a schimbatorului:
![]() (1.29)
(1.29)
In starea de echilibru ambele viteze sunt egale ceea ce conduce la relatiile (1.30) sau (1.31) pentru exprimarea legaturii dintre concentratia in schimbator si cea din mediu a speciei i
 (1.30)
(1.30)
![]() ,
, ![]() (1.31)
(1.31)
Prin
intermediul raportului invers ![]() se obtine o alta forma de exxprimare a relatiei Langmuir:
se obtine o alta forma de exxprimare a relatiei Langmuir:
![]() (1.32)
(1.32)
Relatia Langmuir este aplicabila unei varietati de echilibre binare de schimb in schimbatori lipsiti de cationi sau anioni. Nu este aplicabila fenomenelor de schimb cu schimbatori amfoterici unde protonarea schimbatorului este functie de valoarea pH-ului fazei lichide.
Relatia Langmuir cuprinde doua marimi prin care este descris echilibrul: capacitatea totala qmax si constanta de echilibru sau constanta Langmuir b sau KL. Ambele cantitati pot fi deduse din valori experimentale prin intermediul calculelor de regresie neliniara sau prin intermediul a doua metode diferite de liniarizare. Astfel expresia de echilibru (1.27) poate fi scrisa si in forma echivalenta (1.33)
![]() (1.33)
(1.33)
Multiplicand peste tot in (1.33) cu c se obtine:
![]() (1.34)
(1.34)
Relatiile
(1.33) si (1.34) pot fi interpretate ca ecuatiile unor linii drepte. Prima
dintre ele arata o dependenta liniara intre 1/q si
1/c. Reprezentand grafic 1/q ca functie de 1/c se va obtine o linie
dreapta. Prin prelungire intersectia cu ordonata va fi egala cu ![]() si astfel se poate obtine qmax . Din
panta dreptei rezulta KL. A doua ecuatie este o
dependenta liniara c/q functie de concentratia c.
Reprezentand grafic c/q functie de concentratia c se va obtine o
dreapta de panta 1/qmax. KL este obtinut din
intersectia dreptei cu ordonata. Prima metoda de liniarizare
acorda o pondere mai mare datelor de echilibru la concentratii mici
cea de-a doua la concentratii mari.
si astfel se poate obtine qmax . Din
panta dreptei rezulta KL. A doua ecuatie este o
dependenta liniara c/q functie de concentratia c.
Reprezentand grafic c/q functie de concentratia c se va obtine o
dreapta de panta 1/qmax. KL este obtinut din
intersectia dreptei cu ordonata. Prima metoda de liniarizare
acorda o pondere mai mare datelor de echilibru la concentratii mici
cea de-a doua la concentratii mari.
Cazuri limita. Izoterma Langmuir
are doua importante cazuri limita. Pentru concentratii foarte mici in
solutie a speciei transferabile (![]() ),
), ![]() devine mic, aproape
egal cu 1. De aici rezulta ca:
devine mic, aproape
egal cu 1. De aici rezulta ca: ![]() ; aceasta este
ecuatia unei linii drepte care corespunde legii Henry.
; aceasta este
ecuatia unei linii drepte care corespunde legii Henry.
La
concentratii mari de echilibru: ![]() . De aceea
. De aceea ![]() . Aceasta inseamna ca incarcarea schimbatorului
este independenta de concentratie. Aceasta este asa numita
izoterma ireversibila care reflecta limita incarcarii
fazei schimbator in specia venita din lichid
. Aceasta inseamna ca incarcarea schimbatorului
este independenta de concentratie. Aceasta este asa numita
izoterma ireversibila care reflecta limita incarcarii
fazei schimbator in specia venita din lichid
In
cazul echilibrului tip Langmuir factorul de separare este constant si nu e
functie de concentratia fazei lichide. In consecinta,
izoterma in reprezentare dimensionala este intotdeauna simetrica
fata de a doua diagonala ![]() . Pentru un factor de separare (
. Pentru un factor de separare (![]() ) dat, izoterma rezulta din relatia (1.35)
) dat, izoterma rezulta din relatia (1.35)
![]() (1.35)
(1.35)
2 Metode experimentale
Pentru caracterizarea experimentala a echilibrului de schimb ionic pot fi utilizate mai multe metode experimentale intre care metoda "batch" si metoda cu strat fix de schimbator se autorecomada prin simplitatea si precizia lor.
Metoda batch. In cazul metodei batch, electrolitul este plasat intr-un tanc cu agitator si este amestecat cu rasina schimbatoare de ioni. Dupa atingerea echilibrului rasina este filtrata si eluentul este descarcat. Rasina de obicei nu este regenerata. Modul de desfasurare a experimentului e redat schematic in figura 1.16.

Figura 1.16 - Schema procedeului batch (schimb ionic discontinuu cu contact simplu)
In metoda batch echilibrul este determinat prin contactarea unei solutii de compozitie data cu un material schimbator de ioni la o compozitie cunoscuta a fazei schimbator.
In cazul unui
sistem binar bilantul de masa al sistemului poate fi exprimat prin relatia
(1.36) in care ![]() este masa materialului schimbator in forma
initiala,
este masa materialului schimbator in forma
initiala, ![]() reprezinta incarcarea initiala cu ioni A a schimbatorului
(eq/g),
reprezinta incarcarea initiala cu ioni A a schimbatorului
(eq/g), ![]() este incarcarea cu ioni A la echilibru a
schimbatorului (eq/g),
este incarcarea cu ioni A la echilibru a
schimbatorului (eq/g), ![]() constituie volumul fazei lichide (cantitatea de solutie)
supusa procesului de schimb ionic,
constituie volumul fazei lichide (cantitatea de solutie)
supusa procesului de schimb ionic, ![]() reprezinta
concentratia initiala a ionilor A in faza lichida (
eq/l),
reprezinta
concentratia initiala a ionilor A in faza lichida (
eq/l), ![]() este concentratia
la echilibru a ionilor A in faza lichida (eq/l)
este concentratia
la echilibru a ionilor A in faza lichida (eq/l)
![]() (1.36)
(1.36)
Rezolvand (1.36) se obtine pentru incarcarea de echilibru:
![]() (1.37)
(1.37)
In plus se va mai va avea in vedere ca cei doi componenti A si B trebuie sa satisafaca si cerintele (1.38) si (1.39)
![]() (1.38)
(1.38)
![]() (1.39)
(1.39)
Cu aceste relatii pot fi calculate concentratiile respective de echilibru si incarcarea contraionului B. Matematic relatia (1.37) este relatia linei de operare in raport cu starea initiala a sistemului. Capatul aceste linii este un punct al izotermei de schimb. Pot fi obtinute diferite puncte si poate fi dezvoltat echilibrul, asa cum arata reprezentarea din figura 1.17, prin doua metode:
a) variatia raportului ![]() la o concentratie initiala constanta
la o concentratie initiala constanta ![]()
b)variatia concentratiei
initiale ![]() la un raport constant
la un raport constant ![]()
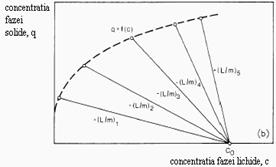
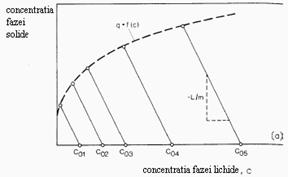
Figura 1.17 Exemplificare de valorificare a datelor de contactare batch schimbator -solulutie la identificarea izotermei de echilibru
Ambele metode conduc neaparat la rezultate identice deoarece variatia concentratiei initiale determina modificarea tariei ionice. La o concentratie initiala constanta, taria ionica este aproximativ constanta.
Metoda filtrului sau metoda
prin contactare in strat fix de schimbator de ioni. In
acest caz o solutie continand contraioni B curge peste un strat de
material schimbator incarcat cu ioni A. Concentratia de
alimentare este![]() . Procesul este stopat cand efluentul contine
contraionii B la concentratia influentului. Incarcarea
respectiva la echilibru cu ioni B adsorbiti de schimbator si
corespunzand la concentratia fazei lichide rezulta din relatia:
. Procesul este stopat cand efluentul contine
contraionii B la concentratia influentului. Incarcarea
respectiva la echilibru cu ioni B adsorbiti de schimbator si
corespunzand la concentratia fazei lichide rezulta din relatia:
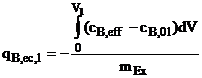 (1.40)
(1.40)
Mai multe puncte
ale izotermei de echilibru sunt obtinute prin cresterea
concentratiei de alimentare la ![]() si calculul
cantitatii de ioni adsorbiti din relatiile:
si calculul
cantitatii de ioni adsorbiti din relatiile:
 (1.41)
(1.41)
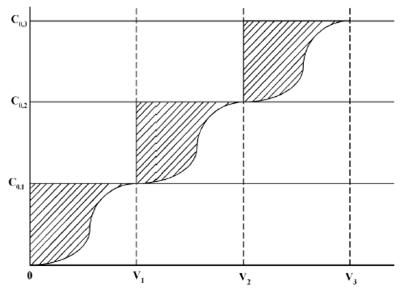
Figura 1.18 Curbe de strapuncere la identificarea echilibrului prin contactare in strat fix de schimbator de ioni
 (1.42)
(1.42)
Aceasta metoda solicita mai mult lichid decat cealalta metoda si astfel este aplicata numai in cazuri exceptionale. Toate metodele pot fi de asemenea aplicate pentru investigarea echilibrelor multicomponent.
3 Asupra termodinamicii procesului de schimb ionic
Exista numeroase modalitati de a descrie echilibrul de schimb ionic prin intermediul termodinamicii. Sunt intalnite o varietate de abordari termodinamice ale echilibrului de schimb ionic (Holl,1997). Acestea nu vor fi prezentate pe larg deoarece majoritatea dintre ele nu permit nici un calcul in sisteme practice. Asupra unora dintre ele se fac precizarile date mai jos.
Descriere Donnan. Din considerente de exprimare concreta este luat in considerare urmatorul sistem de schimb ionic:
![]()
Sistemul este considerat ca fiind faza schimbator in contact cu faza lichida. Ambele faze sunt separate de suprafata rasinii care este considerata ca o membrana. Datorita gradientului de concentratie ionii de hidrogen pot difuza in rasina si ionii de sodiu pot difuza in faza lichida. Ionii Cl- sunt faza mobila pe cata vreme ionii -SO3- nu pot difuza in lichid. Daca ionii Cl- difuzeaza in faza rasina, un deficit de sarcini negative apare in faza lichida si un surplus de sarcini pozitive in schimbator. Aceasta diferenta de potential determina o tensiune care afecteaza toate speciile. In consecinta conditia de stabilire a echilibrului este egalitatea potentialului electro-chimic in ambele faze.
![]() (1.43)
(1.43)
Potentialul electrochimic poate fi
exprimat in functie de potentialul chimic asa cum arata
relatiile (1.44) si (1.45) in care ![]() este potentialul chimic al componentului i,
este potentialul chimic al componentului i, ![]() este valenta
speciei i, F reprezinta constanta Faraday iar
este valenta
speciei i, F reprezinta constanta Faraday iar ![]() reprezinta potentialul
electric:
reprezinta potentialul
electric:
 (1.44)
(1.44)
![]() (1.45)
(1.45)
Pentru potentialul chimic pot fi
utilizate, neglijand termenul ce contine presiunea, relatii in raport cu ![]() (potentialul
standard de formare al speciei i )
(potentialul
standard de formare al speciei i )
![]() (1.46)
(1.46)
![]() (1.47)
(1.47)
Din relatiile
anterioare poate fi dedusa relatia (1.48) care exprima diferenta
de potential electric ![]() la granita dintre
faze:
la granita dintre
faze:
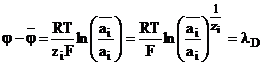 (1.48)
(1.48)
Aceasta diferenta de potential este denumita potential Donnan. Ea este o caracteristica a tuturor speciilor din sistem. Din relatia de exprimare a potentialului Donan se ajunge, spre exemplu la particularizarea din relatia (1.49) sau la generalizarea data de relatia (1.50):

Valenta zi este considerata pozitiva pentru contraioni si negativa pentru co-ioni. In consecinta se obtine:
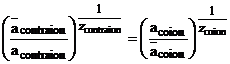 (1.50)
(1.50)
Doua exemple de aplicare a relatiei Donnan arata importanta acesteia:
a)
pentru ioni de valente
diferite spre exemplu ![]() relatia (1.49) ia forma (1.51). Ea arata ca specia
divalenta este preferata de schimbator mai mult decat cea monovalenta. Generalizand
se poate spune ca inschimbator ionii cu
valente mari sunt preferati
celor cu valente mici. In ce
priveste raportul
relatia (1.49) ia forma (1.51). Ea arata ca specia
divalenta este preferata de schimbator mai mult decat cea monovalenta. Generalizand
se poate spune ca inschimbator ionii cu
valente mari sunt preferati
celor cu valente mici. In ce
priveste raportul ![]() ordinul de marime este de la 10 la 1000 (activitatea speciei
i in rasina este de 10 →1000 ori mai mare ca activitatea la echilibru in
lichid)
ordinul de marime este de la 10 la 1000 (activitatea speciei
i in rasina este de 10 →1000 ori mai mare ca activitatea la echilibru in
lichid)
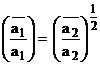 sau
sau 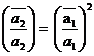
b) pentru cazul sorbtia co-ionilor particularizarea relatiei (1.50) gaseste relatia (1.52)
care cuplata cu
observatia ca ![]() demonmstreaza ca
intotdeauna coionii sunt, in mare masura, exclusi din
schimbator
demonmstreaza ca
intotdeauna coionii sunt, in mare masura, exclusi din
schimbator

Intensitatea
excluderii creste cu valenta lor; de exemplu ionii ![]() sunt mai puternic exclusi
din schimbator decat ionii Cl-.
sunt mai puternic exclusi
din schimbator decat ionii Cl-.
3.1 Descriere generala a echilibrului binar
Conditia de echilibru (1.42) pentru un sistem schimbator de ioni in care se schimba ionii 1 si 2 intre acesta si apa (w) se particularizeaza la forma (1.53)
![]()
Aplicand cu referire la relatia (1.53) conditiile de bilant de masa si neutralitate electrica ((!.54) - (1.56)) se ajunge la relatia (1.57) in care procesarea poate continua prin evaluarea termenului diferential (
![]()
![]()
![]()
![]()
![]()
![]()
Daca prin w se
exprima continutul de apa din schimbator iar prin y1 continutul de
specie ionica 1 in schiombator atunci variatia ![]() si variatia
si variatia ![]() se leaga de acestea
asa cum se arata prin intermediul relatiei (1.58). Consecinta acestei legaturi
este aceiqa ca relatia (1.57) ajunge la forma (1.59).
se leaga de acestea
asa cum se arata prin intermediul relatiei (1.58). Consecinta acestei legaturi
este aceiqa ca relatia (1.57) ajunge la forma (1.59).
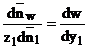
![]()
Substituirea potentialele chimice ( relatiile (1.46) si (1.47)) in (1.59) conduce , dupa rearanjare la expresia generala a constantei de echilibru pentru schimbul ionic dintre 2 ioni intre un lichid si un schimbator:
 (1.60)
(1.60)
Functie de modul in care se aproximeaza ![]() relatia (1.60) se mai
particularizeaza inca. Aproximarea "non-osmotica"e bazata
pe presupunerea ca, in faza schimbator, componentii sunt retinuti diferit
din solutia de electrolit si astfel activitatile
solventului in schimbator si in faza solutie sunt identice. Cu
aceste presupuneri expresia generala a constantei de echilibru se
particularizeaza la forma (1.61) care este in fapt expresia constantei de
echilibru ce rezulta prin particularizarea legii actiunii maselor la schimbul
ionic dintre speciile 1 si 2
relatia (1.60) se mai
particularizeaza inca. Aproximarea "non-osmotica"e bazata
pe presupunerea ca, in faza schimbator, componentii sunt retinuti diferit
din solutia de electrolit si astfel activitatile
solventului in schimbator si in faza solutie sunt identice. Cu
aceste presupuneri expresia generala a constantei de echilibru se
particularizeaza la forma (1.61) care este in fapt expresia constantei de
echilibru ce rezulta prin particularizarea legii actiunii maselor la schimbul
ionic dintre speciile 1 si 2
 (1.61)
(1.61)
Aproximarea osmotica echilibrul de schimb ionic e considerat ca o distributie a celor doi ioni intre schimbator si faza solutie, la diverse presiuni. Atunci apare o conditie suplimentara:
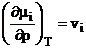 (1.62)
(1.62)
in care![]() este volumul partial molar. Egalitatea
potentialelor electrochimice atunci devine:
este volumul partial molar. Egalitatea
potentialelor electrochimice atunci devine:
![]() (1.63)
(1.63)
Inlocuind aceste conditii in ecuatia (1.59) devine:
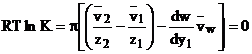 (1.64)
(1.64)
De obicei volumele
partial molare sunt constante. Dependenta lui![]() de
de![]() poate fi de obicei aproximata printr-o linie
dreapta.
poate fi de obicei aproximata printr-o linie
dreapta.
![]() (1.65)
(1.65)
Astfel se obtine:
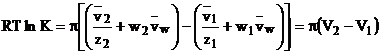 (1.66)
(1.66)
cu ![]() fiind volumul
echivalent al schimbatorului gonflat.
fiind volumul
echivalent al schimbatorului gonflat.
Versiunea osmotica pare sa corespunda bine proprietatilor polielectrolitilor cu reticulare scazuta sau moderata.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |