
Am vazut ca energia libera Gibbs, G, ajunge la un minim pentru T si p constante. Intrebarea este daca acesta are vreo legatura cu reactiile chimice si care? Prin definitie modificarea energiei libere Gibbs intr-o reactie este:
![]() (1)
(1)
Se subintelege ca atat reactantii cat si produsii sunt compusi puri, izolati, in starile lor standard si la aceeasi temperatura si presiune.
Cand am introdus prima data notiunea de caldura de reactie am spus ca nu este posibil sa calculam ΔH o pentru fiecare reactie posibila. In schimb, am facut tabele cu caldurile de formare a compusilor si am utilizat legea lui Hess pentru a determina caldura care insoteste reactia care implica compusii respectivi.
In mod asemanator vom defini energia libera Gibbs pentru formarea unui compus ca ΔG o pentru reactia:
Elemente pure izolate in starea lor standard → un mol produs in starea lui standard.
De exemplu ΔfG o pentru CO2(g) la 25o si 1 atm, se defineste a fi ΔG pentru reactia:
C(s, grafit) + 2 O2(g) → CO2(g).
Utilizand acum legea lui Hess, ΔrG o pentru o reactie aleasa arbitrar
a A + b B → c C + d D, (2)
va fi
ΔrG o = c ΔfGC o + d ΔfGD o − a ΔfGA o − b ΔfGB o. (3)
Rareori vom dori sa efectuam o reactie la volum constant si in consecinta va trebui sa modificam energia libera Helmholtz. Vom abtine ΔrAo utilizand aceeasi aproximatie care am utilizat-o pentru obtinerea valorii lui ΔU din ΔH.
Adica, din
![]()
observam ca
![]()
Utilizand precum anterior aproximatia ca variatia produsului pV este foarte mica pentru lichide si solide precum ca in cazul gazelor acestea se comporta precum un gaz ideal, obtinem ecuatia
![]() (4)
(4)
Stiind ca precum si faptul ca reactiile sunt procese la temperatura constanta, putem relationa energia libera Gibbs a reactiei cu entalpia de reactie, adica
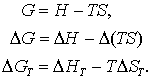 (5 a, b, c)
(5 a, b, c)
Am scris un indice T in ecuatia (5 c) pentru a indica faptul ca aceasta este valabila doar in cazul ca T este constanta ( cu toate ca nu este o practica uzuala!) De obicei avem:
![]() (6)
(6)
si sa lasa cititorului sa inteleaga ca ecuatia este valabila pentru o temperatura constanta.
Sa ne aducem aminte ca pentru T si p constante energia libera Gibbs atinge minimul. Aceasta inseamna ca putem folosi ΔrG o pentru a afla daca o reactie decurge spontan sau nu daca:
ΔrG o > 0 atunci reactia nu decurge asa cum a fost scrisa (reactia inversa este favorite!)
ΔrG o < 0 atunci reactia decurge asa cum a fost scrisa.
Din acest motiv multi folosesc expresia ΔrG o drept masura a "fortei conducatoare" a reactiei, cu toate ca utilizarea notiunii de forta este aici improprie. ΔrG o reprezinta mai corect ideea care ne indica noua daca o reactie este spontana sau nu.
Din ecuatia (6) ca aceea "forta conducatoare" a reactiei are de fapt doua componente:
ΔH conduce spre stabilitate. Cand ΔH< 0 produsii sunt mai stabili decat reactantii (reciproca fiind si ea valabila!)
ΔS conduce spre dezordine. Cand ΔS< 0 produsii sunt mai dezordonati decat reactantii.
Semnul negativ din fata produsului TΔ S arata ca un ΔS pozitiv aduce o contributie negativa la ΔG a negativ contributie care conduce reactia in sensul direct!
De notat ca odata cu cresterea temperaturii T creste si influenta ΔS asupra "fortei conducatoare" a reactiei.
Pentru o reactie chimica ΔH si ΔS sunt independente una fata de cealalta, adica nu putem calcula valoarea uneia din valoarea celeilalte. Sunt situatii in care ambele au valori pozitive, ambele au valori negative sau cazuri cand una este pozitiva si una este negativa. De remarcat ca in cazul in care semnul celor doua variabile este identic, ele lucreaza practic una impotriva celeilalte. Putem face ca entropia sa fie castigatoarea prin scaderea temperaturii.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |