Hidrocarburi
Hidrocarburile sunt compusi organici ai C cu H.
Tinand cont de natura hibridizarii atomului de C din molecula, hidrocarburile pot fi:
Saturate - contin in molecula numai atomi de C hibridizati sp3.
alcanii: CnH2n+2
cicloalcanii : CnH2n
Nesaturate - contin in molecula atomilor de C nesaturati, alaturi de atomi de C saturati:
alchenele: CnH2n (2 at. Csp2; Csp3)
dienele: CnH2n-2 (2x2 at. Csp2; Csp3)
alchinele: CnH2n-2 (2 at. Csp; Csp3)
Aromatice (arene) caracterizate prin prezenta cel putin a unui nucleu benzenic:
mononucleare: CnH2n-6 (ptr.n≥6)
dinucleare (cu nuclee condensate): CnH2n-12
trinucleare (cu nuclee condensate): CnH2n-18
1. Defintie. Caracteristici. Seria omologa.
Defintie. Se numesc alcani (parafine) hidrocarburile in molecula carora nu apar decat legaturi simple (C-C si C-H) si in care raportul numeric a celor doua tipuri de atomi este exprimat prin formula CnH2n+2 in care n reprezinta numarul de atomi de C din molecula.
Caracteristici. Alcanii sunt
-hidrocarburi, contin in molecula numai atomi de C si H,
-aciclice, au catena liniara sau ramificata deschisa,
-nesaturate (N.E.=0), contin, in molecula, un numar maxim de atomi de H la numarul atomilor de C considerat, in clasa hidrocarburilor.
Seria omologa. Definitie: o serie omologa cuprinde toti compusii apartinand aceleiasi clase structurale caracterizati fiind prin aceeasi formula generala ; doi termeni omologi (apartin aceleasi clase, sunt succesivi) se deosebesc intre ei printr-o grupare (- CH2 -), grupare metilenica.
Seria omologa a alcanilor.
Daca in formula generala a alcanilor se dau lui n valori intregi, se obtine seria omologa a alcanilor. Identificarea termenilor se face prin denumiri specifice - conform regulilor de nomenclatura I.U.P.A.C.
2. Nomenclatura alcanilor.
Primii patru termeni ai seriei omologe a alcanilor au denumiri specifice:
(n=1)metan, (n=2)etan, (n=3)propan respectiv(n=4)butan. Caracteristica este prezenta prefixului "an" de la .. alcan.
Pentru urmatorii termeni, de la n≥5, denumirea alcanilor se formeaza plecand de la numera-lul, in limba greaca , ce indica numarul atomilor de C din molecula, la care se adauga sufixul "an"
n CnH2n+2 alcan
CH4 metan
C2H6 etan
C3H8 propan
C4H10 butan
5 - penta C5H12 pentan
6 - hexa C6H14 hexan
7 - hepta C7H16 heptan
8 - octa C8H18 octan
9 - nona C9H20 nonan
10 - deca C10H22 decan
11 - undeca C11H24 undecan
12 - dodeca C12H26 dodecan
.
.
.
20 - eicosa C20H42 eicosan
2.1. Radicali organici
Radicalii organici sunt molecule organice provenite prin eliminarea unuia sau mai multor atomi de H. Sunt neutri din punct de vedere electric (sunt molecule), avand caracteristica prezenta unui numar de orbitali monoelectronici egal cu numarul atomilor de H indepartati din molecula initiala. In cazul radicalilor proveniti din alcani se obtine un rest hidrocarbonat( neutru din punct de vedere electric), cu orbitali monoelectronici, denumiti radicali alchili ( la singular-radical alchil).
Din punct de vedere electronic, un radical este o molecula ce poarta, la unul din atomii sai (sau la mai multi), un numar impar de electroni (acesti orbitali sunt ocupati, fiecare, de cate un singur electron).
Radicalii alchili au un nivel energetic foarte ridicat, fapt ce explica viata lor scurta, ei neexistand in stare libera. Acestia apar ca intermediari in timpul reactiilor chimice, stabilizandu-se in produsi de reactie.
Tinand cont de numarul de atomi de H teoretic eliminati din molecula unui alcan, radicalii alchil pot fi:
1. Monovalenti - provin dintr-un alcan prin eliminarea unui atom de H.Se noteaza R sau R-. Denumirea se formeaza prin inlocuirea sufixului "an" cu sufixul "il".
CH4 metan - CH3- metil
C2H6 etan - C2H5- etil
C3H8 propan - CH3-CH2-CH2- (propil; n-propil)
CH3-CH -CH3 (izopropil)
![]()
Prefixul izo utilizat in cazul propil arata starea de carboradical
Pentru butan, putem identifica doua structuri (izomeri de catena):
C4H10: CH3-CH2-CH2-CH3 n-butan ( n provine de la cuvantul normal, ceea ce inseamna o catena liniara,normala).
CH3-CH -CH3 izobutan (izo ne arata ramificarea catenei)
![]()
CH3
Pentru n-butan avem doua stari de carboradical:
CH3-CH2-CH2-CH2- n-butil
CH3-CH-CH2-CH3 sec-butil (sec ne arata stare de carboradical
![]()
Pentru izobutan avem alte doua stari de carboradical, respectiv:
![]() CH3-CH -CH2 - izo-butil (izo
ne arata stare de
carboradical
CH3-CH -CH2 - izo-butil (izo
ne arata stare de
carboradical
CH3
![]()
CH3-C -CH3 tert-butil (tert
ne arata stare de carboradical
![]()
CH3
2. Divalenti - rezulta prin eliminarea teoretica a doi atomi de H din molecula unui alcan. Denumirea se formeaza prin inlocuirea sufixului an cu
- sufixul ilen (pentru starea de carboradical vicinal) sau
- sufixul iliden (pentru starea de carboradical geminal) R sau -R-
CH4 metan - -CH2- metilen
![]() C2H etan - CH3-CH- etiliden
C2H etan - CH3-CH- etiliden
-CH2-CH2 - etilen
3.Trivalenti -rezulta teoretic prin eliminarea a trei atomi de H din molecula alcanului respectiv. Denumirea se formeaza prin inlocuirea sufixului an cu sufixul in. Se reprezinta:
![]() CH4 metan -CH- metin
CH4 metan -CH- metin
2.2. Nomenclatura IUPAC. Izoalcani
Izoalcanii nu reprezinta o alta clasa de hidrocarburi, ci sunt alcani ce au catena ramificata. Denumirea lor se face cu respectarea regulilor IUPAC.
Sa se denumeasca, conform IUPAC, izoalcanul:
![]()
![]() CH3-CH-CH3 CH3
CH3-CH-CH3 CH3
![]()
![]() CH3-CH-CH2-CH-CH2-C-CH2-CH3
CH3-CH-CH2-CH-CH2-C-CH2-CH3
CH2-CH3 CH3
o Se identifica catena cea mai lunga -noua; prefixul ptr. o catena de 9 at. C este non. Deoarece intre atomii de C din catena cea mai lunga se realizeaza numai legaturi simple, structura de baza va fi a unui un alcan - nonan.
o Se inconjoara cu linie intrerupta catena identificata ca fiind cea mai lunga.
Se numeroteaza atomii de C din catena cea mai lunga (stanga-dreapta).
o Se identifica substituentii. Sunt substituenti toate resturile hidrocarbonate sau gruparile functionale grefate pe catena principala.
o Identificarea substituentilor presupune
pozitionarea lor prin indici de pozitionare indentificand numarul atomilor de C la care se leaga gruparea functionala
identificarea numarului si tipul substituentilor:
- numarul substituentilor identici se indica prin prefixe:
mono (mai rar ), di ,tri ,tetra,penta,hexa
Ex: trei radicali metil -trece in .. trimetil
- numarul atomului de C la care se leaga gruparea
functionala se indica prin indici de pozitionare,
despartiti intre ei prin virgule.
-daca la acelasi atom de C avem substituenti identici,
aceasta se indica prin indici de pozitionare care se
repeta.
o Se compune numele:
![]() indici de pozitionare - nume substituent- numele catenei principale
indici de pozitionare - nume substituent- numele catenei principale
pentru un tip de substituent
-Indicii de pozitionare, in cazul existentei mai multor tipuri de
radicali ,se despart de denumirea radicalului prin liniute.
-Radicalii se aseaza in ordine alfabetica a numelui radicalului si nu
a prefixului ( mono, di, tri, ., )
-Numele radicalului poate implica prezenta prefixelor izo, sec, tert,
neo
Obtinem:
5- izopropil - 3, 7, 7- trimetil nonan (22)
o Se repeta intrega succesiune de operatii numerotand catena invers, de la dreapta la stanga. Obtinem:
5- izopropil - 3, 3, 7- trimetil nonan (18)
Este corecta nomenclatura in care suma indicilor de pozitionare este minima.
Este corecta a doua denumire.(18<22)
5- izopropil - 3, 3, 7- trimetil nonan
3. Izomeria la alcani.
Fenomenul de izomerie apare, in clasa alcanilor, sub forma izomeriei de
constitutie de tipul izomeriei de catena.
Izomeria de catena apare datorita posibilitatilor pe care le are un atom de C din catena de a fi: primar, secundar, tertiar sau cuaternar.
Izomerii se deosebesc prin modul de aranjare a atomilor de C componenti in ansamblul catenei. La alcani apare de la n≥
C4H10 are doua structuri izomere:
CH3-CH2-CH2-CH3 n-butan (n-normal, exista o catena normala, liniara)
![]() CH3-CH -CH3 izobutan (izo*
ne arata ramificarea catenei)
CH3-CH -CH3 izobutan (izo*
ne arata ramificarea catenei)
CH3 2-metil propan
C5H12 are trei structuri izomere:
CH3-CH2-CH2 -CH2-CH3 n-pentan
![]() CH3-CH - CH2-CH3 izopentan (izo* ne arata ramificarea catenei
dar
CH3-CH - CH2-CH3 izopentan (izo* ne arata ramificarea catenei
dar
CH3 este utilizat si pentru a arata prezenta
unei grupari metil
2-metil butan
![]() CH3
CH3
![]() CH3-C -CH3 neopentan ( neo
ne arata prezenta a doua
grupari metil
CH3-C -CH3 neopentan ( neo
ne arata prezenta a doua
grupari metil
CH3
2,2-dimetil propan
3. Structura alcanilor
Atomii de C din alcani sunt atomi de Csp3 (deci au structura tetraedrica). Ca atomi de Csp3 prezinta 4 orbitali hibrizi monoelectronici distribuiti,in spatiu, in modul cel mai simetric posibil, spre varfurile unui tetraedru regulat. Unghiul dintre axele de simetrie ale orbitalilor hibrizi este 109°28´. Prin intermediul celor 4 orbitali hibrizi sp3 se realizeaza 4 legaturi covalente σ deci 4 legaturi covalente simple .
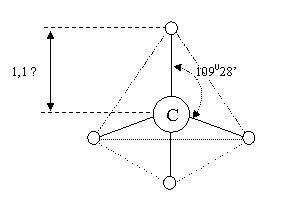
Metanul,CH4 cel mai simplu reprezentant al clasei, are structura tetraedrica, cu unghiul,intre axele orbitalilor hibrizi ,de 109°28´ formand 4 legaturi covalente de tip σ s-sp3 deci 4 legaturi covalente simple. In centrul tetraedrului se afla nucleul atomului de C. Lungimea legaturilor C-H este de 1,1 Å
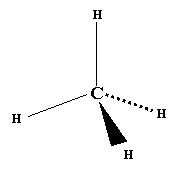 Metan CH4 :
Metan CH4 :
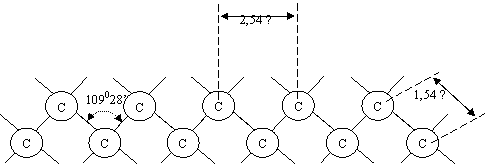
Legatura covalenta simpla este o legatura mobila, permitand rotirea libera a atomilor de C simplu legati in jurul axei de simetrie a legaturii. Tanand cont de posibilitatea realizarii legaturii C-C prin intermediul oricarui orbital hibrid, aranjamentul structural al unei catene cu Csp3 va fi intamplator, dar dintre structurile posibile cea mai stabila va fi cea in zig-zag, structura in care distanta dintre doi atomi de C consecutivi este de 1,54 Å, iar dintre 2 atomi de C alternativi este 2,54 Å.
4. Metode de obtinere. Starea naturala.
4.1.Metode de obtinere:
I. Industriale
Sinteza Bergius - Chimizarea carbunelui
Metoda Fisher-Tropsh
Chimizarea petrolului
II. Metode de laborator
Hidrogenarea hidrocarburilor nesaturate
Hidroliza carburilor metalice
Hidroliza compusilor organo-metalici
Sinteza Würtz
Sinteza Kolbe
Decarboxilarea acizilor carboxilici
I.Metode de obtinere industriale
I.1. Sinteza Bergius - chimizarea carbunelui
La baza chimizarii carbunelui sta ecuatia reactiei:
![]()
C+2H2 CH4
care are loc in sensul indicat de sageata la
I.2. Metoda Fisher-Tropsh
Metoda are la baza
procesul de hidrogenare a CO si a
fost descoperita in 1902 de Sabatiers si Senderens. Aceasta
consta in trecerea gazului de sinteza, la 250-
![]()
CO + 2H2 CH4 + H2O
In anul 1926 Fisher si Tropsh au extins metoda la obtinerea compusilor de tip alcanic cu catena marita folosind gazul de sinteza obtinut din conversia CH4 cu vapori de apa dupa ecuatia:
![]()
![]() CH4 + H2O CO + 3H2
CH4 + H2O CO + 3H2
Gazul de sinteza obtinut, la
![]()
n(CO + 2H2) + H2 CnH2n+2 + nH2O
Sinteza Fisher a fost aplicata pana in 1940 in vederea obtinerii benzinei sintetice; a fost parasita pentru ca pretul de cost al procedeului este mult mai ridicat decat cel al obtinerii benzinei de extractie.
II. Metode de laborator
II.1. Hidrogenarea hidrocarburilor nesaturate
Hidrocarburile nesaturate contin un anumit numar de legaturi p care prin aditie de H2 conduc, in conditii catalitice (cataliza eterogena), la alcanii corespunzatori. La baza reactiei sta schema:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() C C + H2 C C
C C + H2 C C
alchena alcan
(Se observa ca pentru o legatura p se consuma un mol de H2) .
Hidrogenarea alchenelor: reactia are loc pe catalizator Ni-Raney
la 80-
![]() CnH2n + 2H2 Ni-Raney CnH2n+2
CnH2n + 2H2 Ni-Raney CnH2n+2
Amestecul 1 si 2-butena conduce prin hidrogenare la n-butan:
![]()
CH2=CH- CH2-CH3
![]() + H2 CH3-CH2-CH2-CH3
+ H2 CH3-CH2-CH2-CH3
CH3- CH=CH- CH3
![]() Hidrogenarea
totala a dienelor.
Dienele se caracterizeaza prin prezenta in molecula a doua
legaturi duble.Hidrogenarea totala are loc in cataliza
eterogena:Ni, Pt, Pd, metale fin divizate, cu obtinerea alcanului.
Hidrogenarea
totala a dienelor.
Dienele se caracterizeaza prin prezenta in molecula a doua
legaturi duble.Hidrogenarea totala are loc in cataliza
eterogena:Ni, Pt, Pd, metale fin divizate, cu obtinerea alcanului.
![]() CH2=CH-CH=CH2 + 2H2 CH3-
CH2- CH2-CH3
CH2=CH-CH=CH2 + 2H2 CH3-
CH2- CH2-CH3
1,3-butadiena butan
Hidrogenarea totala a alchinelor are loc tot in cataliza eterogena cu obtinerea alcanului corespunzator. Alchinele, avand doua legaturi p, vor consuma doi moli de H2 la un mol alchina:
Pd/ Pb2+
![]()
![]()
![]()
![]()
![]() CH CH+ 2H2 CH3 CH3
CH CH+ 2H2 CH3 CH3
acetilena etan
II.2. Hidroliza carburilor metalice
Carburile metalice sunt compusi ionici in care se gaseste ionul carbura . Carbura de aluminiu (in care se gaseste ionul carbura C4-) hidrolizeaza cu obtinerea CH4 si Al(OH)3.
![]()
![]() Al4C3 +12H2O 3CH4 + 4Al(OH)3
Al4C3 +12H2O 3CH4 + 4Al(OH)3
Reactia poate avea loc si cu HCl cand se obtine AlCl3 si CH4.
Al4C3
+12HCl ![]() 3CH4 + AlCl3
3CH4 + AlCl3
Metoda are aplicatii restranse deoarece CH4 se obtine, mult mai ieftin, direct din gazul metan. Carbura de calciu, compus ionic ce contine ionul carbura C22- (- C ≡≡ C -), prin hidroliza da nastere la acetilena:
![]() CaC2 + 2H2O C2H2 +
Ca(OH)2
CaC2 + 2H2O C2H2 +
Ca(OH)2
II.3. Hidroliza compusilor organo-metalici
Compusii organo-metalici ce prin hidroliza dau nastere la alcani, fac parte din doua clase mari:
-Hidroliza
dialchilzincului conduce
![]() (CH3 CH2)2Zn + 2H2O 2CH3 - CH3
+ Zn(OH)2
(CH3 CH2)2Zn + 2H2O 2CH3 - CH3
+ Zn(OH)2
-Hidroliza derivatilor organomagnezieni (reactivi Grignard)
Reactivii Grignard se obtin in urma reactiei dintre un derivat halogenat si Mg intr-un mediu perfect anhidru, conform ecuatiei:
![]()
R - X + Mg R - MgX
Acesta hidrolizeaza foarte usor:
![]() R - MgX + H - OH R - H
+ Mg(OH)X
R - MgX + H - OH R - H
+ Mg(OH)X
Halogenura bazica de
magneziu
Ex:
![]() CH3Cl +
Mg CH3 - MgCl
CH3Cl +
Mg CH3 - MgCl
![]() CH3 - MgCl + H2O CH4 + MgOHCl
CH3 - MgCl + H2O CH4 + MgOHCl
II.4. Sinteza Würtz este o metoda aplicata in special pentru obtinerea alcanilor simetrici. Reactia de alchilare reciproca data de derivatii halogenati are loc in prezenta de Na.
![]() R-X +
2Na + X-R R-R + 2NaX
R-X +
2Na + X-R R-R + 2NaX
derivat alcan
halogenat simetric
Ex:
![]()
![]() CH3-CH-X + 2Na + X- CH-CH3 CH3-CH-CH-CH3 + 2NaX
CH3-CH-X + 2Na + X- CH-CH3 CH3-CH-CH-CH3 + 2NaX
![]()
![]()
![]()
CH3 CH3 CH3 CH3
halogenura de 2,3-dimetil butan
izopropil
II.5. Sinteza Kolbe
La electroliza unei sari de Na a unui acid monocarboxilic saturat, in final, la anod, se obtine un alcan simetric care va avea 2n-2 atomi de C in molecula( in care n este numarul de atomi de C din sarea de Na a acidului respectiv).
Schema sintezei este:
![]() Ionizarea
sarii R -
COO-Na+ R - COO-
+ Na+
Ionizarea
sarii R -
COO-Na+ R - COO-
+ Na+
![]() Reactii
primare la electrozi: A(+) R - COO- - 1e- R - COO.
Reactii
primare la electrozi: A(+) R - COO- - 1e- R - COO.
ion carboxilat radical carboxilat
![]()
![]() K(-) Na+
+ 1e- + H2O NaOH + 1/2H2
K(-) Na+
+ 1e- + H2O NaOH + 1/2H2
Reactii secundare in sistem:
![]() R - COO. R. + CO2
R - COO. R. + CO2
Reactia totala:
![]() 2R-COONa + H2O electroliza R - R +
2CO2 + NaOH + 1/2H2
2R-COONa + H2O electroliza R - R +
2CO2 + NaOH + 1/2H2
Metoda are aplicatii restranse; randamente superioare se obtin in cazul electrolizei acetatului de sodiu:
Schema sintezei este:
![]() Ionizarea sarii: CH3- COO-Na+ CH3 -
COO - + Na+
Ionizarea sarii: CH3- COO-Na+ CH3 -
COO - + Na+
![]() Reactii primare la electrozi: A(+) CH3 - COO - - 1e- CH3 - COO .
Reactii primare la electrozi: A(+) CH3 - COO - - 1e- CH3 - COO .
ion acetat radical acetal
![]()
![]() K(-) Na+ + 1e- +
H2O NaOH +
1/2H2
K(-) Na+ + 1e- +
H2O NaOH +
1/2H2
Reactii secundare in sistem:
![]() CH3 - COO . CH3 . + CO2
CH3 - COO . CH3 . + CO2
Reactia totala:
![]() 2 CH3-COONa + H2O electroliza CH3 - CH3 + 2CO2 + NaOH + 1/2H2
2 CH3-COONa + H2O electroliza CH3 - CH3 + 2CO2 + NaOH + 1/2H2
acetat de sodiu etan
II.6. Decarboxilarea acizilor monocarboxilici saturati.
Incalzirea acizilor duce la eliminarea unei molecule de CO2 provenind din gruparea carboxil. Incalzirea acizilor monocarboxilici saturati conduce la formarea alcanului (cu n-1 atomi C) si eliminarea unei molecule de CO2 (R. are loc cu micsorarea catenei si scaderea nr. de.atomi de C din molecula).
Acizii monocarboxilici saturati sunt stabili la incalzire pana ]n jurul valorii de 200oC.
Prezinta importanta practica decarboxilarea acidului acetic. Pentru decarboxilarea acestuia se utilizeaza calcinarea acetatului de sodiu cu soda caustica la temperatura ridicata.
![]()
![]()
CH3-COOH + NaOH -H2O CH3-COO-Na+ +NaOH(200 sC) CH4
+ Na2CO3
Metoda nu se aplica numai acizilor saturati, ci tuturor acizilor fiind o metoda de obtinere a diferitelor clase de hidrocarburi. Numai in cazul acidului acetic decarboxilarea se produce la temperaturi relativ ridicate.
4.2. Starea naturala
Metodele de obtinere prezentate au aplicatii restranse deoarece alcanii se gasesc in natura sub forma de:
gaz de sonda -cu alcani in fractiunile C1 - C4 ,in zacaminte ce insotesc petrolul.
Petrolul: zacamant natural format din hidrocarburi solide si gazoase dizolvate in hidrocarburi lichide.
5. Proprietati fizice
5.1. Elementele de structura care determina proprietatile fizice
Proprietatile fizice ale n-alcanilor si ale izoalcanilor sunt determinate de structura moleculelor lor. Legaturile simple C - C sunt legaturi covalente nepolare, iar legaturile C - H din alcani sunt legaturi covalente foarte slab polare, fiind practic nepolare. Prin urmare, moleculele hidrocarburilor saturate sunt molecule nepolare.
Intre moleculele nepolare, cum sunt moleculele alcanilor, se manifesta interactiuni de dispersie, de tip forte van der Waals. In stare solida, substantele cu molecule nepolare formeaza retele moleculare. Punctele de topire ale substantelor cu retele moleculare sunt mici si cresc cu cresterea maselor moleculare si cu micsorarea distantelor dintre molecule. Substantele cu molecule nepolare sunt solubile in solventi cu molecule nepolare.
Asadar, intre moleculele nepolare ale alcanilor se exercita interactiuni slabe de dispersie de tip van der Waals si in stare solida alcanii formeaza retele moleculare.
Existenta fortelor intermoleculare slabe determina puncte de topire si de fierbere scazute la alcani care cresc odata cu cresterea masei moleculare.
Pt si pf ale unor n alcani
|
n-alcan |
p.t. ( |
p.f. ( |
|
CH4 | ||
|
C2H6 | ||
|
C3H8 | ||
|
C4H10 | ||
|
C5H12 | ||
|
C6H14 | ||
|
C7H16 | ||
|
C8H18 | ||
|
C9H20 |
| |
|
C10H22 | ||
|
C15H32 | ||
|
C20H42 |
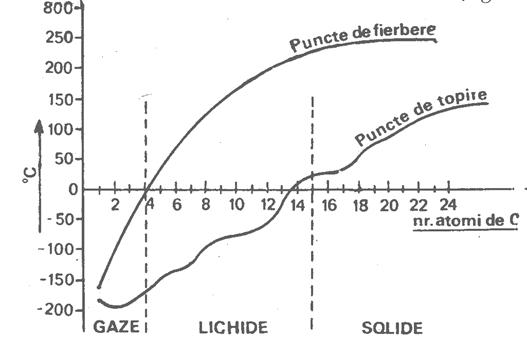
La temperaturi si presiuni obisnuite, primii patru termeni ai seriei n-alcanilor (C1 - C4) sunt gazosi, termenii medii (C5-C17) sunt lichizi, iar cei superiori (peste C17) sunt solizi.
In seria omologa a n-alcanilor, punctele de topire cresc cu 20-300 pentru fiecare atom de carbon in plus deci punctele de fierbere si topire cresc odata cu cresterea masei moleculare..
Cresterea punctelor de topire cu cresterea numarului de atomi de carbon din molecula este mai putin uniforma decat cresterea punctelor de fierbere.
Ramificarea catenei micsoreaza punctul de fierbere al compusilor respectivi (vezi tabelul de mai jos) pentru ca ,odata cu izomerizarea ,distantele dintre molecule cresc si scazand taria fortelor de atractie de tip van der Waals.
|
FM |
Formula plana |
Denumire |
Tipul catenei |
Punct de fierbere ( |
|
C4H10 |
CH3-CH2-CH2 -CH3 |
butan |
aciclica liniara | |
|
CH3 |
izobutan |
aciclica ramificata | ||
|
C5H12
|
CH3-CH2-CH2 -CH2- CH3 |
n-pentan |
aciclica liniara | |
|
CH3-CH - CH2-CH3
|
izopentan |
aciclica ramificata | ||
|
CH3 |
neopentan |
aciclica ramificata |
![]()
Se observa:
p.f . n-butan > p.f izobutan, respectiv
|
C5H12 |
n |
izo |
neo |
|
Cresterea gradului de ramificare a catenei |
|
creste | |
|
p.f. ( | |||
|
Variatie p.f. |
|
scade |
p.f . n-pentan > p.f izopentan >p.f neopentan ,
scaderea p.f. fiind o consecinta si a cresterii ramificarii catenei.
La izoalcanii cu acelasi numar de atomi de carbon, scaderea punctului de fierbere este mai accentuata in urmatoarele situatii:
|
Formula moleculara |
Formula plana |
Denumirea |
Punct de
fierbere ( |
|
|
C6H14 |
a |
CH3- CH2-CH2 -CH2-CH2 -CH3 |
n-hexan | |
|
b |
CH3 |
2-metilpentan | ||
|
c |
CH3 |
3-metilpentan | ||
|
d |
CH3 CH3 |
| ||
|
e |
CH3 |
2,2-dimetilbutan |
Se observa ca
p.f.b < p.f.c - ramificarea la b este mai marginala decat la c.
p.f.e < p.f.d - ramificarea la e este mai accentuata decat la d, cele doua catene laterale fiind
legate de acelasi atom de carbon al catenei principale( la e) si nu de doi atomi
de carbon diferiti ( la d).
![]()
Solubilitatea
n-alcanii ca si izoalcanii sunt insolubili in apa, dar sunt solubili in compusi organici cu care pot forma intermolecular legaturi van der Waals (alte hidrocarburi, eteri, alcooli etc.). Alcanii lichizi sunt buni solventi pentru unele substante organice, ca de exemplu, grasimile.
Proprietati organoleptice
Alcanii inferiori nu au miros.Cei superiori au un miros caracteristic Pentru depistarea scaparilor de gaze din conducta de gaz metan sau din buteliile de aragaz (gaz metan) se adauga substante urat mirositoare (compusi organici cu sulf numiti mercaptani) al caror miros poate fi usor sesizat.
6. Proprietati chimice
Mult timp alcanii au fost denumiti parafine (para - fara; affinis - reactivitate, parafine-fara reactivitate chimica). Explicatia acestui fapt se regaseste in structura alcanilor. Acestia sunt formati din atomi de C si H uniti prin legaturi covalente simple , nepolare(C si H avand electronegativitati foarte apropiate). Legaturile C - C si C - H sunt nepolare ceea ce confera structurii alcanilor caracter de molecula nepolara.
Exista insa ,o serie de reactii chimice pe care le dau alcanii ( dar nu cu reactanti polari), reactii in decursul carora au loc :
ruperi de legaturi C - H: reactii de dehidrogenare, oxidare, substitutii,
ruperi de legaturi C - C: reactii de izomerizare, oxidarea distructiva a alcanilor superiori, arderi.
Principalele reactii pe care le dau alcanii sunt:
a.Reactie de halogenare
b.Reactie de nitrare
6.1. Reactia de substitutie
La modul general, reactia de substitutie se defineste ca fiind o reactie in care are loc inlocuirea unuia sau mai multor atomi din molecula substratului cu atomi sau grupuri de atomi din molecula reactantului. O reactie de substitutie se reprezinta
![]() A - B + X - Y A - X + B - Y
A - B + X - Y A - X + B - Y
substrat reactant produsi de reactie
principal secundar
Substitutia la alcani consta in inlocuirea unuia sau mai multor atomi de H din molecula alcanului cu atomi sau grupuri de atomi din molecula reactantului.
Schematic, reactia de substitutie la alcani se reprezinta:
![]()
![]() R - H
+ X - Y R - X + H - Y produs secundar
R - H
+ X - Y R - X + H - Y produs secundar
![]() alcan
alcan
produs principal
a. Reactia de halogenare
Reactia de halogenare se defineste ca fiind reactia de introducere a unuia sau mai multor atomi de (halogen) in molecula unui compus organic.
Fluorurarea nu se face direct din cauza caracterului puternic oxidant al fluorului. Contactul dintre un alcan si fluor molecular decurge cu explozie.
![]() CnH2n+2 +
(n+1)F2 nC
+ (2n+2)HF
CnH2n+2 +
(n+1)F2 nC
+ (2n+2)HF
Introducerea fluorului se face prin metode indirecte. Se utilizeaza un derivat halogenat si o fluorura solubila. Are loc schimbul interhalogenat cu obtinerea derivatului halogenat respectiv; astfel fluorura de etil se obtine in urma reactiei dintre fluorura de mercur (fluorura mercurica) si clorura de etil
![]() 2CH3-CH2-Cl +
HgF2 2CH3-CH2-F + HgCl2
2CH3-CH2-Cl +
HgF2 2CH3-CH2-F + HgCl2
Clorurarea
si bromurarea se face relativ usor, la lumina (hυ) sau la
temperatura de 300-
Clorurarea CH4 prezinta
importanta practica prin aplicatiile largi pe care le au
produsii de clorurare. Reactia de clorurare a CH4 decurge,
la lumina (h ) sau la temperatura de 300-
![]() CH4 + Cl2 hυ CH3Cl+HCl
CH4 + Cl2 hυ CH3Cl+HCl
clorura de metil (clorometan; monoclorometan)
![]() CH3Cl + Cl2 hυ CH2Cl2+HCl
CH3Cl + Cl2 hυ CH2Cl2+HCl
clorura de metilen (diclorometan)
![]() CH2Cl2 + Cl2 hυ CHCl3+HCl
CH2Cl2 + Cl2 hυ CHCl3+HCl
clorura de metin (cloroform; triclorometan)
![]() CHCl3 + Cl2 hυ CCl4+HCl
CHCl3 + Cl2 hυ CCl4+HCl
tetraclorura (tetraclorometan)
de carbon
b. Reactia de nitrare
Reactia de nitrare poate avea loc:
in sistem omogen lichid ,cand au loc izomerizari,
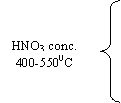
in faza
gazoasa, la 400-
o Nitrarea in faza lichida.
Nitrarea C3H8 in sistem omogen lichid conduce la obtinerea unui amestec de 1-nitropropan si 2-nitropropan (de aceea despre reactia de nitrare se spune ca este neselectiva ; ar fi fost selectiva daca s-ar fi obtinut doar unul din cei doi izomeri posibili). Cele doua tipuri de atomi de C din catena propanului nu prezinta aceeasi reactivitate in reactia de nitrare; se obtine mai mult 2-nitropropan .
![]() 2CH3-CH2-CH3 +
2HONO2 CH3-CH2-CH2-NO2+CH3-CH(NO2)CH3+2H2O
2CH3-CH2-CH3 +
2HONO2 CH3-CH2-CH2-NO2+CH3-CH(NO2)CH3+2H2O
1-nitropropan 2-nitropropan
o Nitrarea in faza gazoasa.
Nitrarea alcanilor, in faza
gazoasa, la 400-
 CH3-CH2-CH2-NO2
1-nitropropan
CH3-CH2-CH2-NO2
1-nitropropan
CH3-CH-CH3 2-nitropropan
![]()
![]() CH3-CH2-CH3 NO2
CH3-CH2-CH3 NO2
CH3-NO2 nitrometan
-H2O CH3-CH2-NO2 nitroetan
o Nitrare indirecta
Reactia de nitrare nefiind orientata ( este neselectiva), pentru obtinerea unui anumit izomer se utilizeaza reactia de nitrare indirecta. fie cu NaNO2, fie cu AgNO2 Se lucreaza avand ca substrat derivatul halogenat corespunzator iar ca reactant fie NaNO2, fie AgNO2.
NaX AgNO2 NaNO2
AgX
![]()
![]()
![]() R-X + R-NO2+
R-X + R-NO2+
Ex:
pentru obtinerea numai a 1-nitropropan se supune nitrarii indirecte clorura de izopropil cu
NaNO2 sau cu AgNO2
- NaCl
![]() CH3-CH-CH3 +
NaNO2 CH3-CH-CH3
CH3-CH-CH3 +
NaNO2 CH3-CH-CH3
![]()
![]()
Cl NO2
clorura de izopropil 2-nitropropan
Reactia de nitrare a alcanilor nu prezinta un interes deosebit din punct de vedere practic.
Reactia de izomerizare
Reactia de izomerizare este o reactie specifica alcanilor constand in transformarea unui n-alcan
in unul din izomerii sai de
catena.Reactia a fost descoperita de C.D. Nenitescu in 1930 pe
sistemul n-hexan cu obtinere de 2-metil pentan. Izomerizarea butanului este o reactie
reversibila avand loc la temperaturi de 50-
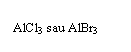
anhidru
![]() CH3 80% izobutan
CH3 80% izobutan
Izomerizarea alcanilor are o importanta practica deosebita, respectiv in industria petroliera in obtinerea benzinelor cu cifra octanica ridicata. Cifra octanica este o caracteristica a oricarei benzine, reprezentand capacitatea unui amestec de vapori de benzina de a rezista la comprimari fara detonatii intr-un motor cu ardere interna. Cifra octanica exprima procentele in volum de izooctan din amestecul n-hectan ce are aceeasi comportare ca si benzina studiata intr-un motor cu ardere interna standard. Conventional, se aloca n-heptanului cifra octanica 0, iar izooctanului (2,2,4-trimetil pentan) cifra octanica 100. O benzina cu cifra octanica 98 va fi o benzina cu98% (in procente de volum) izoctan. Reactia de izomerizare a alcanilor este utilizata pentru ca s-a observat ca alcanii cu ramificare ard mai bine intr-un motor cu ardere interna decat cei neramificati.
6.3. Reactia de oxidare
Reactia de oxidare in chimia organica are acelasi inteles ca si in chimia anorganica, respectiv este o reactie cu schimbarea N.O. (cu cedare de e-). Numarul si aplicatiile reactiei de oxidare in chimia organica sunt mult mai mari. In principal, exista doua tipuri de reactii de oxidare:
1). Arderi care sunt oxidari totale cu obtinerea oxizilor elementelor organogene, compusi ale moleculelor. Toate substantele organice ard cu obtinerea CO2, H2O si alti oxizi.
2). Arderi partiale sau simple oxidari. Acestea pot avea loc:
o cu O2 din aer la temperaturi ridicate in prezenta catalizatorilor specifici de oxidare;
o cu [O] furnizat de un sistem oxidant.
Oxidarile: - pot avea loc cu ruperea sau cu conservarea catenei;
- pot fi blande sau energice.
Alcanii ard si se pot oxida doar cu O2 din aer, sunt stabili la oxidarea cu [O].
Arderea alcanilor are loc cu formare de CO2, H2O reactia fiind puternic exoterma, fapt ce explica utilizarea acestora drept combustibili. Ecuatia generala este:
![]()
![]() CnH2n+2+ O2 nCO2+(n+1)H2O+Q
CnH2n+2+ O2 nCO2+(n+1)H2O+Q
![]() In cazul CH4 avem: CH4+ 2 O2 CO2+2H2O+Q
In cazul CH4 avem: CH4+ 2 O2 CO2+2H2O+Q
![]() In cazul C4H10
avem: C4H10+13/2O2 4CO2+5H2O+Q
In cazul C4H10
avem: C4H10+13/2O2 4CO2+5H2O+Q
CH4, C3H8 si C4H10 sunt combustibili furnizati populatiei, CH4 prin conducte, C3H8 si C4H10 prin lichefiere in butelii. CH4 (dar si alti alcani) formeaza cu aerul un amestec ce in cazul unei compozitii volumetrice de 5-15% se autoaprinde cu explozie, fapt ce explica grija pentru evitarea scaparilor de gaz metan in atmosfera. Oxidarea alcanilor se face numai cu oxigen din aer in conditii catalitice. Obtinerea produsilor de oxidare ce reprezinta materii prime importante in industria chinica organica de sinteza determina cresterea valorii unui metru cub de CH4 in raport cu consumuri de peste 30 de ori. Totalitatea proceselor care duc la transformarea unei substante in compus cu importanta industriala poarta denumirea de chimizare.
Metanul prezinta mai multe cai de chimizare, dar una din cele mai importante este chimizarea prin oxidare.
![]() CH4 + O2 CH2=O + H2O
CH4 + O2 CH2=O + H2O
Aldehida formica constituie materia prima in industria medicamentelor dar si a masei plastice la obtinerea rasinilor fenolformaldehidice.
![]() CH4 + 1/2O2 CH3-OH
CH4 + 1/2O2 CH3-OH
Alcoolul etilic este considerat ca un combustibil al viitorului fiind folosit si ca solvent la obtinerea formaldehidei. Este toxic pentru organismul uman; doza letala este de 0,15 g/Kg corp.
a). Oxidarea partiala a metanului:
![]() CH4 + 1/2O2 CO + 2H2
CH4 + 1/2O2 CO + 2H2
b). Conversia partiala a CH4. Reactia are loc pe catalizator de Ni la 650-9000C:
![]() CH4+H2O (vap.) CO+3H2
CH4+H2O (vap.) CO+3H2
c). Conversia totala a metanului cu vapori de apa conduce la amestecul de CO2 si H2 care poate fi considerata ca sursa de H2 (prin trecerea amestecului prin lapte de var si retinerea CO2-ului sub forma de CaCO3).
![]() CH4 + H2O (vap.) CO + 3H2
CH4 + H2O (vap.) CO + 3H2
![]() CO + H20 (vap.) CO2
+ H2
CO + H20 (vap.) CO2
+ H2
![]() CH4 + 2H2O CO2
+ 4H2
CH4 + 2H2O CO2
+ 4H2
Gazul de sinteza are multiple aplicatii, fiind utilizaT, spre exemplu, la obtinerea metanolului.
Reactia de
obtinere a metanolului are loc la 300-
![]() CO+2H2 CH3-OH
CO+2H2 CH3-OH
![]() CH4 + O2 C + 2H2O
CH4 + O2 C + 2H2O
Reactia nu este convenabila din punct de vedere practic si de aceea pentru obtinerea negrului de fum se utilizeaza reziduuri petroliere. Carbonul este utilizat in industria cauciucului dar si pentru obtinerea tusurilor.
![]() CH4 + (2O2 + 8N2) CO2
+ 2H2O + 8N2
CH4 + (2O2 + 8N2) CO2
+ 2H2O + 8N2
H2 obtinut fie din gazul de sinteza fie prin dubla conversie a metanului impreuna cu N2 astfel obtinut constituie materii prime in sinteza NH3.
![]() CH4 + 3/2O2 + NH3 HCN + 3H2O
CH4 + 3/2O2 + NH3 HCN + 3H2O
In acelati mod are loc reactia de amonoxidare a propenei cu obtinerea acrinonitrilului care este un monomer in industria firelor si fibrelor sintetice, fiind utilizat la obtinerea firelor PNA (fire de tip melana).
![]() CH2=CH-CH3 + 3/2O2 + NH3 CH2=CH-CN + 3H2O
CH2=CH-CH3 + 3/2O2 + NH3 CH2=CH-CN + 3H2O
![]() 2CH4 CH≡CH+3H2
2CH4 CH≡CH+3H2
Descompunerea termica a alcanilor
Alcanii fiind inerti chimic, sunt stabili
pana la 300-
![]() 2CH4 CH≡CH + 3H2
2CH4 CH≡CH + 3H2
Caldura necesara poate fi furnizata:
a). Arderea incompleta a unei cantitati de metan
b). Descarcarea intre doi electrozi (arc electric)
![]() CH3-CH3 CH2=CH2+H2
CH3-CH3 CH2=CH2+H2
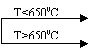
CH3-CH2-CH3 CH4 + CH2=CH2
CH2=CH-CH3 + H2
o La butan numarul produsilor de cracare, respectiv de hidrogenare este mai mare datorita diversitatii mai mari a naturii atomilor de C din natura.
Prin cracare la temp. mai mari de
![]()
 CH4
+ CH2=CH-CH3
CH4
+ CH2=CH-CH3
CH3-CH2-CH2-CH3 CH3-CH3 + CH2=CH2
![]() CH2=CH-CH2-CH3
+ H2
CH2=CH-CH2-CH3
+ H2
CH3-CH=CH-CH3 + H2
Odata cu cresterea numarului atomilor de C din catena alcanului numarul produsilor de cracare este mai mare. In industrie nu se supun procesului de descompunere termica alcani in stare pura, ci amestecuri cum sunt pacura si motorina. Se obtine o fractie gazoasa ce contine alcani si alchene inferioare si o fractiune lichida; rezulta benzina de piroliza - cracare, iar in cazul pacurei se obtine un reziduu solid numit casa de petrol.
Schema chimizarii CH4 este
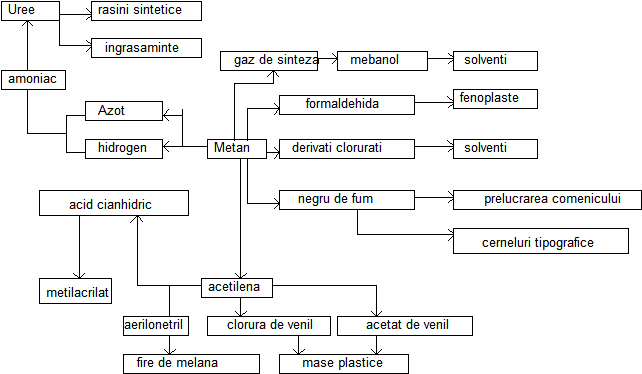
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |