
Anumite elemente chimice, in special fierul si titanul, pot forma mai multe combinatii cu anionii in functie de valenta lor. Daca exista o diferenta a solubilitatii raportata la diferitele valente, atunci potentialul redox[1] (Eh-ul) poate afecta mobilitatea elementului respectiv.
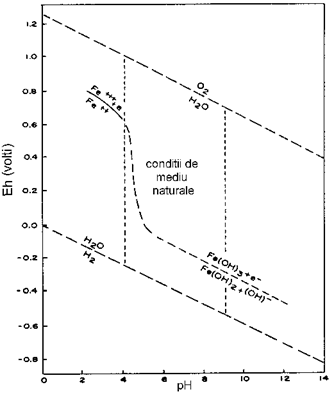
Conform Fig.2., precipitarea hidroxidului feric are loc la un pH=3, iar in conditii normale de alterare chimica acesta este retinut de mediu. Pe de alta parte, hidroxidul feros necesita o valoare mult mai mare a pH-ului pentru a precipita. Ca o consecinta, acolo unde conditiile de mediu au un caracter predominant reducator, majoritatea fierului va fi levigat (indepartat) din zona de alterare, in timp ce in conditii oxidante, fierul se va stabiliza.
Experientele vizand o serie de reactii privind comportamentul fierului au aratat ca potentialul redox descreste odata cu cresterea pH-ului (Fig.4.), iar astfel oxidarea fierului are loc mult mai usor in medii alcaline. Ca regula generala, reactiile de oxidare ale unui compus au loc intotdeauna concomitent cu reducerea altuia si punerea in libertate de electroni sau, cu alte cuvinte, potentialul redox (gradul de oxidare) este o valoare care caracterizeaza energia de oxidare, respectiv tendinta unui sistem de a pune in libertate electroni. Astfel, in functie de Eh, elementele chimice pot apare cu diferite valente (grade de oxidare).
Transportul Fe2+ in medii apoase, sub forma ionica, este impiedicat de prezenta oxigenului dizolvat, care oxideaza Fe2+ la Fe3+ determinand formarea de oxizi de fier, conform reactiei:
2Fe2+(aq) + 4(HCO3)- + 0,5O2 Fe2O3 + 4CO2 + 2H2O
Reactiile chimice ce au loc in medii apoase sunt limitate, teoretic, la cele la care Eh-ul este cuprins intre 0,00 - 1,23 volt (pH=0). La un pH intre 4 si 9, valorile limita pentru reactiile de oxidare ce au loc in prezenta apei sunt cuprinse intre -0,53 si +0,99 volt.
In concluzie, potentialul unui sistem redox depinde de raportul concentratiei dintre forma oxidata si cea redusa. Valorile potentialului redox sunt pozitive cand forma oxidata este in cantitate mai mare decat cea redusa si sunt negative in caz contrar. In mod conventional, valorile pozitive indica un regim oxidant, pe cand cele negative unul reducator.
Principalii factori ce controleaza potentialul redox in medii supuse proceselor de dezagregare-alterare sunt:
(a) accesul liber al oxigenului atmosferic;
(b) prezenta sau absenta materiei organice.
Oxidarea este o reactie exoterma ce tinde sa se produca spontan deasupra zonei saturate in apa (nivelul hidrostatic). Sub acest nivel predomina reactiile de reducere. Cu toate acestea, materia organica, care prin excelenta se oxideaza la CO2 este un agent reducator deosebit de puternic, iar acolo unde se gaseste din abundenta poate crea un mediu reducator, chiar si deasupra nivelului hidrostatic. Aceasta sugereaza ca Eh-ul este dependent de clima si de relief. Un mediu cald, cu precipitatii abundente si bine drenat, favorizeaza oxidarea prin distrugerea rapida a materiei organice si adancirea nivelului hidrostatic, in timp ce mediile reci, cu precipitatii reduse si slab drenate sunt propice acumularii de materie organica si implicit imprimarea unui caracter reducator.
Titanul este un alt element chimic comun rocilor si care poate exista in doua sau mai multe trepte de valenta (stari de oxidare). Cu toate acestea, comportamentul titanului nu este influentat de Eh, ci doar de pH. Astfel, ca dioxid (TiO2) precipita la un pH peste 2,5 (Fig.2.) devenind un compus stabil in aproape toate mediile. Pe de alta parte, Ti(OH)4 nu precipita pana cand nu e atins un pH de 5. Ca urmare, daca titanul este pus in libertate din rocile primare (ex. bazalte cu augit titanifer, magnetit etc.) sub forma de Ti(OH)4, iar pH-ul mediului este cuprins intre 4 si 5, sunt indeplinite conditiile ca prin deshidratare sa rezulte una din formele polimorfe ale TiO2. Daca insa, titanul e prezent in rocile primare sub forma de anatas sau rutil, el nu va fi afectat de procesele de alterare si va ramane stabil.
Potential redox (Eh) = potentialul unei reactii chimice in care unul dintre reactanti este redus (primeste unul sau mai multi electroni), iar celalalt este oxidat (pierde unul sau mai multi electroni). Potentialul redox se exprima in volti. Cu cat aceasta valoare este mai mare, cu atat caracterul oxidant este mai mare, iar cu cat este mai mica, caracterul reducator este mai accentuat.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |