Studiul fenomenelor electrochimice care au loc intr-o celula potentiometrica formata dintr-o solutie de electrolit care contine analitul care participa la o reactie redox la echilibru.
Celula potentiometrica - solutie analit
- electrod indicator, i
electrod de referinta, r
Tensiunea electromotoare, E: , reprezinta diferenta de potential intre cei doi electrozi masurata in
Data nasterii: Iunie 25, 1864

Echilibru:
Ox + ze Red
= + (RT/nF) ln (aox / aRed )
e potentialul unui electrod
e potentialul standard, cand aOx = aRed
R- constanta gazelor, 8.314 J /mol K
T- temperatura absoluta, 2750 K (temperatura standard =250C, 298° K)
z- numar de electroni
F-constanta lui Fraday, 96485 C (96500)A s/mol
a = f c , ![]()
f = + (b/n) log (fOx /fRed)
f - potentialul formal, la I constant
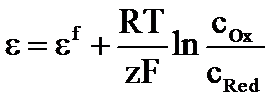
2,303 (RT/F)= 0,0592 V, la 25C (298,15K) -temperatura standard
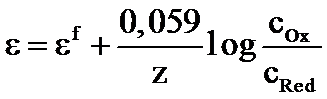
NOU!! pE = -log[e-] la fel ca si pH = - log [H+] pX=-log[X]
Tipuri de electozi
Electrozi redox
Electrozi metal-ion
Electrozi cu membrana
Electrozi enzimatici
Electrozi chimic modificati
Electrozi redox Ce sunt electrozii redox ?
Functia de etalonare
f + (0,059/n) log (cOx /cRed)
Exemplu - electrodul de platina
(inel) 
Aplicatii analitice
- directe
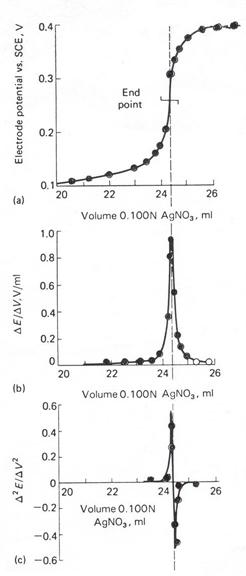
- indirecte - titrarea potentiometrica redox
Exemplu Determinarea Fe2+ prin titrare potentiometrica redox
Electrozi metal-ion
-speta I (ordinul I)
-speta a IIa (ordinul II)
-speta a IIIa (ordinul III)
Electrozi de referinta
Electrozi metal-ion de tipul I Ce sunt electrozii metal-ion de tipul I? M | Mz+
Functia de etalonare
![]()
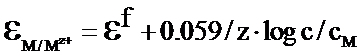
log CM =1
![]()
Aplicatii analitice
- directe Ag/Ag+
- indirecte - titrarea potentiometrica
Electrozi metal-ion de tipul II Ce sunt electrozii metal-ion de tipul II? M;MX X
Ag;AgCl | Cl Hg;Hg2Cl2 | Cl
Functia de etalonare
Ag;AgCl | Cl
![]()
PAgCl = [cAg+] [cCl
![]()
Electrozii de tipul II ca electrozi indicatori
Aplicatii analitice
- directe, electrozi indicatori pentru anionii Br-, Cl-, I-, S2-. Selectivitate redusa !!
- indirecte - titrarea potentiometrica cu AgNO3-determinarea anionilor Br-, Cl-, I-, S2-
Selectivitate imbunatatita !!
Electrozii de tipul II ca electrozi de referinta
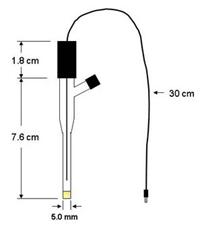
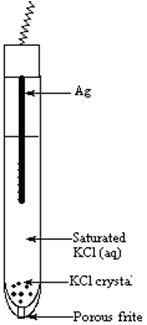
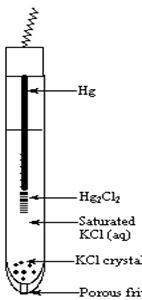
Ag;AgCl | Cl Hg;Hg2Cl2 | Cl
Aplicatii analitice
Electrozi de referinta
-Ag;AgCl | Cl
-Electrodul de calomel Hg;Hg2Cl2 | Cl
Hg2Cl2(s) + 2e 2Hg(l) + 2Cl- ( )
V la 25C.
Electrodul de calomel nu poate fi utilizat la temperaturi mari
Reactia de disproprtionare:
Hg2Cl2 Hg + HgCl2 ( )
Potentialul de jonctiune
ej
In zona de contact dintre solutia interna a electrodului de referinta si solutia externa (de proba in care este inserat) apare o diferenta de potential s potential de jonctiune, ejo. Aparitia acesteia se datoreaza diferentei de compozitie ionica intre cele doua solutii. La interfata celor 2 solutii au loc procese de difuziune ale ionilor. Viteza de difuziune a fiecarui ion este functie de mobilitatea ionului respective. Datorita mobilitatii diferite ale ionilor in zona interfetei ( a contactului dintre cele doua solutii) se formeaza un strat dublu electrochimic, in care distributia inegala a sarcinilor pozitive si negative ale ionilor provoaca aparitia lui ej
Ca urmare a tensiunii electromotoare a unei celule electrochimice cu electrod de referinta cu dop poros (si punte de sare) este.
![]()
Precizia si exactitatea masuratorilor potentiometrice este data in masura de existenta si marimea lui ej
Existenta lui ej face posibila clarificarea celulelor electrochimice in 2:
1. se mai cheama si celule fara transport sau fara difuzie. Realizarea unei celule electrochimice fara jonctiune se realizeaza atunci cand se cer masuratori foarte precise si exacte ale tensiunii electromotoare. Acest lucru se realizeaza folosind electrodul normal de hidrogen sau electrodul standard de hidrogen (ESH) chiar in solutia probei.
Electrodul de hidrogen standard - IUPAC - prin conventie internationala a fost exceptat ca electrod de referinta standard (SHE). Electrodul consta dintr-un fir de platina, acoperit negru de platina, in contact cu un curent de hidrogen gazos (H2). La introducerea acestui electrod intr-o solutie electrodul se comporta ca un electrod reversibil in raport cu ionii de H+:
Ecuatia care are loc in electrod:
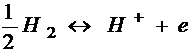
Relatia de echivalenta intre H+ din solutie si hidrogenul molecular dizolvat, prin intermediul electronilor din metalul nobil (platina).
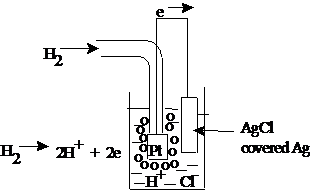
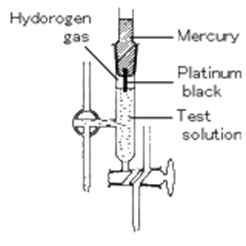
Reprezentarea shematica:
![]()
Pt ; H2 H+
La echivalenta potentialul acestui electrod este:
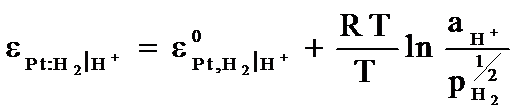
![]()
sau
la 250C:
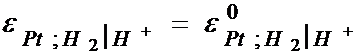
la 250C (temperatura standard) pentru o presiune partiala a hidrogenului constanta si egala cu 1 atmosfera (presiune standard) si activitatea ionilor a H+ = 1, potentialul de echilibru al electrodului de hidrogen este egal cu potentialul sau standard.
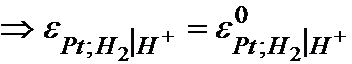
IUPAC prin conventie, a considerat ca in conditiile etalon (PH2 = 1 atmosfera, aH+ = 1, t = 250C) potentialul electrodului de platina este zero.
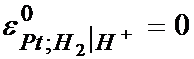
Deci:
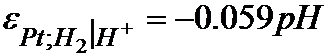
si arata ca potentialul ESH devine tot mai negativ cand pH-ul solutiei creste si invers. Aceasta dependenta este valabila pe intreaga scala de pH (0 - 14), in conditii de perfecta reproductibilitate.
ESH se reprezinta intotdeauna in partea stanga a unei celule.
O celula electrochimica se poate reprezenta schematic prin desemnarea electrodului indicator in partea stanga si a celui de referinta in partea dreapta. Exceptie face ESH.
Exemplu: o celula electrochimica pentru cazul unui electrod de speta I (M/Mz+)si un (electrod indicator) electrod de referinta ESH:
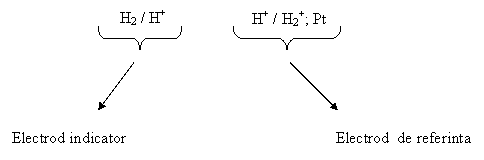 Pentru:
Pentru:
unde aH+ = 1; pH2 = 1 atom
Aceste celule electrochimice sunt dificil de realizat.
2. Puntea de sare a electrodului de referinta se reprezinta schematic
ej nu este un potential la echivalenta, deoarece procesul de difuzie este continuu, el tinand sa anuleze gradientul de concentratie referitor la fiecare ion prezent in sistem.
ej poate avea valori foarte mari de cateva zeci de mV si poate introduce serioase erori in analiza. El nu poate fi indepartat sau calculate cu precizie. De aceea este de dorit ca valoarea lui sa fie cat mai mica. Cele mai mici valori ale lui ej s-au obtinut cand jonctiunea lichida s-a asigurat cu o solutie de KCl. Acest lucru se explica prin aceea ca ionii KCl au mobilitatii asemanatoare si deci ei difuzeaza in mod practic egal.
Henderson a reusit sa calculeze ej, cu aproximatie; plecand de la ecuatia lui Nernst, a stabilit relatia dintre ej, active ionilor si cele doua solutii (interna si externa) si nr. De transport al ionilor (pentru un electrod monovalent).
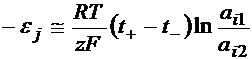

ai1 si a12 sunt activitatile unui anumit ion de o parte si de alta a zonei de contact.
Din relatia de mai sus se observa ca pentru a micsora cat mai mult pe ej, trebuie ca ai1 = a12 iar t+ si t- sa aiba valori cat mai apropiate . De exemplu:
Pentru KCl: tK+ = 0.48 iar tCl- = 0.51, conditia de mai sus este indeplinita.
In reprezentarea schematica a unei celule electrochimice cu jonctiune lichida, jonctiune se reprezinta || (linie dubla verticala). In determinarile din laborator cele mai multe determinari se realizeaza cu celule de acest tip. Se pot reprezenta astfel
Exista cazuri in care se cere in mod expres ca proba sa nu fie impurificata cu anionii Cl- (acestia ar putea interfera in determinare) iar se utilizeaza in loc de KCl, KNO3 si se realizeaza o punte dubla (jonctiune dubla). In laborator exista acest tip de electrod la determinarea I- si la titrarea de precipitare (Cl- si I-).
 Electrozi de referinta cu jonctiune dubla
Electrozi de referinta cu jonctiune dubla
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |