
Masuratori
experimentale de determinare a echilibrului la demineralizarea batch a unor
solutii cu Cl-![]()
Avand in vedere metoda descrisa privind determinarea echilibrului de schimb ionic prin metoda batch, in cele date mai jos se prezinta particularizarea acesteia la determinarea practica a relatiilor de echilibru corespunzand cazului in care apa cu continut de clorura de sodiu, clorura de calciu, clorura de nichel si clorura de aluminiu este prelucrata prin adaus succesiv de cantitati egale de cationit Purolite PPC100H si anionit Purolite PPA4000 (vezi paragraful 1.6.2). Rasinile mentionate lucreaza ca rasini de tip gel si au in stare gonflata diametrul mediu de 0.9 mm.Se precizeaza ca contactarea batch este de interes cand capacitatea schimbatorului e destul de mare pentru a se obtine o sorbtie cat mai completa intr-o singura treapta. Nivelul la care se produce schimbul e limitat de preferinta schimbatorului manifestata fata de ionii din solutie. Deoarece regenerarea batch a rasinii e chimic ineficienta, procedeul batch pentru schimb ionic are totusi utilizari limitate in aplicatii.
Scopul investigarii experimentale si solutia aleasa. Asa cum s-a precizat anterior unele aplicatii ale schimbului ionic pot fi deci obtinute prin contactarea schimbatorului de ioni cu un fluid ce contine specia/ speciile ionice ce trebuie retinute, in echipamente de tip batch. Aceste metode sunt bine adaptate la utilizarea in laborator putand fi aplicate intr-o gama larga de situatii. Tratamentele batch sunt adoptate cand capacitatea schimbatorului e destul de mare pentru a se obtine o sorbtie cat mai completa intr-o singura treapta. Nivelul la care se produce schimbul e limitat de preferinta schimbatorului manifestata fata de ionii din solutie. Deoarece regenerarea batch a rasinii e chimic ineficienta, procedeul batch pentru schimb ionic are totusi utilizari limitate in aplicatii.
Obiectivul investigatiei experimentale in acest caz a fost caracterizarea echilibrului de schimb ionic in sistemul format din amestecul cationit Purolite PPC100H - anionit Purolite PPA4000 - solutii diluate de NaCl, CaCl2, NiCl2 si respectiv AlCl3. In toate cazurile concentratie a ionilor Cl- in solutiile de lucru a fost de 0.3 g/l.
Prezentarea instalatiei experimentale. In acest scop s-a conceput si realizat instalatia experimentala prezentata in figura 1.19. Instalatia pilot de laborator consta dintr-un contactor in care solutia supusa procesului de demineralizare este agitata la o intensitate care sa permita suspendarea shimbatorilor de ioni. Inncalzirea solutiei este asigurata de o plita electrica termostatata. Amestecarea solutiei si schimbatorilor de ioni, in contactor este asigurata de un agitator magnetic. Procedeul consta in adaugarea simultana la anumite intervale de timp determinate de atingerea echilibrului a unor cantitati egale (1g) de cationit puternic acid Purolite PPC100H si respectiv anionit puternic bazic Purolite PPA 400 urmata de inregistrarea variatiei fortei electromotoare data se sistemul electrod de clor (model 96-6179B Fischer Scientific)- un electrod de referinta ( model 90-0019 Fischer Scientific) ca erxprimarea a starii concentratiei ionilor Cl- in solutia de lucru. Dupa cum rezulta din figura 1.19 instalatia experimentala este cuplata, printr-un sistem de achizitie date, la un calculator ce inregistreaza si afiseaza grafic dinamica concentratiei ionului Cl- din solutie si starea temperaturii amestecului solutie-schimbatori.


Figura 1.19 Instalatie experimentale pentru determinarea echilibrului de schimb ionic la demineralizarea apei prin contactare batch
Mod de lucru. Solutia de lucru al, carei volum se masoara, este adusa in
contactor si incalzita pana la temperatura de lucru (de 30 C˚
si respectiv 60C˚). Dupa aceasta se adauga simultan cate 1g
cationit si respectiv 1g anionit urmarindu-se dinamica fortei
electromotoare data de sistemul de electrozi ce masoara concentratia ionilor Cl- pana la
stabilirii echilibrului de schimb (cand
valoarea fortei electromotoare inregistrata de aparat ramane
constanta); in acest moment se adauga o noua cantitate de
schimbatori astfel ca procesul de schimb ionic reporneste. Procedeul se
continua pana cand valoarea fortei electromotoare
masurata in solutia din pahar este aproximativ egala cu cea corespunzatoare apei
demineralizate fapt ce arata ca toti ionii de clor din solutie
au fost retinuti. Asa cum s-a aratat ,
pentru fiecare experienta efectuta, dinamica concentratiei ionilor Cl-
in solutia supusa demineralizarii c(t) a fost inregistrata on line. In contactorul de laborator a fost introdus de
fiecare data cate un volum de 200 cm3 solutie de
electrolit (NaCl, CaCl2, NiCl2 si respectiv AlCl3
) avand concentratia initiala a ionilor Cl- la valoarea ![]() . Reactiile de schimb ionic ce au loc in
timpul contactarii (( 1.67),(1.68)) fac ca solutie concentratia ionilor sa
scada la orice adaus de anionit si cationit
. Reactiile de schimb ionic ce au loc in
timpul contactarii (( 1.67),(1.68)) fac ca solutie concentratia ionilor sa
scada la orice adaus de anionit si cationit
![]() (1.67)
(1.67)
![]() (1.68)
(1.68)
Procesele de schimb redate prin relatiile (1.67) si respectiv (1.68) continua atat timp cat in solutie exista ioni si se adauga schimbatori.
Rezultate experimentale. In scopul caracterizarii echilibrului de schimb la contactarea
batch s-au folosit solutii diluate de saruri NaCl, CaCl2,
NiCl2 si respectiv AlCl3 de concentratie
cunoscuta (![]() Cl-). Rezultatelor
experimentale obtinute, ce arata dinamica concentratie ionilor Cl-
in contactor sunt prezentate in figurile 1.20-1.21.
Cl-). Rezultatelor
experimentale obtinute, ce arata dinamica concentratie ionilor Cl-
in contactor sunt prezentate in figurile 1.20-1.21.
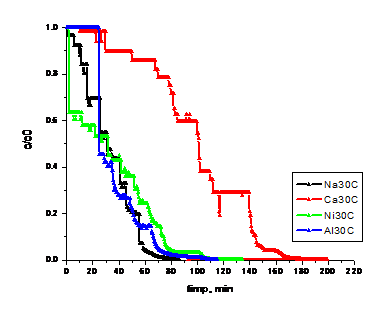
Figura. 1.20 . Dinamica concentratiei ionilor Cl- in faza lichida pentru operare la 300 C
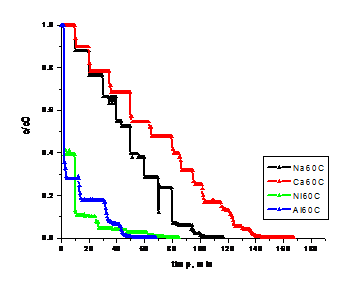
Figura. 1.21 . Dinamica concentratiei ionilor Cl- in faza lichida pentru operare la 600 C
Valorificarea rezultatelor experimentale . Asa cum s-a precizat anterior modalitatea de reprezentare a echilibrului atat in cazul adsorbtiei cat si a schimbului ionic este izoterma de echilibru. Izoterma de echilibru reprezinta reprezinta distributia speciei retinute intre adsorbant/ schimbator si solutie atunci cand sistemul este in echilibru. Diferenta intre adsorbtie si schimb ionic este aceea ca daca in cazul adsorbtiei putem vorbi despre o izoterma unica in cazul schimbului ionic pot exista mai multe izoterme functie de coionul asociat sistemului ion-contraion (Helfferich, 1962).
Plecand de la similitudinile dintre adsorbtie si schimbul ionic se propun doua modele pentru pentru descrierea echilibrului de schimb ionic. Primul model considera procesul de schimb ionic ca un proces de adsorbtie-desorbtie in care vitezele de adsorbtie si de desorbtie sunt exprimate cu relatile (1.69) si (1.70) in care cSA este concentratia ionului A in solid, in g/g iar cA concentratia ionului A in lichid, in g/l. Prin k1 si k3 sunt exprimate constantele de reactie in timp ce n reprezinta ordinul de reactie Marimea k2 caracterizeaza gradul de ocupare a punctelor active din schimbator
![]()
![]() (
(
La echilibru aceste viteze sunt egale astfel ca procesarea relatiei (1.71) conduce la exprimarea relatiei de echilibru conform relatiei (1.72)
![]()
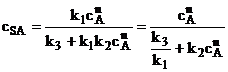
Relatia obtinuta va fi utilizata la valorificarea masutatorilor experimentale in scopul identificarii parametrilor modelului (n, k2, k3/k1 ). Cel de-al doilea model, care aminteste de izoterma Langmuir, porneste de la relatia de echilibru (1.73) . Aici cSA este concentratia ionului A in solid, in g/g, cA arata concentratia ionului A in lichid, in g/l iar k si n sunt constante de caracterizare a echilibrului.
![]() (1.73)
(1.73)
Pe baza modelelor matematice propuse datele experimentale obtinute au fost prelucrate in programul Mathcad; rezultatele obtinute fiind prezentate in tabelele de mai jos. Si sub forma curbelor de echilibru din figurile (1.22) - (1.25):
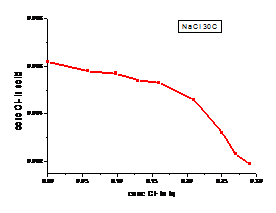
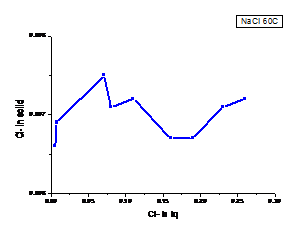
a b
Figura 1.22. Curbe de echilibru ale ionilor Cl- la diferite temperaturi cazul solutiei de NaCl
(a. 300C, b. 600C
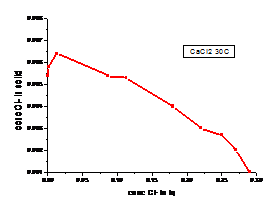
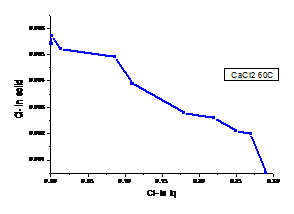
a b
Figura 1.23 Curbele de echilibru ale ionilor Cl- la diferite temperaturi - cazul solutiei de CaCl2
(a. 300C, b. 600C
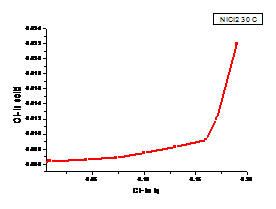
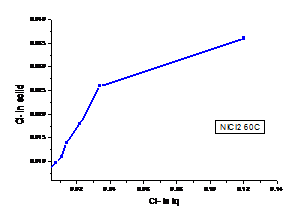
a b
Figura 1.24 Curbe de echilibru ale ionilor Cl- la diferite temperaturi cazul solutiei de NiCl2
(a. 300C, b. 600C
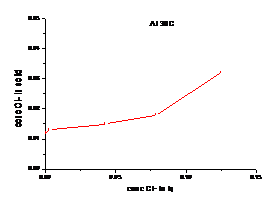
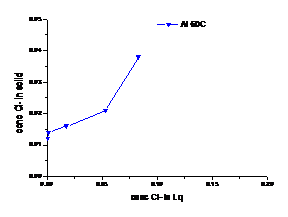
a b
Figura 1.25 Curbe de echilibru ale ionilor Cl- la diferite temperaturi cazul solutiei de AlCl3
(a. 300C, b. 600C)
Bibliografie
1. Alguacil, F.J., Alonso, M., Lozano, L.J., 2004, Chromium (III) recovery from waste acid solution by ion exchange processing using Amberlite IR-120 resin: batch and continuous ion exchange modelling, Chemosphere 57, pag 789-793.
2. Ahmad, A., Rafatullah, M., Danish, Md., 2006, Thermodynamics of Ion-Exchange of Alkali Metal Ions on Crystalline Niobium(V) Phosphate, Bull. Chem. Soc. Jpn., Vol. 79, (1), pag 88-94.
3. Ahmed, M., Malik, M.A., Pervez,S., Raffiq, S., 2004, Effect of porosity on sulfonation of macroporous styrene-divinylbenzene beads, European Polymer Journal 40, pag1609-1613;
4. Athanasiadis K., Helmreich B., 2005, Influence of chemical conditioning on the ion exchange capacity and on kinetic of zinc uptake by clinoptilolite. Water Research, 39, pag 1527-1532.
Barros, M. A.S.D., Silva, E.A. Arroyo, P.A. Tavares, C.R.G., Schneider. R.M, M. Suszek,M, Sousa-Aguiar, E.F.,2004, Removal of Cr(III) in the fixed bed column and batch reactors using as adsorbent zeolite NaX. Chem.Eng.,59, 5959 - 5966.
6. Chabani, M., Bensmaili, A., 2005, Kinetic modelling of the retention of nitrates by Amberlite IRA 410. Desalination 185, 509-515
7. Chabani, M., Amrane, A., Bensmaili, A., 2006, Kinetic modelling of the adsorption of nitrates y ion exchange resin, Chemical Engineering Journal 125, pag.111-117
Chen J.P., Wang, L., 2004, Characterization of metal adsorbtion kinetic properties in batch and fixed bed reactors, Chemosphere, 54, 397-404;
Christensen, S.G., Thomsen, K., 2005, Experimental measurement and modeling of the distribution of solvent and ions between an aqueous phase and an ion exchange resin, Fluid Phase Equilibria 228-229, pag 247-260.
10. Dardel, F., Arden, T. V., 1989, Ion exchange-principles and applications. Rohm and Haas Brochur, A(14).
Dechow, F.J., 1989, Separation and Purification Techniques in Biotechnology, William Andrew Publishing/Noyes, pag 163-320;
Dechow, F. J., Vogel, H.C., Tadaro, C.L., 2002, Fermentation and Biochemical Engineering Handbook - Principles, Process Design, and Equipment ,(2nd Edition),William Andrew Publishing/Noyes, pag 382-476
13. Demir, A.,Günay, A., Debik, E., 2002, Ammonium removal from aqueous solution by ion-exchange using packed bed natural zeolite, Water SA. Vol. 28 ( 3), pag 329-335;
14. Douglas Le Van, M., Carta, G., Carmen, M.,
Yon, M.S., 1999, Adsorption and Ion Exchange,
15. Koivula, R., 2004, Inorganic ion exchangers for decontamination of radioactive wastes generated by the nuclear power plants, Report Series in Radiochemistry No23.
16. Gallant, S.R., 2004,Modeling ion-exchange adsorption of proteins in a spherical particle, Journal of Chromatography A, 1028, pag 189-195;
17. Helfferich, F. G., 1964, Ion Exchange. McGraw Hill, New York.
18. Holl, W., 1997, Fundamentals of Ion Exchange. Institute for Technical
Chemistry,
Inglezakis, V.J., Loizidou, M.D., Grigoropoulou H.P., 2002, Equilibrium and kinetic ion exchange studies of Pb2+, Cr3+, Fe3+ and Cu2+ on natural clinoptilolite, Water Research 36, pag. 2784-2792;
20. Inglezakis,V.J., Grigoropoulou, H., 2004, Effects of operating conditions on the removal of heavy metals by zeolite in fixed bed reactors, Journal of Hazardous Materials B112, pag 37-43;
21. Ionescu, T., 1969, Schimbul ionic in tehnica, Editura Tehnica, Bucuresti.
22. Jorgensen, T.C., Weatherley, L.R., 2003, Ammonia removal from wastewater by ion exchange in the presence of organic contaminants, Water Research 37, pag 1723-1728.
23. Kim, J., Benjamin, M., 2004, Modeling a novel ion exchange process for arsenic and nitrate removal, Water Research 38, pag 2053-2062.
24. Navratil, J.D., Wei , Y., 2001, Actinide ion exchange technology in the back end of the nuclear fuel cycle. Nukleonika , 46(2), pag 75-80.
25. Petrus, R., Warchoł, J.,2003, Ion exchange equilibria between clinoptilolite and
aqueous solutions of Na+ /Cu2+, Na+ /Cd2+ and Na+/Pb2+, Microporous and Mesoporous Materials 61, pag 137-146
26. Pehlivan, E., Altun, T., 2006, The study of various parameters affecting the ion exchange of Cu2+, Zn2+, Ni2+, Cd2+, and Pb2+ from aqueous solution on
Dowex 50W synthetic resin, Journal of Hazardous Materials B134, pag 149-156.
27. Tan H.K.S., 2003, Ion exchange accompanied by neutralization in an anion bed
Chemical Engineering Journal 91, pag 59-66;
28. Trgo, M., Peric, J., Vukojevic Medvidovic, N., 2006, A comparative study of ion exchange kinetics in zinc/lead-modified zeolite-clinoptilolite systems. Journal of Hazardous Materials B136, pag 938-945.ORIGINAL PAPER
29. *** , 2002, Application of ion exchange processes for the treatment of radioactive waste and management of spent ion exchangers. - Vienna, International Atomic
Energy Agency. (Technical reports series, ISSN 0074-1994; no. 408)
30 Zhou, X., Xue, B., Bai, S., Sun 2002, Macroporous polymeric ion exchanger of high capacity for protein adsorption, Biochemical Engineering Journal 11, pag 13-17.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |