Potentialul de oxigen
Se
numeste potential de oxigen marimea ![]() , in care P
, in care P![]() este tensiunea de disociere a oxidului. El reflecta
capacitatea de oxidare a elementului (metalului) la diferite temperaturi
si depinde de temperatura si activitatea termodinamica a oxidului
si metalului.
este tensiunea de disociere a oxidului. El reflecta
capacitatea de oxidare a elementului (metalului) la diferite temperaturi
si depinde de temperatura si activitatea termodinamica a oxidului
si metalului.
Exemplu: se foloseste reactia de formare a oxidului:
2Me + O2 = 2MeO
Cand Me si MeO sunt substante in stare pura sau in solutie saturata aMeO = aMe = 1, sistemul este monovariant (l = Ci + 2 - f = 2 + 2 - 3 = 1) si deci:
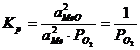 ,
,
logaritmand si inmultind cu - RT ambele parti rezulta:
- RT ln Kp
= RT ln P![]()
dar - RT ln Kp
= ΔG![]() , deci:
, deci: ![]() .
.
Rezulta ca potentialul de oxigen depinde numai de natura substantelor reactante si de temperatura (reda afinitatea normala a metalelor sau nemetalelor fata de oxigen).
Diagrama potentialelor de oxigen
Variatia potentialului de oxigena oxizilor cu temperatura in conditii standard este redata de diagrama potentialelor de oxigen (diagrama Ellingham).
Variatia este liniara deoarece in relatia de calcul se neglijeaza influenta temperaturii asupra lui ΔH0 si ΔS0.
Panta dreptei este:
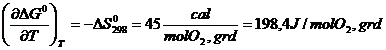
Panta este pozitiva pentru ca ΔS0 < 0 (gradul de dezordine in sistem creste prin inglobarea oxigenului gazos in sistem).
Daca dreapta se prelungeste in stanga pana la T = 0 K (- 273,16 sC) se poate citi pe ordonata ΔH0, adica entalpia de reactie standard la zero absolut (figura 2.17).
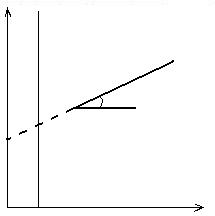
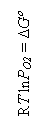
2Me + O2 = 2MeO
![]() tg
tg![]() = - ΔS0
= - ΔS0
![]()
ΔH0
0 K T
Fig. 2.17. Variatia cu temperatura a potentialului de oxigen al
unui oxid
Cand Me si MeO formeaza solutii nesaturate sistemul este bivalent
(l = 2) deci potentialul de oxigen depinde de T si de aMe si aMeO.
Constanta de echilibru a reactiei 2Me + O2 = 2MeO are forma:
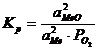 .
.
Se logaritmeaza ambele parti ale relatiei si se inmultesc cu - RT:
-RT
ln Kp = RT ln P![]() - 2RT ln
- 2RT ln ![]()
![]()
de unde:
![]()
sau
![]()
In
reprezentarea grafica (figura 2.18) a functiei ![]() = f (T) termenul al doilea al relatiei
anterioare poate determina modificarea pantei (pozitiei) dreptelor in
functie de valoarea raportului
= f (T) termenul al doilea al relatiei
anterioare poate determina modificarea pantei (pozitiei) dreptelor in
functie de valoarea raportului ![]() , astfel:
, astfel:
a)
![]() > 1 (aMe <
1 datorita intrarii metalului intr-o solutie nesaturata).
Rezulta ca dreapta RT ln P
> 1 (aMe <
1 datorita intrarii metalului intr-o solutie nesaturata).
Rezulta ca dreapta RT ln P![]() = f (T) se roteste in sensul invers
acelor de ceasornic, deci potentialul de oxigen creste in jurul unui
punct aflat la intersectia intre dreapta respectiva si verticala
dusa la T = 0 K (-273,16 sC).
= f (T) se roteste in sensul invers
acelor de ceasornic, deci potentialul de oxigen creste in jurul unui
punct aflat la intersectia intre dreapta respectiva si verticala
dusa la T = 0 K (-273,16 sC).
b)
![]() < 1 intrarii oxidului intr-o solutie
nesaturata - zgura). Rezulta ca dreapta RT ln P
< 1 intrarii oxidului intr-o solutie
nesaturata - zgura). Rezulta ca dreapta RT ln P![]() = f (T) se roteste in sensul acelor de
ceasornic (potentialul de oxigen scade) in jurul aceluiasi punct.
= f (T) se roteste in sensul acelor de
ceasornic (potentialul de oxigen scade) in jurul aceluiasi punct.
c)
![]() = 1, p = RT ln P
= 1, p = RT ln P![]() = ΔG0
potentialul de oxigen depinde numai de temperatura. Cazul este
echivalent cazului aMeO
= aMe =
1.
= ΔG0
potentialul de oxigen depinde numai de temperatura. Cazul este
echivalent cazului aMeO
= aMe =
1.
![]() aMeO=1 aMeO=1
aMeO=1 aMeO=1
aMe<1 aMeO=1
aMe= 1
aMe>1
0 K 0
Fig. 2.18. Variatia p cu activitatile
metalului si oxidului sau.
Utilizarea diagramei potentialului de oxigen la analiza proceselor siderurgice
Stabilitatea relativa a
oxizilor. Cu cat ΔG![]() de formare a oxidului (care se citeste pe
ordonata) este mai negativ (deci dreapta situata mai jos), cu atat
afinitatea metalului fata de oxigen este mai mare si stabilitatea
oxidului este mai mare. Intrucat ΔG
de formare a oxidului (care se citeste pe
ordonata) este mai negativ (deci dreapta situata mai jos), cu atat
afinitatea metalului fata de oxigen este mai mare si stabilitatea
oxidului este mai mare. Intrucat ΔG![]() = RT ln P
= RT ln P![]() se poate spune ca, cu cat p scade cu atat stabilitatea oxidului este
mai mare si invers, pentru acelasi T. Asa se vede ca stabilitatea oxizilor creste de la
CuO → FeO → SiO2 → Al2O3.
se poate spune ca, cu cat p scade cu atat stabilitatea oxidului este
mai mare si invers, pentru acelasi T. Asa se vede ca stabilitatea oxizilor creste de la
CuO → FeO → SiO2 → Al2O3.
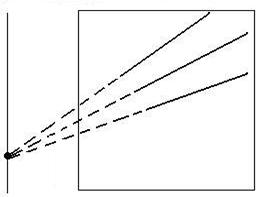
Analiza posibilitatii unor reactii de schimb. Pentru a se vedea daca in conditii standard (substante pure si P = 1atm) este posibila sau nu o reactie de schimb de tipul:
Me1O + Me2 = Me2O + Me1,
ΔG0 se calculeaza ΔG![]() al reactiei.
al reactiei.
Daca
ΔG![]() < 0 atunci reactia este posibila. Daca
ΔG
< 0 atunci reactia este posibila. Daca
ΔG![]() = ΔG
= ΔG![]() - ΔG
- ΔG![]() , adica este diferenta entalpiilor libere de
formare a celor doi oxizi la temperatura T.
Conditia ΔG
, adica este diferenta entalpiilor libere de
formare a celor doi oxizi la temperatura T.
Conditia ΔG![]() < 0 este indeplinita cand
< 0 este indeplinita cand ![]() . Asadar calitativ, este necesar ca dreapta pentru Me2O
sa fie sub dreapta pentru Me1O, iar cantitativ, trebuie ca ΔG
. Asadar calitativ, este necesar ca dreapta pentru Me2O
sa fie sub dreapta pentru Me1O, iar cantitativ, trebuie ca ΔG![]() = ΔG
= ΔG![]() - ΔG
- ΔG![]() < 0 (figura 2.19).
< 0 (figura 2.19).
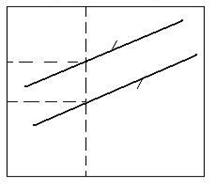
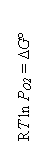
![]()
![]() 2Me1
+ O2 = 2Me1O
2Me1
+ O2 = 2Me1O
![]() ΔG
ΔG![]() ΔG
ΔG![]()
ΔGs
2Me2 + O2 =2Me2O
0 T
Fig. 2.19. Posibilitatea utilizarii unor reactii de schimb
Determinarea presiunii partiale a oxigenului asupra unui oxid la o temperatura data(figura 2.20)
Pentru
a se determina P![]() corespunzator echilibrului unui oxid la T se duce din punctul "W" o linie
dreapta care trece prin punctul de intersectie intre verticala
temperaturii T si dreapta RT ln P
corespunzator echilibrului unui oxid la T se duce din punctul "W" o linie
dreapta care trece prin punctul de intersectie intre verticala
temperaturii T si dreapta RT ln P![]() = f(T). Prelungind linia pana la axa
notata cu P
= f(T). Prelungind linia pana la axa
notata cu P![]() se obtine un alt punct care reprezinta valoarea
presiunii partiale de echilibru P
se obtine un alt punct care reprezinta valoarea
presiunii partiale de echilibru P![]() (tensiunea de disociere).
(tensiunea de disociere).
 W 0 P
W 0 P![]()
Meinst.→MeO

P![]() > P
> P![]() (e)
(e)
MeOinst → Me P![]() (e)
(e)
P![]() < P
< P![]() (e)
(e)
0 T sC
P![]()
Fig. 2.20. Schema pentru determinarea P
![]() la echilibru a oxizilor
la echilibru a oxizilor
Daca
in faza gazoasa ambientala presiunea partiala a oxigenului,
p![]() este mai mare decat tensiunea de disociere P
este mai mare decat tensiunea de disociere P![]() la temperatura T
are loc formarea oxidului (oxidarea metalului), iar daca p
la temperatura T
are loc formarea oxidului (oxidarea metalului), iar daca p![]() < P
< P![]() are loc disocierea oxidului.
are loc disocierea oxidului.
Explicatia se da cu ajutorul izotermei lui Van' t Hoff.
In conditii standard (aMe = aMeO = 1) pentru reactia:
2Me + O2 = 2MeO; Kp
= ![]()
unde: P![]() este presiunea partiala de echilibru a oxigenului;
este presiunea partiala de echilibru a oxigenului;
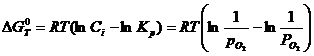 ;
;
unde: p![]() este presiunea partiala externa a oxigenului
este presiunea partiala externa a oxigenului
sau
![]() .
.
a)
cand P![]() < p
< p![]() → ΔG
→ ΔG![]() < 0 are loc reactia de oxidare a Me;
< 0 are loc reactia de oxidare a Me;
b)
cand P![]() > p
> p![]() → ΔG
→ ΔG![]() > 0 poate avea loc reactia inversa (disociere).
> 0 poate avea loc reactia inversa (disociere).
In procesele tehnologice de cele mai multe ori metalele si oxizii nu se afla in stare pura, ci sub forma de componenti ai unor solutii metalice (fonta, otel, feroaliaje) sau nemetalice (zgura) ceea ce atrage modificari radicale ale potentialului de oxigen fata de cel indicat in diagrama (Ellingham). Implicatiile acestor modificari vor fi analizate in continuare.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |