
Termodinamica disocierii termice a carbonatilor
Disocierea carbonatului de calciu
Formele naturale cele mai raspandite ale carbonatului de calciu sunt calcarul, creta, marmura, calcita si aragonita.
Deoarece calcarul este utilizat pe scara larga in siderurgie el va fi tratat in mod special. aragonita este stabila termodinamic numai sub - 59 °C (214 K), asa incat in conditii normale este doar metastabila, adica tinde sa se transforme, este drept lent, in calcita.
La 400 °C (673 K), transformarea aragonitei in calcita dupa reactia:
![]() CaCO3(aragonit) →Ca CO3(calcit) ΔH0 = -200,9J/mol
CaCO3(aragonit) →Ca CO3(calcit) ΔH0 = -200,9J/mol
ΔG![]() = -200,9 + 0,837
= -200,9 + 0,837![]() [J/mol]
[J/mol]
are o viteza masurabila.
Disocierea termica a calcarului are loc in cuptoarele speciale pentru obtinerea varului, dar si direct in agregate siderurgice (furnale, benzi de aglomerare, cuptoare Siemens - Martin etc.).
Reactia de disociere este:
CaCO3(calcita) ↔CaOs + CO2 ΔG![]() = 170 893 - 144,45
= 170 893 - 144,45![]() [J/mol]
[J/mol]
lg Kp
=lg P![]() = -
= - ![]() + 7,54
+ 7,54
Variatia
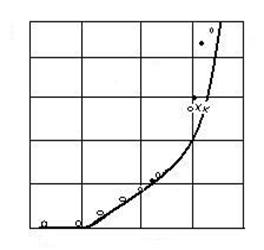
tensiunii de disociere P![]() , cu temperatura este redata in figura 2.9.
, cu temperatura este redata in figura 2.9.
2,0
1,6
PCO![]() 1,2
1,2
(atm)
0,6
0,4
0
600 700 800 900 1000 T (°C)
Fig. 2.9. Variatia tensiunii de disociere a CaCO3 cu
temperatura
Se dau mai jos cateva valori ale tensiunii de disociere la diferite temperaturi:
|
T, °C | ||||||||
|
P atm |
2,1 |
2,3 |
Asa cum era de asteptat cresterea temperaturii mareste tensiunea de disociere a carbonatului de calciu. Pentru o temperatura data, cresterea gradului de dispersie a carbonatilor mareste tensiunea de disociere.
Pentru
calcita temperatura teoretica
de disociere termica in aerul atmosferic contine 0,0338% CO2
(PCO![]() = 0,000338 atm) este:
= 0,000338 atm) este:
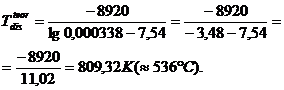
Temperatura practica de disociere termica a calcitei este:
![]()
Experimental temperatura practica de disociere termica se determina pe cale termografica, trasandu-se la instalatii automatizate (derivatograf) curbele de variatie a temperaturii probei cu timpul (termograme). Cand se atinge temperatura practica de disociere pe termograma apare un palier.
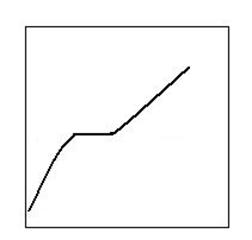 In figura 2.10, care reda termograma disocierii calcitei, se
observa existenta palierului la temperatura practica de
disociere a calcitei.
In figura 2.10, care reda termograma disocierii calcitei, se
observa existenta palierului la temperatura practica de
disociere a calcitei.
T, °C
910 °
τ, min
Fig. 2.10. Termograma disocierii calcitei (CaCO3).
Fiecare varietate de carbonat prezinta pe termograma un palier propriu, corespunzator temperaturii practice de disociere:
|
Tipul de carbonat |
% CaCO3 |
T |
|
Calcita | ||
|
Calcar | ||
|
Creta | ||
|
Marmura |
Temperatura de disociere a carbonatilor de calciu depinde in primul rand de structura lor mineralogica, dar si de prezenta diferitelor impuritati. S-a stabilit ca cresterea continutului total de impuritati (SiO2 + Al2O3 + Fe3O4) micsoreaza temperatura de descompunere a carbonatului de calciu ca urmare a formarii de solutii solide nesaturate cu CaCO3. Dintre toate impuritatile, cea mai importanta influenta are in acest sens silicea (SiO2).
Pe termograme prezenta unei cantitati mari de impuritati in CaCO3, face ca palierul de disociere sa se transforme intr-o curba mai mult sau mai putin inclinata.
Studiile efectuate au permis sa se traga concluzia ca intre CaCO3 si CaO se formeaza solutii solide care, insa se satureaza rapid. Concentratiile de saturatie sunt:
- solutia solida de CaO in CaCO3 (CaO)max = 2,4%;
- solutia solida de CaCO3 in CaO (CaCO3)max = 4%.
Conditiile de disociere a carbonatului
In prezent calcarul se foloseste ca atare, sau transformat in var, care are o larga utilizare la elaborarea otelului, pentru formarea zgurii.
Regimul termic de calcinare trebuie ales astfel incat sa se obtina un var care sa aiba capacitatea de a se dizolva rapid in zgura, cerinta deosebit de importanta, mai ales pentru convertizoarele cu oxigen (tip LD), in care procesul de elaborare a otelului se desfasoara foarte rapid. S-a ajuns la concluzia ca pentru a obtine un var asa-zis "moale" caracterizat prin structura poroasa si capacitate de dizolvare rapida in zgura, temperatura de calcinare trebuie sa fie de 1100 - 1150 °C. Daca se depaseste acest interval de temperatura, se obtine un var "dur", cu structura compacta si greu dizolvabil in zgura, deci inadecvat utilizarii la elaborarea otelului, mai ales in agregatele cu mers rapid (convertizoare).
Varul trebuie folosit imediat ce a fost obtinut prin descompunerea calcarului, deoarece este higroscopic (absoarbe rapid apa din aer).
Disocierea termica a carbonatului de magneziu
Carbonatul de magneziu se afla in stare naturala sub forma de magnezita, care reprezinta materia prima pentru fabricarea materialelor refractare magnezitice, cu larga utilizare in siderurgie (in special in domeniul elaborarii otelului).
Reactia de disociere termica a carbonatului de magneziu este:
MgCO3 ↔ MgO
+ CO2 ΔH![]() = 110 803 [J/mol];
= 110 803 [J/mol];
ΔG![]() = 110 803 - 120,13
= 110 803 - 120,13![]() [J]
[J]
lg Kp
= lg P![]() =
= ![]() .
.
Temperatura teoretica de disociere este:
![]() (320,33 °C)
(320,33 °C)
Temperatura practica de disociere este:
![]() (649,64 °C).
(649,64 °C).
Comparativ cu temperatura de disociere a carbonatului de calciu se constata ca MgCO3 disociaza mai usor decat CaCO3 (este mai putin stabil).
Tensiunile de disociere inregistrate la diferite temperaturi sunt:
|
T, °C | |||||||
|
P |
Datele de mai sus au fost confirmate si de studiul termografic. Pe termografele obtinute se constata existenta unor paliere mai mult sau mai putin tipice (orizontale) la circa 640 - 660 °C, in functie de caracteristicile de compozitie si structurale ale carbonatilor.
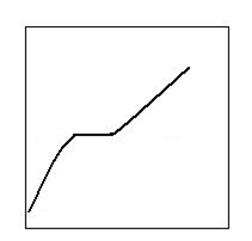
T, °C
650 °
τ, min
Fig. 2.11. Termograma disocierii magnezitei (MgCO3)
Disocierea termica a dolomitei
Dolomita este carbonat dublu de calciu si magneziu Ca, Mg(CO2). Ea se foloseste pentru obtinerea materialelor refractare dolomitice (blocuri, caramizi, mase refractare) si uneori ca fondant.
Trebuie
subliniat ca dolomita nu este un simplu amestec de carbonat de calciu si
carbonat de magneziu, ci un compus cu legaturi complexe intre ionii de Ca2+,
Mg2+ si CO![]() . Dovada o constituie faptul ca formarea dolomitei din
CaCO3 si MgCO3 este insotita de degajare
de caldura.
. Dovada o constituie faptul ca formarea dolomitei din
CaCO3 si MgCO3 este insotita de degajare
de caldura.
CaCO3 +MgCO3 = Ca,Mg(CO3)2 ΔH![]() = -11 888 [J/mol]
= -11 888 [J/mol]
Disocierea termica a dolomitei are loc in doua etape :
CaMg(CO3)2 = CaCO3 + MgO + CO2
CaCO3 =CaO + CO2
Datorita interactiunii ionilor din reteaua dolomitei, prima treapta a disocierii decurge mai dificil decat disocierea MgCO3 propriu-zis.
Calculul temperaturii de disociere in prima treapta
MgCO3 = MgO + CO2 ΔG![]() = 110 803 - 120,13
= 110 803 - 120,13![]() [J/mol]
[J/mol]
Tinand
seama de efectul termic de formare a dolomitei din cei doi carbonati
(ΔH![]() = - 11 888 J/mol) efectul termic al primei etape este:
= - 11 888 J/mol) efectul termic al primei etape este:
1) ΔH![]() = 110 803 + 11 888 = 122 691 [J/mol]
= 110 803 + 11 888 = 122 691 [J/mol]
ceea ce inseamna ca pentru prima etapa a disocierii dolomitei:
ΔG![]() = 122 691 - 120,13
= 122 691 - 120,13![]() [J/mol]
[J/mol]
lg Kp = lg P![]() = -
= -![]() .
.
Temperatura teoretica de disociere este:
![]() K (384 °C).
K (384 °C).
Temperatura practica de disociere este:
![]() = 102,5 K (748,5 °C).
= 102,5 K (748,5 °C).
Termogramele obtinute prin studiul termografic confirma ca temperatura practica de disociere a dolomitei in prima etapa este de 720 - 750 °C.
A doua treapta de disociere termica a dolomitei are loc la temperaturile de disociere a carbonatului de calciu (900 - 920 °C).
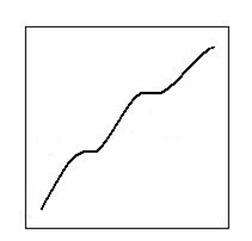
T, °C
910 ° C
Fig. 2.12. Termodinamica disocierii dolomitei.
720-750° C
τ, min
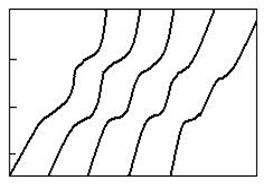 T, sC
T, sC
Fig. 2.13. Influenta gradului de dispersie asupra temperaturii de
disociere a dolomitei: 1,
2, 4-granulatie fina ; 3, 5-granulatie mare.
900 914 922 922 920
700 707 745 735 747
500 1 2 3 4 5
τ, min
Influenta gradului de dispersie asupra temperaturii de disociere este redata in figura 2.13. Se observa ca cu cat gradul de dispersie a dolomitei este mai mare (granulatia este mica) temperaturile de disociere in ambele trepte sunt mai mici.
Schema reala de disociere a dolomitei:
I. nCaMg(CO3)2 = (n -
1)MgO + MgCO3 ![]() CaCO3 + (n-1)CO2
CaCO3 + (n-1)CO2
II MgCO3![]() CaCO3 = MgO + nCaO + (n+1)CaO2
CaCO3 = MgO + nCaO + (n+1)CaO2
Conditii tehnice de disociere a dolomitei si magnezitei
Spre deosebire de var, magnezita si dolomita folosite ca material refractar trebuie calcinate la temperaturi inalte, pentru a se obtine produse stabile la hidratare. Temperatura inalta de calcinare favorizeaza procesul de recristalizare; cresterea cristalelor reduce reactivitatea magnezitei si dolomitei calcinate, marind stabilitatea acestora. Pelicula formata pe suprafata cristalelor prin reactiile cu impuritatile reprezinta si ea un strat protector pentru materialele calcinate, carora le mareste stabilitatea la calcinare.
Disocierea termica a carbonatului de fier
Carbonatul de fier se gaseste in natura sub forma de siderita care reprezinta un minereu de fier foarte raspandit in toata lumea, inclusiv in tara noastra.
Inainte de a fi folosita pentru elaborarea fontei, siderita este supusa unui proces de prajire (calcinare) in cuptoare verticale sau pe benzile de aglomerare. Prajirea este de fapt o disociere termica de un tip special, avand in vedere ca produsul primar al descompunerii FeO reactioneaza cu CO2.
Procesul prajirii consta din doua trepte:
I. FeCO3
= FeO + CO2 ΔH![]() = 103 980 J/mol FeO
= 103 980 J/mol FeO
II. 3FeO + CO2 = Fe3O4 ΔH![]() = -22 395 J/mol Fe3O4
= -22 395 J/mol Fe3O4
Pentru a insuma cele doua etape, se inmulteste prima relatie cu trei:
I. 3FeCO3 = 3FeO + 3CO2 ΔH![]() = 311 940 (J)
= 311 940 (J)
II. 3FeO + CO2 = Fe3O4 ΔH![]() = -22 395 (J)
= -22 395 (J)
|
III.
3FeCO3 = Fe3O4 + 2CO2 + CO ΔH |
Recalculand pentru un mol de FeCO3 se obtine:
III, a) FeCO3 = ![]() Fe3O4 +
Fe3O4 + ![]() CO2 +
CO2 + ![]() CO
CO
ΔH![]() = 96 515 J/mol FeCO3.
= 96 515 J/mol FeCO3.
Compozitia reala a produsului prajit depinde de conditiile concrete de lucru. Spre exemplu, daca evacuarea CO2 din zona de reactie este lenta, aceasta favorizeaza etapa a II- a si defavorizeaza etapa I, ceea ce inseamna ca produsul prajit consta numai din Fe3O4. Daca dimpotriva, evacuarea CO2 este energica, in produsul prajit ramane mult FeO. La limita, daca disocierea (prajirea) se desfasoara in vid, asigurandu-se evacuarea completa a CO2 din zona de reactie, procesul se termina in prima etapa, iar produsul prajit contine numai FeO.
In realitate, procesul de prajire decurge astfel incat procesul obtinut consta dintr-un amestec de FeO si Fe3O4.
Temperatura de descompunere in prima etapa poate fi calculata dupa relatia:
lg Kp
= lg P![]() = -
= - ![]() + 8,07
+ 8,07
de unde rezulta:
- temperatura teoretica de disociere
![]() = 470 K (197 °C)
= 470 K (197 °C)
- temperatura practica de disociere
![]() = 673 K (400 °C)
= 673 K (400 °C)
ceea ce se afla in buna concordanta cu datele experimentale.
Valorile tensiunii de disociere a sideritei la diferite temperaturi sunt date in continuare:
|
T, K | ||||
|
P |
1,62 |
Se observa ca siderita disociaza si mai usor decat MgCO3, deci are stabilitate si mai mica decat acesta.
Stabilitatea comparativa a componentilor
Pentru aprecierea stabilitatii carbonatilor pot fi luate in considerare
toate trei criteriile amintite anterior ΔG0 de formare, tensiunea de disociere
si ΔH0 de formare a carbonatilor.
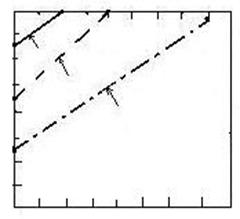
In
figura 2.14. este prezentata variatia ΔG0 de formare a diferitilor carbonati (ΔG0 = RT ln P![]() ) cu temperatura.
) cu temperatura.
 0
0
ΔG![]() ,
,
Fig. 2.14. Variatia entalpiei libere de formare a unor carbonati.
Kcal FeCO3
-10 MgCO3
CaCO3
- 25
- 35
0 100 300 500 700 900 T, °C
Cu cat dreapta care se refera la un carbonat este situata mai jos, cu atat ΔG0 de formare a carbonatului este mai negativ, iar stabilitatea lui este mai mare.
In figura 2.15 este redata variatia cu temperatura a tensiunii de disociere a catorva carbonati. Cu cat curba este situata mai la dreapta, cu atat temperatura de disociere este mai mare, iar stabilitatea carbonatului este mai mare.
P
![]() , mmHg
, mmHg
Fig. 2.15. Variatia comparativa a tensiunii de disociere a unor
carbonati cu temperatura.
900 FeCO3
MgCO3
CaCO3
500
300
100
800 1000 1200 T, K
Deci stabilitatea carbonatilor este foarte variata si depinde de taria legaturilor din reteaua lor cristalina.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |