
Termodinamica reactiilor din sistemul H-O
Reactia de ardere a hidrogenului
5) 2H2 + O2 2H2O(g) ΔG![]() -504 124 + 117,45 T (J),
-504 124 + 117,45 T (J),
 ,
,  .
.
Elementele principale ale analizei termodinamice ale acestei reactii sunt identice cu cele referitoare la reactia (3) 2CO + O2 2CO2.
Varianta sistemului
Aplicand legea fazelor pentru reactia de ardere a hidrogenului se obtine:
l = Ci + n - f = 2 + 2 - 1 = 3
deci
este suficient sa se cunoasca 3 din cei 5 parametri care
influenteaza sistemul, T, Pt,
P![]() , PO
, PO![]() , PH
, PH![]() O, pentru ca sistemul sa fie determinat.
O, pentru ca sistemul sa fie determinat.
Influenta presiunii
Influenta presiunii este determinata de variatia de volum a sistemului. In cazul reactiei de ardere a hidrogenului variatia de volum
ΔV = -1, deci cresterea presiunii in sistem favorizeaza desfasurarea reactiei de la stanga la dreapta.
Influenta temperaturii
Reactia
de ardere a hidrogenului fiind o reactie puternic exoterma ΔH < 0, este defavorizata de
cresterea temperaturii in sistem. Deoarece, ![]() > 0, rezulta
ca variatia cu temperatura a constantei de echilibru este o
curba descrescatoare, asa cum se poate vedea in tabelul
urmator:
> 0, rezulta
ca variatia cu temperatura a constantei de echilibru este o
curba descrescatoare, asa cum se poate vedea in tabelul
urmator:
|
T, K |
log Kp |
Kp |
|
2C + O2 = 2CO2 |
||
|
4,445 |
||
|
7,998 |
||
|
9,727 |
||
|
1,073 |
||
|
1,183 |
||
|
2CO + O2 = 2CO2 |
||
|
2,330 |
||
|
5,093 |
||
|
6,602 |
||
|
2,377 |
||
|
0,857 |
||
Temperatura
de echilibru se determina fie din ![]() punandu-se
conditia
punandu-se
conditia ![]() sau din relatia
sau din relatia ![]() punandu-se
conditia
punandu-se
conditia ![]() , de unde rezulta Te
= 4292 K (4019 °C). Deci, reactia are loc pana la temperaturi
foarte inalte.
, de unde rezulta Te
= 4292 K (4019 °C). Deci, reactia are loc pana la temperaturi
foarte inalte.
Gradul de disociere x a vaporilor de apa in H2 si O2 dupa reactia:
5') 2H2O = 2H2 + O2, H > 0, se calculeaza cu relatia:
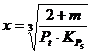 , in care
, in care ![]() in aerul de combustie.
in aerul de combustie.
Concluziile privind influenta negativa a disocierii vaporilor de apa in procesele de ardere a diversilor combustibili continand hidrogen si hidrocarburi sunt aceleasi ca si in cazul disocierii dioxidului de carbon.
Tot din sistemul H - O fac parte si reactiile de formare a radicalilor OH:
6)
2 H2Og = 2 OH + H2 ΔH![]() = 521 981 J/mol H2
= 521 981 J/mol H2
7)
2 H2Og + O2 = 4 OH ΔH![]() = 565 152 J/mol H2
= 565 152 J/mol H2
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |