
Termodinamica reactiilor in sistemul C-H-O
Termodinamica reactiei gazului de apa
Reactia gazului de apa:
9)
CO2 + H2 = CO + H2O ΔG![]() = 30 493 - 28,11 T (J)
= 30 493 - 28,11 T (J)
Reactia are un rol important in formarea fazei gazoase in furnal.
Putand atinge usor echilibru reactia a fost bine studiata experimental. Pe cale indirecta, datele termodinamice pot fi obtinute pe baza legii lui Hess, folosindu-se schema:
3) 2CO + O2 = 2CO2 |-1
5) 2H2 + O2 = 2H2O
|
9) 2(CO2 + H2 = CO + H2O) |
adica
(9) = ![]() [ (5) - (3) ]
[ (5) - (3) ]
ΔH![]() =
=![]() (ΔH
(ΔH![]() - ΔH
- ΔH![]() ) = 30 493 (J/mol)
) = 30 493 (J/mol)
ΔG![]() =
= ![]() (ΔG
(ΔG![]() - ΔG
- ΔG![]() ) = 30 493 - 28,11 T (J/mol)
) = 30 493 - 28,11 T (J/mol)
![]() , sau
, sau
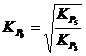 , rezulta deci ca
, rezulta deci ca ![]() , cand
, cand ![]() , adica la 1083 K (810 °C).
, adica la 1083 K (810 °C).
Varianta sistemului
![]() .
.
Deci
pentru a defini compozitia fazei gazoase la echilibru trebuie
cunoscuti patru parametrii termodinamici: T, P si doua din presiunile partiale ![]() ,
,![]() ,
,![]() ,
,![]() .
.
Influenta temperaturii. Reactia fiind endoterma este favorizata de cresterea temperaturii (constanta de echilibru creste cu cresterea temperaturii).
Influenta presiunii. Reactia decurge fara variatie de volum, deci reactia gazului de apa nu este influentata de variatiile de presiune in sistem, daca acestea nu conduc la modificarea starii de agregare a substantelor.
Compozitia fazei gazoase de echilibru.
Daca
se noteaza  si
si  , atunci
, atunci 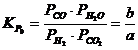 sau
sau ![]() care reprezinta
ecuatia unei drepte care trece prin origine, avand coeficientul unghiular
egal cu
care reprezinta
ecuatia unei drepte care trece prin origine, avand coeficientul unghiular
egal cu ![]() , (creste cu cresterea temperaturii). Reprezentarea
grafica a ecuatiei este:
, (creste cu cresterea temperaturii). Reprezentarea
grafica a ecuatiei este:
![]()
 1800 1600 1400 1200 K
1800 1600 1400 1200 K
K
4 1000
3
2
1 800
0 600
![]()
0 1 2 3 4
Fig. 1.11. Corelatia intre presiunile partiale ale
ale componentilor fazei gazoase de echilibru a reactiei (9).
La
1083 K (810 °C) afinitatea CO si H2 fata de oxigen
este aceeasi si deci Kp![]() = 1. La T >1083 K (810 °C)
afinitatea hidrogenului fata de oxigen este mai mare decat a oxidului
de carbon si de aceea Kp
= 1. La T >1083 K (810 °C)
afinitatea hidrogenului fata de oxigen este mai mare decat a oxidului
de carbon si de aceea Kp![]() >
>
Daca se cunoaste temperatura si compozitia initiala a fazei gazoase se poate determina compozitia fazei gazoase la echilibru.
Reactia carbonului cu vaporii de apa
10) Cs + H2Og = CO + H2; ΔH > 0
11) Cs + 2H2Og = CO2 + 2H2; ΔH > 0
ΔG![]() = 140 295 - 146,34T (J)
= 140 295 - 146,34T (J)
ΔG![]() = 109 802 - 118,23T (J)
= 109 802 - 118,23T (J)
 si respectiv
si respectiv
 .
.
Aceste reactii se produc in furnale, la aglomerare, in gazogene si in orice situatie in care vaporii de apa vin in contact cu cocsul sau cu carbunele in stare incandescenta.
Ambele reactii decurg in paralel, prima fiind preponderenta in zonele in care temperatura este mai ridicata si continutul de umiditate mai mic, ea fiind puternic endoterma (ΔH10 > ΔH11).
Studiul termodinamic se face de obicei prin metoda indirecta, folosindu-se schemele de mai jos:
CO2 + C 2CO
![]() CO2 + H2
CO + H2O
CO2 + H2
CO + H2O
10) C + H2 O CO + H2.
4) CO2 + C 2CO
![]() 9) CO2 + H2 CO + H2O
9) CO2 + H2 CO + H2O
11) C + 2H2O CO2 + 2H2
Conform legii lui Hess se obtine:
ΔH![]() = ΔH
= ΔH![]() - ΔH
- ΔH![]() = 140 295 (J/mol C) si
= 140 295 (J/mol C) si
ΔH![]() = ΔH
= ΔH![]() - 2ΔH
- 2ΔH![]() = 109 802 (J/mol C)
= 109 802 (J/mol C)
ΔG![]() = ΔG
= ΔG![]() - ΔG
- ΔG![]() = 140 295 -146,34·T (J/mol C) si respectiv
= 140 295 -146,34·T (J/mol C) si respectiv
ΔG![]() = ΔG
= ΔG![]() - 2ΔG
- 2ΔG![]() = 109 802 -118,23·T (J/mol C)
= 109 802 -118,23·T (J/mol C)
![]()
 si respectiv
si respectiv ![]()
![]() .
.
Influenta temperaturii
Reactiile
carbonului cu vaporii de apa sunt endoterme, deci cresterea
temperaturii le influenteaza pozitiv (![]() si
si ![]() cresc cu temperatura),
dar
cresc cu temperatura),
dar  si
si  , ceea ce conduce la concluzia ca, cresterea
temperaturii determina cresterea continutului de CO, H2
si CO2 in faza gazoasa. Acest lucru este numai
partial adevarat pentru ca intervine reactia Bell - Boudouard
CO2 + C = 2CO (4) de echilibru careia depinde raportul dintre
CO/CO2 in faza gazoasa in prezenta carbonului. Dar
reactia Bell - Boudouard este endoterma (ΔH
, ceea ce conduce la concluzia ca, cresterea
temperaturii determina cresterea continutului de CO, H2
si CO2 in faza gazoasa. Acest lucru este numai
partial adevarat pentru ca intervine reactia Bell - Boudouard
CO2 + C = 2CO (4) de echilibru careia depinde raportul dintre
CO/CO2 in faza gazoasa in prezenta carbonului. Dar
reactia Bell - Boudouard este endoterma (ΔH![]() = 170 788 J/mol CO2) si cresterea
temperaturii conduce la cresterea continutului de CO in faza
gazoasa de echilibru. Pentru reactiile (10) si (11) aceasta
inseamna ca la cresterea temperaturii faza gazoasa se imbogateste
in CO si H2 dar nu si in CO2. Se observa
ca |ΔH
= 170 788 J/mol CO2) si cresterea
temperaturii conduce la cresterea continutului de CO in faza
gazoasa de echilibru. Pentru reactiile (10) si (11) aceasta
inseamna ca la cresterea temperaturii faza gazoasa se imbogateste
in CO si H2 dar nu si in CO2. Se observa
ca |ΔH![]() | > |ΔH
| > |ΔH![]() |, ceea ce inseamna ca
|, ceea ce inseamna ca ![]() creste mai rapid
cu temperatura decat
creste mai rapid
cu temperatura decat ![]() , deci cele doua curbe
, deci cele doua curbe ![]() si
si ![]() se intersecteaza.
Temperatura punctului de intersectie se determina din egalare celor
doua expresii:
se intersecteaza.
Temperatura punctului de intersectie se determina din egalare celor
doua expresii:
![]()
![]() de unde va rezulta T 1083 K (810 °C)
de unde va rezulta T 1083 K (810 °C)
La
aceasta temperatura ![]() , iar
, iar![]() .
.
Aceasta
temperatura poate fi dedusa fara calcul, pe baza
relatiilor:  si
si 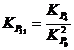 . Se observa ca egalitatea
. Se observa ca egalitatea ![]() se realizeaza la
se realizeaza la ![]() pentru care s-a
stabilit ca
pentru care s-a
stabilit ca ![]() cand T = 1083 K (810 °C).
cand T = 1083 K (810 °C).
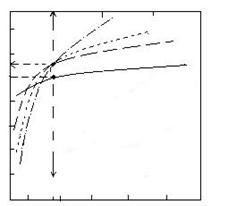 1083 2000 3000 K
1083 2000 3000 K
lg Kp a
a) C + H2O = CO + H2 b) C + 2H2O CO2 + 2H2 c) CO2 + C 2CO d) CO2 + H2 CO + H2O.
4 b
2 c
0,8755 d
0
-2
-4
-6
-8
810
500 1000 1500 2000 2500 sC
Fig. 1.12. Variatia cu temperatura a logaritmului constantei
de echilibru a reactiilor a, b, c si d.
Influenta presiunii.
Reactiile carbonului cu vaporii de apa au loc cu crestere de volum, deci sunt favorizate de scaderea presiunii in sistem. Dar si aici trebuie sa se tina seama de faptul ca CO2 coexista in sistem cu carbonul, deci intervine reactia Bell-Boudouard CO2 + C = 2CO (4) care este de asemenea favorizata de scaderea presiunii. De aceea pentru reactia (11) scaderea presiunii determina imbogatirea fazei gazoase in H2 si CO si nu in H2 si CO2. Deci scaderea presiunii in sistem au acelasi efect ca si cresterea temperaturii.
Varianta sistemului si compozitia fazei gazoase de echilibru.
Varianta
sistemului pentru cele doua reactii (10) si (11) este: ![]() .
.
Deci pentru determinarea compozitiei fazei gazoase de echilibru trebuie sa se cunoasca trei parametrii din cinci (T, P si presiunea partiala a uneia din faze). Celelalte doua presiuni partiale se determina din calcul.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| PROIECT DE DIPLOMA CHIMIE INDUSTRIALA SI INGINERIA MEDIULUI - TEHNOLOGIA ACIDULUI GLUTAMIC |
| ARMA CHIMICA |
| Sulfati |
| Oligozaharide |
| MOLECULA |
| Termochimia |
| ENZIME |
| SPECTROMETRIA RADIATIILOR GAMMA |
| Termeni si conditii |
| Contact |
| Creeaza si tu |