
AL D
Primul principiu al termodinamicii, ca expresie a legii conservarii si transformarii energiei, arata numai posibilitatea transformarii reciproce a diverselor forme de energie. De asemenea primul principiu trateaza transformarile reversibile (ex. de la A la B si de la B la A) cu echivalenta de energie (dar cu semn schimbat), fara a preciza si a stabili daca aceasta evolutie este posibila sau nu. Mai mult principiul I al termodinamicii trateaza in acelasi mod transformarea de energie mecanica in caldura si invers, desi intre aceste doua transformari este o deosebire esentiala: energia mecanica se poate transforma integral in caldura prin frecare, fara conditii speciale; energia calorica insa, nu se poate transforma niciodata integral in lucru mecanic, reclamand si anumite conditii de efectuare.
Toate aceste elemente au dus la formularea principiului al II-lea al termodinamicii, care stabileste particularitatile de transformare a caldurii, cu caracter calitativ. El nu vizeaza cantitatile de energie din cadrul procesului, ci numai sensul transformarilor si explica principiul general al "naturii", dupa care transformarile spontane de energie se realizeaza de la potential mai ridicat spre potential mai scazut (diferenta de potential: termic, hidraulic, electric, etc.).
Principiul al doilea al termodinamicii are multiple formulari, pentru a putea acoperi cat mai bine multiplele aspecte calitative ale proceselor termice. O prima formulare este cea exprimata de Sadi Carnot care arata ca: Nu exista o masina termica, care sa produca cicluri termodinamice fara existenta a doua surse de caldura, de potentiale termice diferite (sursa calda si sursa rece).
Natura a dovedit trecerea de la sine a caldurii de la un corp mai cald spre un corp mai rece, fenomenul nefiind reversibil; trecerea caldurii in sens invers impune un consum suplimentar de lucru mecanic. Aceasta constatare i-a permis lui Clausius (1850) sa sa exprime al doilea principiu sub forma: Caldura nu se transfera de la sine niciodata de la un corp mai rece la altul cu o temperatura mai ridicata. Altfel spus este imposibil a realiza un proces ciclic prin care sa se produca transformarea caldurii in lucru mecanic fara existenta a doua surse de temperaturi diferite, sau nu se poate realiza un proces motor cu un singur izvor de caldura.
In concordanta cu cele de mai sus Lord Kelvin (W. Thomson 1851) a enuntat al doilea principiu sub forma: In natura, transformarile ciclice al caror efect consta in producerea de lucru mecanic echivalent cu cantitatea de caldura preluata de la o singura sursa, sunt imposibile. O astfel de masina care ar produce lucru mecanic prin absorbtie de caldura de la un singur izvor, producand numai racirea acestuia, constituie un perpetuum mobile de speta a II-a. Un astfel de perpetuum mobile ar fi o masina care ar transforma integral energia dezordonata a mediului ambiant intr-o energie ordonata, mediul ambiant jucand rolul unei surse de caldura infinit de mari. Altfel spus aceasta formulare arata ca ideea de a utiliza imensele cantitati de caldura gratuite avute la dispozitie : solara, acumulata in apa marilor, oceanelor etc., fara a exista o a doua sursa este lipsita de sens.
O alta enuntare plecand de la observatii experimentale este: Transformarea lucrului mecanic in caldura prin frecare este ireversibila, sau dupa cum afirma Max Planck: Toate procesele naturale sunt ireversibile.
Toate aceste formulari duc la concluzia ca lucrul mecanic, ca energie ordonata, poate fi trasformat integral in energie interna sau in alta forma de energie, pe cand energia interna se poate transforma numai partial in lucru mecanic sau alta forma de energie, introducand astfel notiunea de randament termic, definit ca raport dintre lucrul mecanic produs si cantitatea de caldura consumata din exterior pentru producerea lui.
Avand in vedere toate aceste elemente termodinamice apare notiunea de pierderi energetice ireversibile pe care Clausius le-a cuantificat prin notiunea de entropie.
Dupa cum am vazut anterior, randamentul termic al unui ciclu Carnot este dat de relatiile:
![]()
de unde, tinand cont de conventia de semne pentru caldurile primite si cedate, rezulta:
![]()
Sa presupunem un proces care se desfasoara dupa un ciclu reversibil oarecare, ciclu pe care il putem considera format dintr-un numar infinit de cicluri Carnot (fig. 1.19).
Tinand cont de relatia anterioara, dedusa pentru un ciclu Carnot si aplicand-o fiecarui ciclu Carnot elementar ce compune ciclul oarecare, putem scrie:
![]()
Insumand aceste relatii pentru toate ciclurile Carnot elementare rezulta:
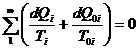
sau
![]()
|
|
Fig. 1.19 - Descompunerea unui ciclu oarecare in cicluri Carnot |
Expresia ![]() se numeste integrala
lui Clausius, iar
se numeste integrala
lui Clausius, iar ![]() a fost
denumita de catre acesta entropie:
a fost
denumita de catre acesta entropie:
![]()
In cazul ciclurilor ireversibile ![]() ; ca
urmare, putem scrie in general:
; ca
urmare, putem scrie in general:
![]()
de unde rezulta ca entropia este o masura a ireversibilitatii ciclurilor termodinamce.
Entropia S este o marime de stare, se masoara in J/K; prin conventie, la 00C si 760 mm Hg entropia se considera a fi nula.
Trebuie remarcat faptul ca entropia, desi este o marime fizica reala, nu are o semnificatie fizica palpabila asa cum au temperatura, presiunea etc. Entropia este o marime statistica; pentru un sistem izolat entropia este proportionala cu logaritmul natural al probabilitatii termodinamice a starii date a sistemului (relatia lui Boltzman):
![]()
unde k este
Pentru un kilogram de gaz perfect, variatia entropiei specifice este:
![]()
In acelasi timp, conform primului principiu al termodinamicii putem scrie:
![]()
Din cele doua relatii rezulta:
![]()
Din ecuatia termica de stare rezulta, prin prelucrari corespunzatoare:
![]()
Avand in vedere ca
![]() , rezulta in
cele din urma:
, rezulta in
cele din urma:
![]() sau
sau ![]() ,
,
de unde putem obtine variatia entropiei, prin integrarea relatiilor respective.
Prin particularizarea relatiilor de mai sus se pot obtine expresiile variatiei de entropie pentru transformarile simple ale gazului perfect, dupa cum se va arata in continuare.
Diagramele dinamice (presiune - volum) nu permit determinarea directa a cantitatilor de caldura ce intervin in transformare; in acest scop se folosesc diagramele entropice, trasate in coordonatele temperatura - entropie (T - s, fig. 1.20). Suprafata delimitata de curba caracteristica transformarii si axa absciselor este proportionala cu cantitatea de caldura schimbata pe parcursul transformarii. In cazul reprezentarii unui ciclu in diagrama entropica, aria suprafetei delimitate de catre ciclu este egala cu diferenta dintre cantitatea de caldura primita si cantitatea de caldura cedata (lucrul mecanic produs sau consumat).
|
|
Fig. 1.20 - Reprezentarea unui proces in diagrama entropica T - s |
2.1. Procesul izocor
In cazul unei transformari izocore, dv = 0; presupunand ca cv nu se modifica odata cu temperatura, variatia de entropie devine:

Reprezentarea procesului izocor in diagrama entropica T - s este prezentata in fig. 1.21.
|
|
|
|
Fig. 1.21 - Transformarea izocora in diagrama entropica |
Fig. 1.22 - Transformarea izobara in diagrama entropica |
2.2. Procesul izobar
Procesul izobar este
caracterizat prin dp = 0; presupunand
ca cp are valoare
![]()
Fig. 1.22 prezinta transformarea izobara in diagrama entropica; pozitiile relative ale izocorei si izobarei sunt prezentate in fig. 1.23.
|
Fig. 1.23 - Pozitiile izocorei si izobarei |
Fig. 1.24 - Ciclul Carnot in diagrama entropica |
2.3. Procesul izoterm
Intr-un proces izoterm dT = 0 si variatia de entropie devine:
![]()
In diagrama T - s transformarea izoterma este reprezentata printr-o paralela cu axa absciselor.
2.4. Procesul adiabatic
Intr-o transformare adiabatica dq = 0 si rezulta deci ds = 0. In diagrama entropica, procesul adiabatic este reprezentat printr-o paralela cu axa ordonatelor.
2.5. Ciclul Carnot
Reprezentarea ciclului Carnot in diagrama T - s este prezentata in fig. 1.24. Cele doua linii verticale corespund transformarilor adiabatice, iar liniile orizontale reprezinta transformarile izoterme.
Pentru ciclul Carnot invers cantitatile de caldura schimbate se determina cu relatiile:
![]()
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |