Ecuatia de stare van der Waals este,
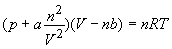 . (3.10)
. (3.10)
De remarcat ca ecuatia de stare van der Waals difera de ecuatia gazului ideal prin doi parametrii ajustabili, a si b. Acesti parametrii sunt introdusi pentru a corecta omisiunea datorata dimensiunilor particulelor gazului, respective moleculele precum si a interactiunilor datorata fortelor atractiva dintre acestea. Parametrul b este corectia privind dimensiunile particulelor, in timp ce parametrul a corecteaza aportul fortelor atractive dintre molecule.
Argumentarea ar suna cam asa: daca admitem ca numarul de molecule a unui sistem corespunde numarului lui Avogadro, adica avem un mol de substanta, acesta ocupa un volum de b litrii. Atunci oricare din molecule, luate individual va avea la dispozitie intregul volum V pentru miscare. Spatiul avut la dispozitie de oricare dintre molecule va fi deci intregul volum minus volumul ocupat de molecule, nb. Astfel volumul "efectiv" Veff este constituit din diferenta V - nb. Presiunea efectiva peff, este o notiune putin mai ascunsa. Daca consideram acum si atractia dintre molecule, moleculele de la extremitatea containerului (aflate aproape de peretii containerului) sunt atrase de cele din interiorul lui. Numarul acestor molecule este proportional cu n/V dar si numarul moleculelor interioare este de asemenea proportional cu n/V . Numarul perechilor de molecule care interactionaza una cu cealalta va fi deci proportional cu n /V astfel incat fortele de atractie a moleculelor din margine fata de moleculele din centru va fi si el proportional cu n /V . Aceste forte duc la o contributie suplimentara la presiunea pe care gazul o exercita si care la randul ei va fi proportionala cu n /V Aceasta va defini constanta de proportionalitate a astfel incat presiunea efectiva are expresia,
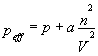 .
.
Este usor acum de ghicit ca un gaz se va supune ecuatiei gazului ideal doar daca vom utiliza pentru presiune si volum valorile efective ale acestora. Adica,
![]() . (3.11)
. (3.11)
Daca acum introducem expresiile noastre referitoare la presiunea si volumul efectiv, rezulta:
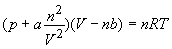 (3.12)
(3.12)
care este ecuatia de stare van der Waals.
Constantele van der Waals, a si b, pentru diferite gaze se obtin experimental sau prin expresii teoretice minutios elaborate. Exista evident numeroase astfel de culegeri de valori in diferite carti
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |