Am vazut ca rezultatul expansiunii Joule (valabila pentru un gaz ideal) a demonstrat experimental ca pentru un gaz ideal
![]() (1)
(1)
Ar fi acum avantajos de a calcula aceasta cantitate din ecuatia de stare sau alte date privind produsul pVT. Exista o ecuatie, care va fi demonstrata ulterior care va fi introdusa acum datorita utilitatii ei si care se va definii drept "ecuatia de stare termodinamica" care ne va permite astfel de determinari. Ea ne va permite sa calcula derivata ecuatiei (1) prin expresia unei ecuatii de stare. Aceasta ecuatie este:
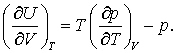 (2)
(2)
Aceasta ecuatie poate fi usor dovedita daca este deja enuntata a doua lege a termodinamicii. Deocamdata o vom accepta ca atare inainte de a fi dovedita. De remarcat ca in partea dreapta nu avem decat date pVT . Putem verifica credibilitatea acestei reactii daca valoarea ei pentru gazul ideal este zero.
Pentru gazul ideal avem:
![]()
astfel incat
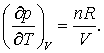
atunci,
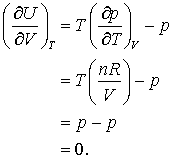
Putem verifica de asemenea care va fi ecuatia de stare termodinamica pentru cazul unui gaz van der Waals. Pentru un gaz care corespunde ecuatiei de stare van der Waals avem,
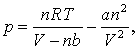
astfel incat
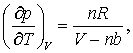
si
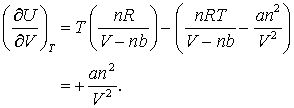
Stim ca a este foarte mic precum si ca n2/V 2 va fi o valoare mica cu exceptia cazului cand se lucreaza la presiuni foarte mari (densitati mari!) (rezultatul anterior poate fi interpretat in baza a ceea ce se intampla gazului! Atunci cand acesta expandeaza la temperatura constanta el va absorbi caldura de al vecinatati producand lucrul asupra acestora. Daca un gaz se comporta precum un gaz ideal atunci lucrul si caldura se egalizeaza astfel incat nu exista modificari ale energiei interne a gazului. In cazul gazelor care asculta de ecuatia van der Waals - si a gazelor reale - expansiunea trebuie sa depaseasca fortele intermoleculare astfel incat o parte a calduri absorbite de la vecinatati fac posibila depasirea acestor forte contrare. Termenul a in ecuatia de stare van der Waals reprezinta tocmai contributia acestor termeni ai interactiunilor intermoleculare. Daca vom calcula lucrul depus la expansiunea unui gas van der Waals vom observa ca o parte din lucru, cea proportionala cu a este o valoare pozitiva astfel incat lucrul efectuat asupra sistemului duce la ridicarea temperaturii acestuia - consecinta este ridicarea energiei interne a sistemului!)
In majoritatea cazurilor:
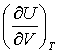
reprezinta o valoare infima, chiar si in cazul unui gaz van der Waals.
Aceasta reprezinta o componenta a ecuatiei (2),
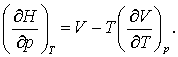 (3)
(3)
Aceasta ecuatie poate fi derivata (fara interventia celei dea doua legi a termodinamicii!! Din ecuatia 2 astfel incat daca ecuatia 2. este adevarata atunci si expresia ecuatiei (3) trebuie sa fie adevarate!!
Vom lasa cititorului placerea de a observa daca valoarea ecuatiei 3 este zero sau nu pentru un gaz ideal. Aplicand acesta gazului van der Waals nu vom ajunge la rezultate concludente desi ecuatia devine mai laborioasa.
Cp si CV sunt legate una de cealalta iar diferenta dintre ele poate fi calculata prin intermediul ecuatiei de stare. Dorim sa dovedim ca
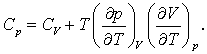 (8 d)
(8 d)
Sa pornim prin a defini Cp si H,
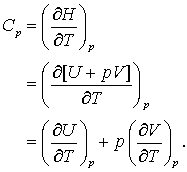 (4 a, b, c)
(4 a, b, c)
Al doilea termen din ecuatia (4 c) pare o forma acceptabila, dar primul termen nu pare de loc acceptabil in aceasta forma. (Variabila slaba poate fi pastrata constanta) Daca reconsideram primul termen prin prisma lui U ca si U = U(T,V), atunci,
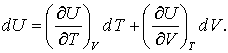 (5)
(5)
Impartim acum ecuatia (5) la dT si mentinem p constanta si obtinem:
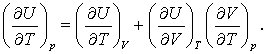 (6)
(6)
Putem substitui acum in ecuatia (6) termenul potrivit din ecuatia (4 c) pentru a obtine,
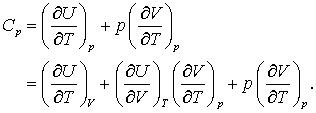 (7 a, b)
(7 a, b)
dar,
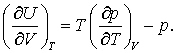 (2)
(2)
Substituind ecuatia (2) in expresia (∂U/∂T)V din ecuatia (7 b) rezulta:
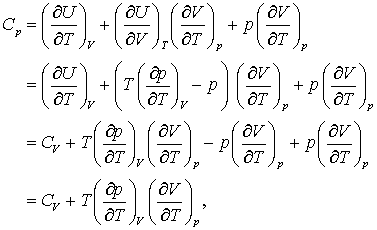 (8 a, b, c, d)
(8 a, b, c, d)
care de fapt este rezultatul dorit. Vom lasa iarasi la latitudinea cititorului, utilizand relatia sirului Euler si definitiile pentru α si κ , de a observa ca aceasta relatie se poate rescrie ca:
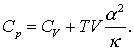 (9)
(9)
Al doilea termen din dreapta ecuatiei (9) trebuie neaparat sa fie pozitiva deoarece κ are intotdeauna pozitiv. α poate avea valoare negativa (pentru apa la aproape de 0oC), dar va aparea ca valoare la patrat. Astfel Cp > CV. Pentru solide si lichide al doilea termen din dreapta ecuatiei (9) este de obicei mica. Pentru gaze aceasta valoare poate fi mare. Pentru un gaz ideal am vazut anterior ca α = 1/T si κ = 1/p astfel incat
![]()
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |