
GAZUL PERFECT
Desfasurarea unui proces termodinamic presupune prezenta unui mediu material numit agent termic sau agent de lucru, mediu care de multe ori este reprezentat de un gaz.
In scopul simplificarii analizei termodinamice, se introduce notiunea de gaz perfect. Gazul perfect reprezinta un model teoretic de care gazele din natura, denumite gaze reale, se apropie cu atat mai mult, cu cat sunt mai rarefiate, respectiv, cu cat presiunea lor este mai coborita si temperatura mai ridicata. Gazul perfect este definit prin urmatoarele conditii:
- moleculele gazului sunt sferice si uniform repartizate, iar volumul lor propriu (covolumul) este neglijabil in raport cu volumul total ocupat de gaz;
- moleculele se afla intr-o permanenta miscare dezordonata, caracterizata de ciocniri perfect elastice, si de absenta fortelor de interactiune dintre ele; ca urmare, energia interna a gazelor perfecte este reprezentata doar de energia cinetica a particulelor constituente.
Chiar daca modelul gazului perfect nu se regaseste riguros in natura, in anumite conditii gazele reale se supun legilor gazului perfect. In consecinta, concluziile obtinute din studiul gazului perfect pot fi extinse asupra gazelor reale. Gaze tehnice precum hidrogenul, oxigenul, azotul, bioxidul de carbon, aerul, in domenii de presiuni si temperaturi specifice functionarii masinilor si instalatiilor termice (departate de domeniul de lichefiere) au o comportare foarte apropiata de cea a gazului perfect. Se utilizeaza nu numai termenul de gaz perfect, pentru modelul teoretic, ci si denumirea de gaze perfecte, pentru mediile naturale reale, aflate in conditii adecvate.
Legea Boyle - Mariotte
In decursul unui proces izoterm 1 - 2 (desfasurat la T = const), produsul dintre presiunea si volumul gazului ramane constant, adica
|
|
2. Legea Gay - Lussac
In decursul unui proces izobar 1 - 2 (desfasurat la p = const), volumul gazului variaza direct proportional cu temperatura sa absoluta, adica
|
|
3. Legea lui Charles
In decursul unui proces izocor 1 - 2 (desfasurat la V = const), presiunea gazului variaza direct proportional cu temperatura sa absoluta, adica
|
|
4. Legea lui Avogadro
Volume egale din diferite gaze perfecte, la aceeasi temperatura si presiune, contin acelasi numar de molecule.
Pe baza acestei legi, s-a stabilit o unitate de masura noua pentru cantitatea de substanta, numita kilomol. Un kilomol reprezinta cantitatea de gaz care, exprimata in kilograme, este numeric egala cu masa moleculara, M, a gazului respectiv, adica 1 [ kmol ] = M [ kg ] .
Se reaminteste ca masa moleculara a unui gaz reprezinta o marime adimensionala care arata de cate ori masa unei molecule din gazul respectiv este mai mare decat a douasprezecea parte din masa moleculei izotopului de C12 . De exemplu,
|
|
Se mentioneaza ca, in cazul unui gaz cu mai multi atomi in molecula, masa moleculara este suma maselor atomice ale atomilor componenti.
O consecinta importanta a legii lui Avogadro poate fi enuntata in felul urmator: volumul ocupat de un kilomol de gaz perfect, respectiv volumul molar, in conditii de temperatura si presiune identice, este acelasi indiferent de natura gazului.
In conditii de stare fizica normala (p0 = 760 mm Hg , T0 = 273.15 K) volumul molar este VM = 22,414 [ m3N / kmol ] .
Conform legii lui Avogadro, rezulta ca, in
orice conditii de temperatura si presiune, 1 kmol de gaz perfect
contine acelasi numar de molecule, numit numarul lui
Avogadro, NA , care este ![]() molecule / kmol .
molecule / kmol .
Ecuatia termica de stare a gazului perfect
Ecuatia termica de stare exprima legatura dintre parametrii de stare ai gazului perfect. Pentru deducerea ei, se considera o succesiune de doua transformari, o izoterma si o izobara, ce se desfasoara intre doua stari de echilibru, starea initiala 1, caracterizata de parametrii p1 , v1 , T1 , si starea finala 2, in care parametrii sunt p2 , v2 , T2 . Cantitatea de gaz care evolueaza este de 1 kg. In parcurgerea proceselor se atinge o stare intermediara i, caracterizata de p2 , vi , T1 , conform schemei din fig. 3.1.
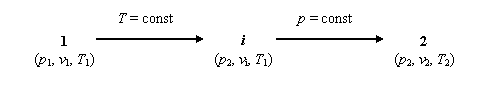
Fig. 3.1. Schema evolutiei pentru deducerea ecuatiei termice de stare
Conform legilor Boyle - Mariotte si Gay - Lussac:
|
|
Se inmultesc membru cu membru cele doua relatii si rezulta:
|
|
Deoarece nu s-a facut nici o ipoteza cu privire la alegerea starilor 1 si 2, atunci, indiferent care ar fi starea gazului, este valabila relatia
|
|
in care, constanta notata cu R reprezinta constanta caracteristica a gazului, a carei valoare depinde de natura acestuia. Se obtine astfel
|
|
expresie ce reprezinta ecuatia termica de stare a gazelor perfecte, valabila pentru o masa de 1 kg.
Pentru m kg, ecuatia de stare devine
|
|
Daca se exprima cantitatea de substanta in kilomoli, m = n M, unde n este numarul de kilomoli de gaz perfect, ecuatia termica de stare devine
|
|
ce reprezinta o alta forma a ecuatiei termice de stare, in care, A = M R = 8314 [J/ kmol K] este constanta universala a gazelor perfecte (independenta de natura gazului).
Pentru un kilomol (n = 1), ecuatia termica de stare este
|
|
Ecuatiile calorice de stare ale gazului perfect. Experienta lui Joule
Avand in vedere ca u si h sunt functii de stare de doi parametri oarecare, de exemplu, u = u (T, v) si h = h (T, p), din cele de mai sus, rezulta cele doua ecuatii calorice de stare pentru gazul perfect, precum urmeaza:
|
| |
|
|
(3.11) |
Prin experienta lui Joule, s-a demonstrat ca energia interna si entalpia gazului perfect depind doar de temperatura, de aceea derivatele partiale in raport cu volumul, repectiv presiunea sunt nule.
Prin integrare, se obtin variatiile energiei interne si entalpiei pentru un kilogram de substanta, in cazul unui proces oarecare 1 - 2 :
|
| |
|
|
Caldurile specifice ale gazelor perfecte
In general, prin caldura specifica a unei substante se intelege cantitatea de caldura necesara pentru a modifica cu un grad temperatura unitatii de cantitate din acea substanta, fara a-i schimba starea de agregare.
Pentru gaze, se folosesc urmatoarele tipuri de calduri specifice, in functie de modul cum sunt raportate, respectiv, la 1 kg, la 1 kmol sau la 1 m3N de gaz:
- caldura specifica masica, c [J/kgK];
- caldura specifica molara, C [J/kmol K];
- caldura specifica volumica, C' [J/m3NK] .
Cantitatea de caldura primita / cedata de gaz se poate calcula cu relatiile:
|
|
In ultima relatie, V0 este volumul gazului la starea fizica normala. Se observa ca
|
|
De aici, se obtin relatiile care exista intre caldurile specifice de diferite tipuri, si anume:
|
|
unde, VM = 22,414 [m3N / kmol] este volumul molar, iar M - masa molara [kmol/kg].
Caldura specifica depinde de natura gazului si de tipul procesului pe care il efectueaza. Astfel, se definesc: caldura specifica la volum constant sau caldura specifica izocora (cv , Cv , C'v) si caldura specifica la presiune constanta sau caldura specifica izobara (cp , Cp , C'p) . Corelatia dintre cele doua calduri specifice, denumita relatia Robert Mayer, se deduce pornind de la expresia entalpiei masice, h = u + pv, care, daca se are in vedere ecuatia termica de stare,
pv = RT, devine h = u + RT sau, sub forma diferentiala, dh = du + R dT. Pentru gaze perfecte, dh = cp dT si du = cv dT, astfel incat, din ultima expresie a entalpiei masice rezulta ca
|
|
Daca se multiplica ultima relatie cu masa molara M [kg/kmol] se obtine cea de-a doua relatie Robert Mayer, relatia pentru un kilomol de gaz:
|
|
Raportul dintre caldurile specifice izobare si izocore, notat cu k,
|
|
intervine in studiul proceselor adiabatice.
Aplicand ipoteze ale teoriei cinetico - moleculare au fost obtinute valori ale caldurilor specifice molare si ale exponentului adiabatic k, valori ce sunt folosite curent in calculele termotehnice.
- gaze monoatomice, Cv = ( 3 / 2 ) A Cp = ( 5 / 2 ) A k = 1,66 ;
- gaze biatomice, Cv = ( 5 / 2 ) A Cp = ( 7 / 2 ) A k = 1,4 ;
- gaze triatomice, Cv = ( 6 / 2 ) A Cp = ( 8 / 2 ) A k = 1,33 .
Valorile teoretice ale caldurilor specifice sunt riguros valabile doar pentru gazele monoatomice. Caldurile specifice ale gazelor biatomice sau poliatomice sunt sensibil dependente de temperatura, datorita sporirii gradelor de libertate ale moleculelor lor o data cu cresterea temperaturii (de aceea, caldura specifica a gazelor reale creste simultan cu cresterea temperaturii). Caldurile specifice adevarate se determina cu ajutorul unor ecuatii empirice (stabilite prin cercetari experimentale), adecvate fiecarui gaz si valabile pentru intervale de temperatura precizate. Cand intervalul de temperatura este mai ingust, dependenta caldurii specifice de temperatura este aproximativ liniara.
De regula, in calculele termotehnice (de exemplu, la determinarea variatiilor de entalpie sau de energie interna), se utilizeaza valorile medii ale caldurilor specifice,
![]() , valori care depind de natura gazului si de intervalul
de temperatura [T1, T2] in care se
desfasoara procesul termodinamic. Expresia caldurii
specifice medii se deduce astfel:
, valori care depind de natura gazului si de intervalul
de temperatura [T1, T2] in care se
desfasoara procesul termodinamic. Expresia caldurii
specifice medii se deduce astfel:
|
|
Se mentioneaza ca valorile caldurilor specifice medii, pentru diferite gaze, in intervalul de temperatura notat generic [0, t] oC, sunt prezentate si in tabele termotehnice. In cazul cand, din lipsa unei ecuatii adecvate, se utilizeaza asemenea tabele, caldura aferenta procesului care se desfasoara intr-un interval de temperatura oarecare [t1, t2] se calculeaza cu relatia:
|
|
Analiza termodinamica a proceselor simple
Procesele termodinamice simple sunt caracterizate prin aceea ca evolutia gazului din starea initiala in starea finala se produce dupa aceeasi lege de variatie a parametrilor de stare, precum si prin aceea ca o marime de stare sau de proces se mentine constanta pe intreg "parcursul" dintre cele doua stari.
In studiul termodinamic al masinilor si instalatiilor termice se considera ca procesele la care este supus agentul de lucru pot fi reprezentate de o succesiune de transformari simple, de tipul urmator:
- proces izocor, realizat la V = const;
- proces izobar, realizat la p = const;
- proces izotermic, realizat la T = const;
- proces adiabatic, fara schimb de caldura cu exteriorul (dQ
- proces politropic, care are caracterul cel mai general, in decursul careia variaza toti parametrii de stare, iar schimburile energetice se realizeaza atat sub forma de caldura, cat si de lucru mecanic.
Procesul politropic
Procesele reale de comprimare sau de destindere a gazelor in motoare sau compresoare nu sunt riguros adiabatice sau izoterme. In asemenea cazuri, evolutia de tip politropic reprezinta cea mai oportuna posibilitate de aproximare.
Ecuatia procesului politropic se obtine plecand de la principiul intai al termodinamicii pentru un sistem termodinamic inchis, procedand precum urmeaza:
|
|
si, dupa impartirea ultimelor relatii membru cu membru, rezulta ecuatia diferentiala a procesului politropic,
|
|
(3.21) |
unde
|
|
este exponentul politropic.
Notiunea de transformare politropica se bazeaza pe ipoteza n = const. Ca urmare, prin integrarea ecuatiei (3.46) rezulta succesiv, n ln v + ln p = const; ln ( pvn ) = const si, in final,
|
|
Ecuatia (3.48) este ecuatia caracteristica a procesului politropic, cu ajutorul careia se coreleaza parametrii de stare ai gazului in lungul unei transformari politropice. De fapt, exponentului n i se pot atribui valori in intervalul n I ) si, ca urmare, ecuatia politropei poate fi particularizata pentru orice proces de tipul celor simple enumerate mai sus.
Daca sistemul termodinamic este un gaz perfect, pe baza ecuatiei (3.48) si a ecuatiei termice de stare pentru gaze perfecte, se pot obtine alte doua forme ale ecuatiei politropei, precum urmeaza:
|
| |
|
|
Legatura dintre parametrii finali si initiali ai procesului politropic se obtine prin particularizarea ecuatiilor (3.23), . . . , (3.25) pentru cele doua stari:
|
|
Caldura specifica politropica, cn [J/kg K], rezulta din relatia (3.22), in care, se are in vedere raportul cp / cv = k (exponentul adiabatic) :
|
|
Energia transferata prin frontiera sistemului
- sub forma de caldura este
|
|
- sub forma de lucru mecanic (de variatie a volumului) este
|
|
sau, pentru intreaga cantitate de gaz,
|
|
Adesea, expresiile (3.26) si (3.27) se prelucreaza prin scoaterea in factor comun a produsului p1 v1 , respectiv, p1 V1 :
|
|
(3.26a) |
|
|
(3.27a) |
Variatia energiei interne si variatia entalpiei se calculeaza cu relatii independente de natura procesului. Astfel,
|
|
Particularizarea procesului politropic
Procesul politropic este procesul cel mai general, fiind caracterizat atat de variatia tuturor parametrilor de stare, cat si de transferurile de energie termica si mecanica prin frontiera sistemului. Astfel, prin particularizarea exponentului politropic, n, rezulta ecuatiile caracteristice si relatiile de calcul pentru toate celelalte transformari simple [(tabelul 3.2 si fig.
Tabelul 3.1. Ecuatiile si caracteristicile transformarilor simple
n Ecuatia Procesul c Du Dh q12 l12
0 p= ct izobar cp cv (T2 - T1) cp (T2 - T1) cp (T2 - T1) p1 ( v2 - v1 )
pv = ct izotermic 0 0 RT ln(v2 / v1) RT ln(v2 / v1)
k p v k = ct adiabatic 0 cv (T2 - T1) cp (T2 - T1) 0 (p1v1- p2v2)/(k-1)
v = ct izocor cv cv (T2 - T1) cp (T2 - T1) cv (T2 - T1) 0
![]()
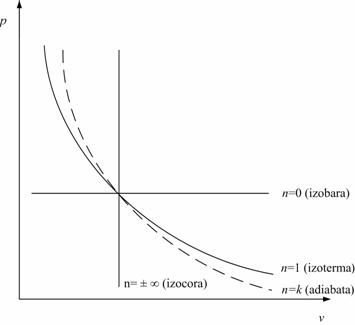
Fig. Reprezentarea transformarilor simple in diagrama p - v,
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |