
Orice substanta este un sistem de particule (atomi, ioni, molecule), care se poate gasi teoretic in una din cele trei stari fizice: gazoasa, lichida sau solida. Starea fizica este determinata de raportul dintre energia de coeziune si energia termica a particulelor constitutive.
Energia de coeziune Eo reprezinta aportul de energie necesar separarii substantei in particulele constitutive, respectiv vaporizarii. Ea este puternic dependenta de natura legaturii interatomice si se poate considera, intr-o prima aproximatie, independenta de temperatura.
Energia termica (cinetica) Et caracterizeaza agitatia termica a particulelor si este proportionala cu temperatura absoluta:
Et = k T (1)
unde k = 1,381· 10-23
JK-1 este
 Se
considera Tt
- temperatura de echilibru topire-solidificare si Tf - temperatura
de echilibru fierbere-condensare a unei substante pure. Starea fizica
stabila se modifica cu temperatura astfel (fig. 1):
Se
considera Tt
- temperatura de echilibru topire-solidificare si Tf - temperatura
de echilibru fierbere-condensare a unei substante pure. Starea fizica
stabila se modifica cu temperatura astfel (fig. 1):
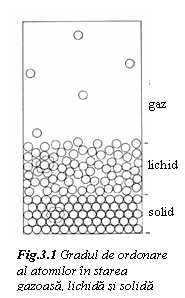
- T >Tf, Et >> Eo, agitatia termica a particulelor constitutive face ca interactiunea dintre ele sa fie instabila si neglijabila. Corespunde starii gazoase, la care dispunerea particulelor constitutive este dezordonata. La limita, in gazul perfect, interactiunile dintre particule sunt neglijabile si distanta de ordonare este nula. Proprietatile fizice (compresibilitatea, conductibilitatea termica, etc.) depind exclusiv de energia termica. Un exemplu de gaz perfect este neonul, la presiunea 1atm si temperatura ambianta.
- Tt < T < Tf, Et > Eo, interactiunea particulelor constitutive este partiala. Apare tendinta de organizare mai compacta, corespunzatoare starii lichide. Lichidul se caracterizeaza prin ordonarea particulelor pe scurta distanta, dupa un model variabil in timp. Distanta de ordonare variaza intre 3 si 10 raze atomice. Analiza difractometrica cu radiatii X a lichidului a aratat, ca acesta este un sistem eterogen, in care particulele constitutive se organizeaza sub forma de insule mai dense, separate de spatii vide. Aceste spatii vide pot atinge pana la 10% de masa. Mobilitatea lor este foarte mare, asemanatoare atomilor sau moleculelor din gaze, ceea ce determina curgerea lichidelor sub actiunea unor forte relativ reduse, proprietate caracterizata prin vascozitatea lichidului.
- T < Tt, Et < Eo, are loc dispunerea compacta a particulelor, legate prin forte de coeziune, specifica starii solide.
In stare solida substantele pot avea structura cristalina sau amorfa.
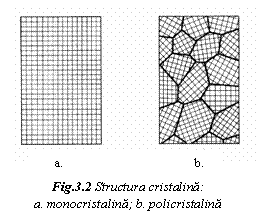
Materialele cristaline prezinta ordonarea regulata si periodica a particulelor pe lunga distanta. Ele exista sub forma monocristalina sau policristalina.
 In
cazul cristalului perfect sau ideal, distanta de ordonare este practic infinita (fig. 2a).
Un exemplu de cristal aproape perfect este monocristalul de siliciu folosit
pentru circuite integrate. Cristalul real pastreaza
asezarea ordonata si periodica a particulelor, dar este
afectat de o serie de defecte (capitolul 4). Gradul de perfectiune al
monocristalelor depinde de tehnici de solidificare foarte complexe.
In
cazul cristalului perfect sau ideal, distanta de ordonare este practic infinita (fig. 2a).
Un exemplu de cristal aproape perfect este monocristalul de siliciu folosit
pentru circuite integrate. Cristalul real pastreaza
asezarea ordonata si periodica a particulelor, dar este
afectat de o serie de defecte (capitolul 4). Gradul de perfectiune al
monocristalelor depinde de tehnici de solidificare foarte complexe.
Materialele curent folosite (metale, ceramice, anumiti polimeri) prezinta o structura policristalina (fig. 2b), alcatuita dintr-o multime de microcristale (graunti cristalini) legate prin zone mai putin ordonate, numite limite de graunte. Distanta de ordonare a particulelor depaseste 100 raze atomice.
O serie de sticle minerale, majoritatea polimerilor organici si unele aliaje metalice racite ultrarapid din faza lichida prezinta starea amorfa. Este o stare in afara de echilibru, care mentine in stare solida ordonarea particulelor pe scurta distanta specifica starii lichide.
Dintre grupele de materiale prezentate, metalele si ceramicele pot exista in toate cele trei stari (gazoasa, lichida sau solida). Polimerii organici au un comportament mai complex. Macromoleculele nu pot exista in stare gazoasa, deoarece energia termica necesara vaporizarii implica temperaturi atat de ridicate, incat se rup legaturile covalente dintre atomii lantului molecular.
Materialele metalice au tendinta mare de cristalizare. Comparativ cu metalele, polimerii organici cristalizeaza cu dificultate. Aceasta dificultate creste cu complexitatea lantului molecular. De aceea, in stare solida, polimerii organici exista sub forma semicristalina sau complet amorfa. Din punct de vedere al tendintei la cristalizare, materialele ceramice se plaseaza intre metale si polimerii organici. Se
intalnesc atat materiale ceramice cristaline, cum sunt diferiti oxizi (MgO), cat si materiale cu structura amorfa, cum sunt sticlele minerale.
Se exemplifica dificultatile de obtinere a monocristalelor prin tehnologia de obtinere a monocristalului de siliciu, un material de o deosebita importanta in microelectronica, la fabricarea circuitelor integrate folosite la calculatoare, instalatii audio de mare fidelitate, robotica, automatizari.

 Din punct de vedere al resurselor, siliciul
este al doilea element din scoarta terestra, unde se
gaseste sub forma de oxizi sau silicati.
Siliciul tehnic pur se obtine prin reducerea in cuptor
electric a dioxidului de siliciu (SiO2) cu carbon sau carbura
de calciu (CaC2). Din siliciu tehnic pur se produce tetraclorura de
siliciu (SiCl4), care se reduce in mediu de hidrogen la siliciu de
inalta puritate. Urmeaza un proces de purificare zonara pentru
obtinerea siliciului ultrapur (99,99999%).
Din punct de vedere al resurselor, siliciul
este al doilea element din scoarta terestra, unde se
gaseste sub forma de oxizi sau silicati.
Siliciul tehnic pur se obtine prin reducerea in cuptor
electric a dioxidului de siliciu (SiO2) cu carbon sau carbura
de calciu (CaC2). Din siliciu tehnic pur se produce tetraclorura de
siliciu (SiCl4), care se reduce in mediu de hidrogen la siliciu de
inalta puritate. Urmeaza un proces de purificare zonara pentru
obtinerea siliciului ultrapur (99,99999%).
Pentru obtinerea proprietatilor semiconductoare, in siliciul ultrapur se adauga o mica cantitate de impuritati, cca 10 ppm (10-5) atomi de fosfor sau aluminiu.
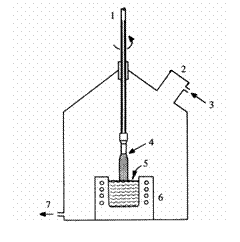
Una din metodele de obtinere a monocristalului de siliciu este metoda Czochralski (fig. 3). O cantitate de siliciu ultrapur se topeste intr-un creuzet de cuart, incalzit cu rezistenta electrica, intr-o atmosfera reducatoare sau de gaz inert. La 1420˚C, cand baia topita este stabilizata, un germene monocristalin fixat la capatul unei tije de extractie vine in contact cu suprafata baii. Germenele este apoi extras lent in sus, conducand la obtinerea unui cristal cu aceeasi orientare a retelei cristaline ca si a germenelui. Pentru omogenizarea conditiilor de crestere, baia topita si tija sunt antrenate intr-o miscare in sens invers.
In anul 1952, tehnologia existenta permitea obtinerea unor monocristale de siliciu cu diametrul in jur de 20 mm. Astazi, diametrul lor atinge 150 pana la 200mm, cu lungimi de 1 pana la 2m.
Monocristale sunt apoi taiate transversal cu ferastraie diamantate pentru obtinerea de plachete circulare de 1mm grosime. Dupa polizarea si lustruirea oglinda a unei suprafete plane, se graveaza circuitele integrate prin microlitografie cu radiatie laser.
Starea cristalina este caracterizata prin dispunerea ordonata pe lunga distanta a particulelor constitutive in structuri cristaline specifice.
Cristalul (0,1m.. 0,1mm) este un agregat de atomi, ioni sau molecule, cu aranjamentul spatial periodic, conform legilor simetriei.
Cristalografia este disciplina care studiaza arhitectura cristalelor, respectiv repartitia particulelor in spatiu si legile geometrice care le fixeaza pozitia.
Pentru descrierea structurii cristaline se folosesc doua concepte fundamentale: reteaua spatiala si motivul.
Reteaua spatiala este
un ansamblu infinit de puncte (noduri), obtinut prin translatia in
spatiu a trei vectori necoplanari ![]() ,
,![]() ,
,![]() , care determina directiile de translatie
si distanta intre puncte.
, care determina directiile de translatie
si distanta intre puncte.
Motivul reprezinta baza materiala, care se asociaza fiecarui punct al retelei. Motivul poate fi o particula (atom, ion, molecula) sau o grupare de particule cu orientare si geometrie determinate.
Structura cristalina este determinata concomitent de motiv si reteaua spatiala. Daca reteaua este o fictiune geometrica, structura cristalina este o realitate fizica.
Elementele geometrice ale retelei cristaline sunt (fig. 4):
- punctul sau nodul de retea, definit prin vectorul de pozitie al punctului fata de un sistem de referinta;
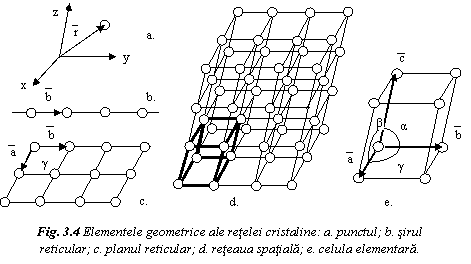 -
sirul reticular sau directia
reticulara, definit de doua puncte ale retelei. Se
caracterizeaza prin vectorul de translatie
-
sirul reticular sau directia
reticulara, definit de doua puncte ale retelei. Se
caracterizeaza prin vectorul de translatie ![]() , care determina directia si distanta
dintre puncte. Marimea b, egala cu modulul vectorului de
translatie este numita parametru liniar sau
, care determina directia si distanta
dintre puncte. Marimea b, egala cu modulul vectorului de
translatie este numita parametru liniar sau
- planul reticular
este definit de trei puncte ale retelei. Se caracterizeaza prin
vectorii de translatie![]() ,
, ![]() , care dau parametrii liniari a si b si pe cel
unghiular ;
, care dau parametrii liniari a si b si pe cel
unghiular ;
- celula
elementara este cel mai mic poliedru, care translat in spatiu
dupa trei directii necoplanare, reproduce reteaua
spatiala. Se caracterizeaza prin vectorii de translatie ![]() ,
,![]() ,
,![]() , care determina parametrii liniari a, b, c si pe
cei unghiulari , ,
.
, care determina parametrii liniari a, b, c si pe
cei unghiulari , ,
.
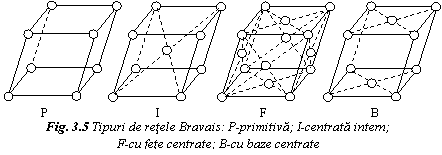
Celula elementara trebuie sa fie reprezentativa pentru elementele de simetrie ale retelei. Celula elementara poate sa fie simpla, atunci cand contine noduri la colturile celulei, sau multipla, daca contine noduri si in interior sau pe fetele celulei. In functie de tipul celulei elemntare, retelele cristaline pot fi de patru tipuri (fig. 5):
3
Tabel 1 Sisteme cristalografice si retele Bravais
|
Nr. sistem |
Sistem cristalografic |
Relatii intre parametrii sistemului |
Nr. retea Bravais |
Retea Bravais |
|
1. |
Cubic |
a = b = c = = = 90o |
1. 2. |
P I F |
|
2. |
Tetragonal |
a = b c = = = 90o |
4. 5. |
P I |
|
Ortorombic |
a b c = = = 90o |
6. 7. 8. 9. |
P I F B |
|
|
4. |
Romboedric |
a = b = c = = 90o |
10. |
P |
|
5. |
Hexagonal |
a = b c = = 90o ; = 120o |
11. |
P |
|
6. |
Monoclinic |
a b c = γ = 90oβ |
12. 1 |
P B |
|
7. |
Triclinic |
a b c 90o |
14. |
P |
primitiva (P) sau simpla, cu puncte la colturile celulei elementare; centrata intern sau cu volum centrat (I), avand puncte la colturi si un punct care centreaza volumul celulei; cu fete centrate (F), avand puncte la colturi si puncte care centreaza fiecare fata a celulei; cu baze centrate (B), avand puncte la colturi si puncte care centreaza bazele celulei.
Exista 14 moduri de repartizare periodica si compacta de puncte in spatiu. Acestea constituie cele 14 retele spatiale Bravais, repartizate in 7 sisteme cristalografice, care difera intre ele prin relatiile dintre parametri si prin elementele de simetrie. In tabelul 1 se prezinta sistemele cristalografice si retelele Bravais.
Aranjamentul atomic se pune in evidenta prin interactiunea materialului cu radiatii cu o lungime de unda apropiata sau inferioara distantei dintre atomi, cum sunt: radiatia X (λ = 0,1nm), fasciculele de electroni cu energie inalta (λ = 0,001nm) sau de neutroni termici (λ = 0,1nm).
Prin microscopie electronica, aranjamentul atomic se reconstitue prin analiza radiatiei refractate la trecerea prin straturi subtiri. Radiatia X si fasciculele de neutroni patrund in profunzimea materialului. In acest caz se sintetizeaza imaginea cristalului prin metode de analiza matematica a unor diagrame de difractie (difractograme). Cea mai utilizata metoda pentru localizarea atomilor este difractia cu radiatie X. Difractia cu neutroni lenti este o metoda complementara, cu echipament experimental mai complex. In timp ce difractia cu radiatii X permite pozitionarea atomilor grei, difractia cu neutroni pozitioneaza atomii usori sau diferentiaza atomii de mase apropiate.
 In
cele ce urmeaza se prezinta principiul difractiei cu radiatii
X. Radiatiile
X sunt radiatii electromagnetice, care la interactiunea cu o
particula cu sarcina electrica, cum este electronul, ii induc o
deplasare periodica. Particula devine centrul unei unde sferice care se
propaga in toate directiile in spatiu. Daca radiatia
intalneste un atom, electronii care il inconjoara intra in oscilatie,
astfel incat atomul devine centrul unei unde sferice, de intensitate
proportionala cu numarul de electroni. Fiecare atom din cristal
devine centrul unei unde sferice. Aceste unde interfereaza constructiv
dupa anumite directii in spatiu daca sunt in faza
(intensitatea undei se mareste) sau distructiv dupa alte
directii (intensitatea undei se anuleza).
In
cele ce urmeaza se prezinta principiul difractiei cu radiatii
X. Radiatiile
X sunt radiatii electromagnetice, care la interactiunea cu o
particula cu sarcina electrica, cum este electronul, ii induc o
deplasare periodica. Particula devine centrul unei unde sferice care se
propaga in toate directiile in spatiu. Daca radiatia
intalneste un atom, electronii care il inconjoara intra in oscilatie,
astfel incat atomul devine centrul unei unde sferice, de intensitate
proportionala cu numarul de electroni. Fiecare atom din cristal
devine centrul unei unde sferice. Aceste unde interfereaza constructiv
dupa anumite directii in spatiu daca sunt in faza
(intensitatea undei se mareste) sau distructiv dupa alte
directii (intensitatea undei se anuleza).
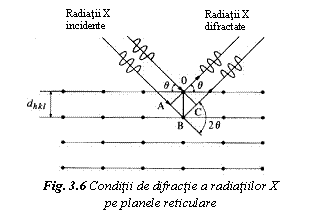
Daca radiatia intalneste un plan reticular dintr-un cristal, o mica parte din intensitate este absorbita, iar restul este reflectat de planul de atomi. Radiatia reflectata de ansamblul de plane paralele este receptionata de catre un detector, numai dupa anumite directii. Daca radiatiile X cad sub unghiul de incidenta θ (fig. 6) si distanta dintre doua plane reticulare este dhkl, diferenta de drum ABC dintre radiatiile reflectate de cele doua plane este 2 dhkl sin θ. Pentru ca radiatia reflectata sa aiba intensitate maxima, aceasta diferenta trebuie sa fie un multiplu n al lungimii de unda λ incidente, conform legii lui Bragg:
n λ = 2 dhkl sin θ (2)
In aceasta relatie θ este unghiul de difractie, dependent de distanta dhkl dintre plane. Distanta dintre plane se poate calcula in functie de parametrii reticulari si indicii Miller ai familiei de plane considerate.
De aceea, pentru a determina structura cristalina prin difractie cu radiatii X, se analizeaza succesiv pe difractograma pozitia picurilor de difractie (unghiurile de difractie), ca si intensitatea difractata (marimea picurilor). Unghiul de difractie se coreleaza cu geometria si marimea celulei elementare, iar intensitatea difractiei cu structura atomica.
Proprietatile fizico-mecanice ale cristalelor sunt vectoriale. Marimea lor depinde de directia de masurare, ceea ce impune indicarea unor plane si directii reticulare.
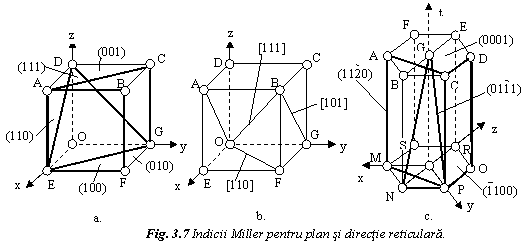
Planul reticular se simbolizeaza prin indicii Miller (h k l) intre paranteze rotunde pentru structurile din sistemul cubic, respectiv prin indicii Miller-Bravais (h k i l) pentru sistemul hexagonal, unde i = - (h+k).
Indicii Miller reprezinta cele mai mici numere intregi proportionale cu valorile inverse ale taieturilor planului fata de un sistem de referinta, exprimate in unitati axiale.
 La
retelele din sistemul cubic celula elementara se raporteaza la
un sistem de trei axe rectangulare (fig. 7a). Se exemplifica calculul
indicilor Miller pentru planul cubului (ABCD):
La
retelele din sistemul cubic celula elementara se raporteaza la
un sistem de trei axe rectangulare (fig. 7a). Se exemplifica calculul
indicilor Miller pentru planul cubului (ABCD):
axe: ox oy oz
taieturi: 1
valori inverse: 1/ 1/ 1/1
indicii Miller: 0 0 1
Planul cubului (ABCD) se simbolizeaza (001). In mod similar, planul dodecaedrului rombic (ACGE) se indica (110), iar planul octaedrului (DGE) - (111).
In cazul sistemului hexagonal (fig. 7c), celula elementara se raporteaza la un sistem de 4 axe, dintre care 3 axe sunt in planul bazei si formeaza intre ele un unghi de 120s, iar a patra axa este perpendiculara pe ele.
Astfel, planul bazal (ABCDEF) se noteaza (0001),
planul prismatic (DCPQ) cu (![]() 100), planul diagonal (ACPM) cu (11
100), planul diagonal (ACPM) cu (11![]() 0), iar planul piramidal (GNP) cu (01
0), iar planul piramidal (GNP) cu (01![]() 1). Bara de deasupra indicelui arata ca planul
intersecteaza axa in domeniul negativ.
1). Bara de deasupra indicelui arata ca planul
intersecteaza axa in domeniul negativ.
Planele paralele se indica prin aceiasi indici Miller.
O familie de plane cuprinde toate planele cu aceeasi
densitate de puncte. Familia de plane se simbolizeaza prin
indicii Miller ai unuia din planele familiei intre acolade si contine
toate planele care au aceiasi indici, cu valori negative sau pozitive,
permutati. Exemplu: familia planelor cubului se indica 100} si cuprinde planele:
(100), (010), (001), (![]() 00), (0
00), (0![]() 0), (00
0), (00![]() ).
).
Directia reticulara se noteaza prin indicii [u v w] intre paranteze drepte la structurile din sistemul cubic, respectiv prin [u v j w], unde j = - (u+v) la sistemul hexagonal. Pentru aceasta se transleaza directia in origine, dupa care indicii directiei se determina ca cele mai mici numere intregi proportionale cu coordonatele unui punct al directiei, exprimate in unitati axiale.
De exemplu, la sistemul cubic (fig. 7b), diagonala BG a
fetei cubului se transleaza in pozitia OA si se
noteaza prin coordonatele punctului A: [101]. Diagonala OB a volumului
cubului se noteaza prin coordonatele punctului B: [111]. Se observa
ca indicii unei directii coincid cu cei ai planului perpendicular pe
directie. Astfel, planul (DEG) si directia ![]() 0].
0].
O familie de directii cu aceeasi densitate de puncte se noteaza prin indicii uneia dintre directii intre paranteze frante. Astfel, familia diagonalelor volumului cubului este notata <111>.
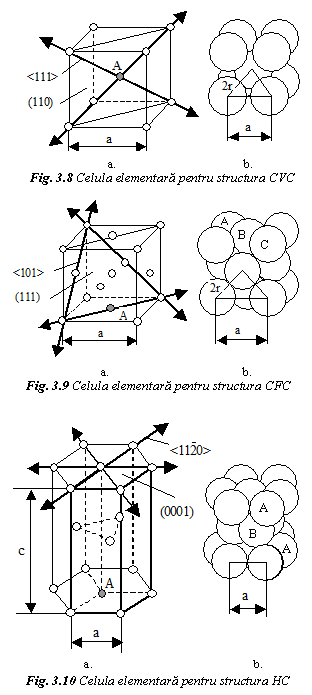
Legatura metalica este puternica si neorientata si ca urmare cristalele metalice adopta un aranjament atomic compact. Majoritatea metalelor cristalizeaza in sistemele cu simetrie multipla, cubic si hexagonal, in cadrul a trei structuri cristaline: cubica cu volum centrat (CVC), cubica cu fete centrate (CFC) si hexagonal compacta (HC)
Structura cristalina a metalelor se
evidentiaza prin asocierea unui atom fiecǎrui punct al
retelei cristaline. In fig. 8a este prezentata celula elementara
pentru structura CVC, un cub care contine 8 atomi la colturi si
un atom care centreaza volumul. Se caracterizeaza prin
CFC (fig. 9a) contine 8 atomi la colturi si 6 atomi care centreaza fetele cubului.
 Pentru
a fi reprezentativǎ, celula cristalina pentru structura HC (fig. 10a)
este alcǎtuitǎ din asocierea a trei celule elementare. Rezultǎ o
prisma hexagonala dreapta, care contine 12 atomi la
colturi, 2 atomi care centreaza bazele si 3 atomi care centreaza
volumul celor 3 prisme rombice, care alcatuiesc prisma hexagonala.
Gradul de tetragonalitate teoretic este c/a = 1,633, dar la metale variaza
intre 1,57 la Be si 1,86 la Zn.
Pentru
a fi reprezentativǎ, celula cristalina pentru structura HC (fig. 10a)
este alcǎtuitǎ din asocierea a trei celule elementare. Rezultǎ o
prisma hexagonala dreapta, care contine 12 atomi la
colturi, 2 atomi care centreaza bazele si 3 atomi care centreaza
volumul celor 3 prisme rombice, care alcatuiesc prisma hexagonala.
Gradul de tetragonalitate teoretic este c/a = 1,633, dar la metale variaza
intre 1,57 la Be si 1,86 la Zn.
a. Indicatori de compactitate
Compactitatea structurii cristaline se apreciaza prin numarul de coordinatie si gradul de compactitate.
Numarul de coordinatie, C, reprezinta numarul de atomi aflati la distanta minima si egala de un atom considerat central.
Se analizeaza vecinii unui atom A. La structura CVC, atomul A central este inconjurat de cei 8 atomi de colt. Ccvc=8. In cazul structurii CFC, atomul A centreaza baza cubului. El se gaseste la aceeasi distanta de cei 4 atomi din colturile bazei, si de alti 8 atomi care centreaza fetele adiacente bazei, 4 din celula considerata si 4 din celula inferioara. Rezulta CCFC=12. La structura HC, atomul bazal A este inconjurat de 6 atomi din colturile bazei si de cei 6 atomi, care centreaza volumul celulelor adiacente bazei, 3 atomi de la celula considerata si alti 3 atomi care centreaza volumul celulei inferioare. CHC=12.
Gradul de compactitate, , este dat de raportul dintre volumul atomilor ce apartin celulei si volumul celulei, conform relatiei:
= N·Va/Vcel (3)
unde N-numarul de atomi ce apartine volumului celulei; Va-volumul atomului; Vcel-volumul celulei.
Numarul de atomi, N, ce apartine celulei se calculeaza tinand cont ca atomii de la colturile cubului apartin concomitent la 8 celule, atomii de la colturile prismei hexagonale la 6 celule, atomii care centreaza fetele la 2 celule, iar cei care centreaza volumul apartin in totalitate celulei. Ca urmare, numarul N se calculeaza cu relatiile:
NCVC, CFC = NC/8 + NF/2 + NI (4a)
NHC = NC/6 + NF/2 + NI (4b)
unde NC-numarul de atomilor de colt; NF - numarul atomilor care centreaza fetele si NI - numarul atomilor interni. Rezulta: NCVC = 2 atomi; NCFC = 4 atomi; NHC = 6 atomi/3 celule= 2 atomi/celula.
Daca se considera atomul o sfera de raza r, volumul atomului este:
Va = 4r3/3 (5)
In figurile 8b, 9b, 10b se prezinta celulele cristaline, cu dispunerea compacta a atomilor dupa modelul sferelor rigide in contact. Sferele sunt tangente dupa directiile de compactitate atomica maxima. Dupa aceste directii, distanta interatomica este egala cu 2r. La structura CVC directiile de compactitate atomica maxima corespund diagonalelor volumului cubului, la CFC dupa diagonalele fetelor cubului, iar la HC dupa latura hexagonului. Rezulta: rCVC = a 3/4; rCFC = a 2/4; rHC = a/2.
Volumul celulei se exprima in raport de constantele reticulare:
VcelCVC,CFC = a3; (6a)
Vcel HC = 33 a2c/2 (6b)
Inlocuind valorile in relatia (3), rezulta: CVC = 0,68 si CFC, HC = 0,74.
Ambii indicatori de compactitate arata ca structurile CFC si HC sunt cu aranjamentul atomic cel mai compact. In figurile 9b si 10b se observa ca impachetarea planelor de densitate maxima are loc in succesiunea ABCABC.la structura CFC si ABAB. la HC.
b. Marimea interstitiilor
Gradul de compactitate evidentiaza ca 32% din volumul celulei CVC, respectiv 26% din volumul celulei CFC sau HC este neocupat de atomi, formand interstitii, in care se pot plasa atomii elementelor de aliere sau atomii de impuritati. Interstitiile pot fi de doua tipuri: tetraedrice sau octaedrice.
Interstitiile tetraedrice sunt delimitate de 4 atomi ale caror centre sunt plasate la varfurile unui tetraedru (fig. 11a).
Interstitiile octaedrice sunt delimitate de 6 atomi, ale caror centre formeaza un octaedru (fig. 11b). La CVC au raza maxima (0,126a) interstitiile tetraedrice delimitate de atomul central si 3 atomi de colt invecinati. La CFC, au raze maxime (0,146a) interstitiile octaedrice plasate in centrul celulei si la mijlocul muchiilor. Structura HC are acelasi tip de interstitii ca si structura CFC. Rezulta ca structurile CFC si HC au o capacitate mai mare de a dizolva interstitial atomi straini.
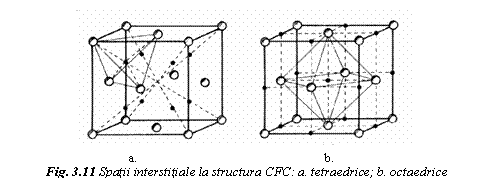
c. Sistemele de alunecare
O serie de proprietati fizico-mecanice sunt dependente de aranjamentul atomic. Astfel, deformabilitatea plastica a metalelor are la baza posibilitatile de alunecare in cristale sub eforturi mici. Alunecarea are loc de-a lungul unor plane, iar in cadrul planului dupa o directie de alunecare. Planul si directia de alunecare formeaza un sistem de alunecare. Planele si directiile preferentiale de alunecare sunt cele de densitate atomica maxima. Planele cele mai compacte sunt cele mai distantate, cu legatura interplanara cea mai redusa, ceea ce favorizeaza declansarea alunecarii sub eforturi mici. Capacitatea de deformare plastica a metalelor este data de numarul sistemelor de alunecare si de compactitatea planelor de alunecare.
Structura CVC (fig. 8a) contine 6 plane de cea mai mare compactitate atomica, care apartin familiei planelor dodecaedrului rombic . In fiecare plan sunt cate 2 directii de compactitate atomica maxima corespunzatoare familiei diagonalelor volumului cubului <111>. Rezulta 12 sisteme principale de alunecare.
Planele de alunecare nu sunt de compactitate atomica maxima (nu toti atomii sunt reciproc tangenti), astfel incat rezistenta la alunecare este relativ mare. Pot fi activate sisteme secundare de alunecare dupa planele , de compactitate apropiata, pastrand aceeasi directie de alunecare <111>, ajungandu-se pana la 48 sisteme de alunecare.
Deoarece au multiple posibilitati de alunecare dar sub eforturi relativ mari, metalele cu structura CVC au o rezistenta inalta si o plasticitate moderata. Prezinta structura CVC 16 metale: Fe, Cr, Mo, W, V, Nb, Ta, Li, Na, K, Ba etc.
La structura CFC (fig. 9a) sunt 4 plane de compactitate atomica maxima din familia planelor octaedrului , cu cate 3 directii de alunecare corespunzatoare familiei diagonalelor fetelor cubului <110>. Rezulta 12 sisteme de alunecare.
Avand un numar mare de sisteme de alunecare sub eforturi reduse, metalele care cristalizeaza in structura CFC prezinta rezistenta redusa si plasticitate maxima. Structura CFC este caracteristica pentru cele mai plastice 18 metale: Cu, Ag, Au, Al, Pb, Ni, Pd, Pt, Fe etc.
La structura HC (fig. 10a) exista un
singur plan de compactitate atomica maxima - planul bazal (0001), cu
cate 3 directii de alunecare din familia <11![]() 0>, corespunzatoare diagonalelor hexagonului.
Rezulta 3 sisteme de alunecare. Pentru metalele cu grad de tetragonalitate
c/a >1,633 pot apare alunecari si dupa alte plane.
0>, corespunzatoare diagonalelor hexagonului.
Rezulta 3 sisteme de alunecare. Pentru metalele cu grad de tetragonalitate
c/a >1,633 pot apare alunecari si dupa alte plane.
Avand un numar mic de sisteme de alunecare sub eforturi reduse, metalele care cristalizeaza in structura HC prezinta rezistenta si plasticitate scazute. Structura HC este specifica pentru 25 metale: Be, Mg, Zn, Cd, Co, Ni, Ti, Zr, Hf, Sc, La etc.
d. Raza atomica
Trebuie precizat ca la metale raza atomica reprezinta raza ionica, a carei marime se pǎstreaza si in aliaje. Raza ionului se modifica la schimbarea numarului de coordinatie si a tipului de legatura chimica. Astfel, la modificarea numarului de coordinatie de la 12 la 8, raza ionului scade cu 3%. De asemenea, raza ionului din cristalele metalice este superioara celei din cristalele ionice. In tabelul 2 se prezinta raza atomica pentru o serie de metale.
Tabel 2 Structura cristalina si raza atomica pentru o serie de metale
|
Metal |
Structura cristalina |
Raza atomica[nm] |
Metal |
Structura cristalina |
Raza atomica[nm] |
|
Aluminiu |
CFC |
Molibden |
CVC | ||
|
Argint |
CFC |
Nichel |
CFC | ||
|
Aur |
CFC |
Platina |
CFC | ||
|
Cadmiu |
HC |
Plumb |
CFC | ||
|
Crom |
CVC |
Tantal |
CVC | ||
|
Cobalt α |
HC |
Titan α |
HC | ||
|
Cupru |
CFC |
Wolfram |
CVC | ||
|
Fier α |
CVC |
Zinc |
HC |
Cunoasterea caracteristicelor structurii cristaline permite calculul densitatii ρ a metalului cu relatia:
ρ = N·A/(Vcel·NA (7)
unde: N-numarul de atomi ce apartin celulei; A-masa atomica; Vcel-volumul celulei; NA-numarul lui Avogadro (6,023 x 1023 atomi/mol). Avand in vedere ca volumul celulei se poate exprima in functie de raza atomica, exista posibilitatea ca aceasta sa se determine prin calcul, daca se cunoaste densitatea.
Legatura ionica este specifica compusilor ceramici. Ca si legatura metalica este puternica si neorientata. Cristalele sunt alcatuite din ioni de semn opus, care adopta un aranjament atomic compact, ce favorizeaza cresterea interactiunii ionilor de semn opus si reducerea interactiunii celor de acelasi semn.
Factorii care determina structura cristalina adoptata sunt:
valenta ionilor, care din
conditia de neutralitate electrica a cristalului, determina
formula generala a compusului:,![]() etc;
etc;
marimea relativa a ionilor, care determina modul de impachetare a ionilor si numarul de coordinatie.
Se exemplifica prin cristalele de tip AX, alcatuite din ioni de aceeasi valenta. In acest caz, motivul este format dintr-un cation si un anion. Structura cristalina, care se formeaza, depinde de raportul dintre raza cationului, rc, si raza anionului, ra, (fig. 12):
rc / ra > 0,73, cea mai stabila este structura de tip CsCl. Aceasta are numarul de coordinatie 8, fiecare ion de Cs+ fiind inconjurat de 8 ioni de Cl. Celula elementara se poate deduce din structurile specifice metalelor, daca volumul celulei cubice simple a ionilor de Cl- se centreaza cu un ion Cs+.
0,41 < rc / ra < 0,73, se adopta structura de tip NaCl, cu numar de coordinatie 6. Celula elementara se obtine daca, in structura CFC a ionilor de Cl-, se centreaza spatiile octaedrice cu ioni de Na+. Aceasta structura este specifica pentru MgO, FeO, MnS.
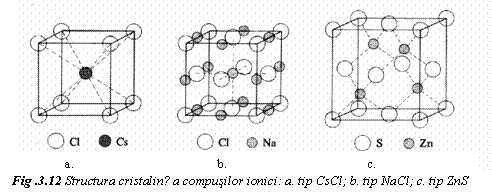
 0,23
< rc / ra < 0,41, se adopta structura
de tip ZnS, cu numar de coordinatie 4. Celula rezulta
din structura CFC a ionilor S2-, la care o jumatate din
spatiile tetraedice sunt ocupate de ionii de Zn2+. Un
spatiu tetraedric este delimitat de un atom de colt si cei 3
atomi care centreaza fetele invecinate coltului. In aceasta
structura cristalizeaza BeO si SiC.
0,23
< rc / ra < 0,41, se adopta structura
de tip ZnS, cu numar de coordinatie 4. Celula rezulta
din structura CFC a ionilor S2-, la care o jumatate din
spatiile tetraedice sunt ocupate de ionii de Zn2+. Un
spatiu tetraedric este delimitat de un atom de colt si cei 3
atomi care centreaza fetele invecinate coltului. In aceasta
structura cristalizeaza BeO si SiC.
Legatura covalenta este puternica si orientata. Structura cristalina este determinata in primul rand de geometria orbitalilor si in secundar de modul de impachetare al atomilor. De aceea cristale cu legatura covalenta au o compactitate mai redusa, sunt usoare si cu rezistenta mecanica inalta.
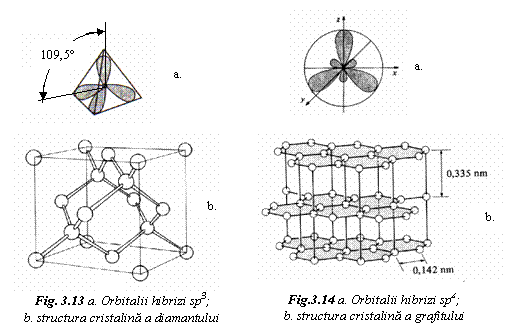
Exemplul tipic il reprezinta cele doua forme alotropice ale carbonului, diamantul si grafitul, incluse in grupa materialelor ceramice. Carbonul este un element tetravalent, cu numarul de ordine in tabelul periodic Z = 6 si configuratia electronica 1s22s22p2.
La formarea cristalului de diamant orbitalii atomici hibridizeaza sp Cei 4 orbitali moleculari sunt orientati dupa varfurile unui tetraedru si formeaza intre ei un unghi de 109,5˚ (fig. 13a). Structura cristalina a diamantului este cubica complexa si rezulta din aranjamentul regulat al tetraedrelor de carbon legati prin legaturi covalente. Celula elementara se obtine din structura CFC, la care jumatate din spatiile tetraedrice sunt ocupate tot de atomi de carbon (fig. 13b).
Diamantul este un cristal usor, cu densitatea ρ = 3,52g/cm3 si izolator electric. Legatura rigida dintre atomi ii confera duritate mare (HV=10.000daN/mm2), transparenta. Si temperatura de topire inalta (3350sC).
In cazul grafitului, orbitalii atomici hibridizeaza sp2. Cei trei orbitali moleculari sunt coplanari si formeaza intre ei un unghi de 120˚ (fig. 14a). Structura cristalina a grafitului este hexagonala stratificata (fig. 14b). Contine plane in care atomii de carbon, legati prin legaturi covalente, sunt dispusi la varfurile unor hexagoane regulate. Orbitalii atomici 2p, care nu participa la legatura covalenta, se combina intre ei pentru a forma orbitali polinucleari. In planul bazal, legatura interatomica este puternica, deoarece atomii se leaga intre ei atat prin legaturile covalente cat si prin legatura creata de electronii polinucleari. Legatura interplanara este slaba si se realizeaza prin interactiunea electronilor polinucleari din plane vecine.
 Distanta
interplanara relativ mare face ca grafitul sa prezinte o compactitate
atomica mai redusa, avand densitatea ρ = 2,25g/cm Anizotropia structurala
determina anizotropie de proprietati fizico-mecanice. Astfel,
grafitul are rezistenta mecanica inalta, similara
diamantului, in lungul planelor bazale si de 30 de ori mai redusa,
perpendicular pe acestea. Cristalul cliveazǎ usor dupa planele
bazale, ceea ce determinǎ proprietatile lubrifiante ale
grafitului. Prezenta orbitalilor polinucleari in
Distanta
interplanara relativ mare face ca grafitul sa prezinte o compactitate
atomica mai redusa, avand densitatea ρ = 2,25g/cm Anizotropia structurala
determina anizotropie de proprietati fizico-mecanice. Astfel,
grafitul are rezistenta mecanica inalta, similara
diamantului, in lungul planelor bazale si de 30 de ori mai redusa,
perpendicular pe acestea. Cristalul cliveazǎ usor dupa planele
bazale, ceea ce determinǎ proprietatile lubrifiante ale
grafitului. Prezenta orbitalilor polinucleari in
planele hexagonale determina o conductivitate electrica ridicata paralel cu aceste plane si de 100 pana la 1000 de ori mai redusa dupa directia perpendiculara pe ele. Electronii mobili determina opacitatea grafitului.
 Proprietatile remarcabile ale
grafitului in lungul planelor bazale au contribuit la realizarea fibrelor
de carbon. Acestea sunt structuri grafitice preponderent orientate cu
planele bazale in lungul fibrei (fig. 15). Fibrele de carbon sunt materiale de
inalta rezistenta mecanica si termica,
conducatoare de electricitate, care se folosesc ca elemente de armare in
materialele compozite si pentru transportul energiei electrice.
Proprietatile remarcabile ale
grafitului in lungul planelor bazale au contribuit la realizarea fibrelor
de carbon. Acestea sunt structuri grafitice preponderent orientate cu
planele bazale in lungul fibrei (fig. 15). Fibrele de carbon sunt materiale de
inalta rezistenta mecanica si termica,
conducatoare de electricitate, care se folosesc ca elemente de armare in
materialele compozite si pentru transportul energiei electrice.
Comparatia efectuata intre diamant si grafit evidentiaza rolul determinant al naturii legaturilor interatomice asupra structurii si proprietatilor macroscopice.
Legatura covalenta favorizeaza formarea macromoleculelor, specifice polimerilor. Constructia polimerilor este posibila numai cu elemente cu valenta egala sau mai mare ca 2. La baza structurii polimerilor stau trei elemente: carbonul, siliciul (tetravalente) si oxigenul (bivalent). Carbonul si siliciul formeaza patru legaturi simple σ, orientate dupa varfurile unui tetraedru. Carbonul poate realiza in anumiti polimeri si legaturi duble σ si π.
Dupa natura elementelor care formeaza lantul molecular, polimerii pot fi: organici, organo-minerali si minerali. Dupa structura lantului, polimerii pot fi: liniari, ramificati, bi si tridimensionali.
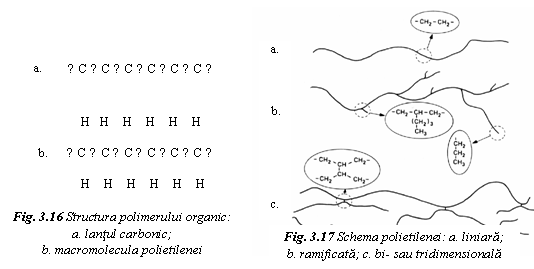
Polimerii organici au lantul molecular alcatuit din tetraedre ale atomilor de carbon legate covalent intre ele (fig. 16a). Fiecare atom din lant prezinta doua legaturi libere, iar atomii de capat trei legaturi libere. Daca pozitiile libere ale atomilor din lant se ocupa cu un element monovalent, ca de exemplu hidrogenul, se obtine un polimer liniar numit polietilena (fig. 16b si 17a).
Lantul molecular se caracterizeaza prin unitatea structurala (motiv), care prin repetare reface imagimea lantului molecular. In cazul polietilenei, unitatea structurala este - CH2 - CH2 - .
Daca una din pozitiile libere este ocupata de un atom de carbon, se poate produce o ramificatie a lantului molecular (fig. 17b). Daca intre lanturi apar legaturi punctuale covalente intre atomii de carbon, se obtin polimerii bi si tridimensionali (fig. 17c). Cand la limita toate legaturile libere sunt ocupate de atomi de carbon, se obtine structura tridimensionala a diamantului. Grafitul este un exemplu de polimer bidimensional. In aceste ultime doua cazuri, macromolecula are dimensiunile cristalului.
Polimerii liniari si ramificati au o legatura intermoleculara secundara slaba. De aceea au o rigiditate de 103 pana la 106 ori mai mica decat a diamantului. Sunt polimeri termoplastici, care prin incalzire trec in stare lichida si pot fi pusi in forma. Sunt solubili in solventi organici.
Polimerii bi- si tridimensionali au legatura intermoleculara covalenta puternica si de aceea sunt insolubili, nefuzibili, cu o rezistenta termica mai ridicata. Aceste proprietati recomanda polietilena tridimensionala ca izolator electric pentru liniile subterane de inalta tensiune.
 In cazul polimerilor care au mai
multe tipuri de atomi sau grupari de atomi catenari, lantul molecular
are diferite configuratii atomice pentru aceeasi compozitie
chimica. In polimer, pot exista izomeri: de pozitie, de
configuratie si geometrici.
In cazul polimerilor care au mai
multe tipuri de atomi sau grupari de atomi catenari, lantul molecular
are diferite configuratii atomice pentru aceeasi compozitie
chimica. In polimer, pot exista izomeri: de pozitie, de
configuratie si geometrici.
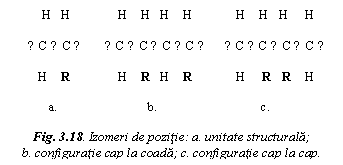
Izomerii de pozitie se
diferentiaza prin modul de asociere a unitatilor
structurale: configuratie cap la coada (cea mai frecventa) sau
cap la cap. In figura 18 s-a notat cu R gruparea atomica.
Izomerii de configuratie apar ca urmare a aranjamentului atomic diferentiat fata de axa lantului. Se disting trei tipuri de izomeri de configuratie (fig. 19):
izotactici, la care gruparile R sunt de aceasi parte a lantului;
sindiotactici, gruparile R alterneaza de o parte si de alta a lantului;
atactici, gruparile R se distribuie aleatoriu.
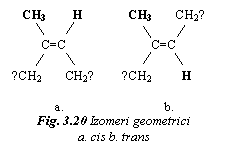

Izomerii
geometrici apar in cazul unitatilor structurale, care
contin legatura dubla a atomilor de carbon. Fiecare atom de
carbon din legatura dubla prezinta o singura
legatura libera cu un atom sau cu o grupare de atomi, care se
situeaza de aceeasi parte sau in opozitie fata de
lant.
Se exemplifica cu unitatea structurala a izoprenului (fig. 20). Daca atomul de H si gruparea CH3 sunt de aceeasi parte a lantului, se obtine o structura cis, respectiv cis-izoprenul sau cauciucul natural. Daca atomul de H si gruparea CH3 sunt in opozitie, se obtine o structura trans. Trans-izoprenul (numit si gutta perca, folosita ca izolator electric, in stomatologie sau pentru mingi de golf) are proprietati diferite de ale cauciucului natural.
Polimerii organo-minerali si minerali prezinta lantul polisiloxanic, alcatuit din tetraedre ale atomilor de siliciu, legate covalent intre ele prin atomi de oxigen (fig. 21a). Daca legaturile libere ale siliciului sunt ocupate cu grupari organice monovalente, cum este gruparea metil, se obtine un polimer organo-mineral. In figura 21b se prezinta macromolecula de polidimetilsiloxan, care este structura de baza a cauciucurilor siliconice, elastomeri cu rezistenta la temperaturi ridicate (350-400˚C).
Polimerii minerali se obtin daca legaturile libere ale lantului polisiloxanic sunt ocupate de cationi metalici (Na+, Mg2+, Al3+), care formeaza legaturi ionice prin intermediul oxigenului. Se exemplifica prin piroxen (fig. 21c), care este un silicat mineral. In structura acestor minerale sunt numai legaturi intermoleculare puternice, iono-covalente sau ionice, ceea ce determina o rigiditate superioara polimerilor organici, la care legatura intermoleculara este de tip van der Waals.
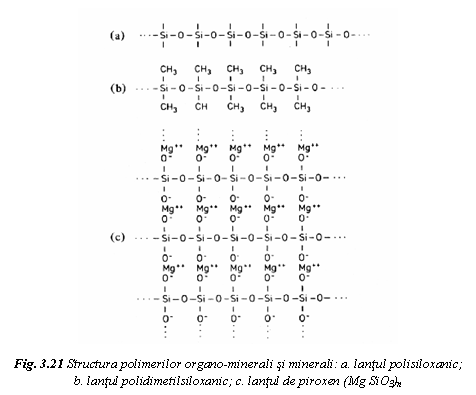 Daca
legaturile libere ale lantului sunt ocupate de grupari
siloxanice se obtine silicea tridimensionala cu formula globala
SiO2.
Daca
legaturile libere ale lantului sunt ocupate de grupari
siloxanice se obtine silicea tridimensionala cu formula globala
SiO2.
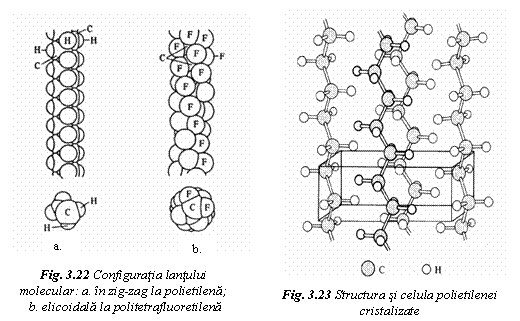
In cristal, lantul molecular adopta o configuratie spatiala, care corespunde energiei potentiale minime. Tipul de configuratie a lantului afecteaza modul de impachetare a lanturilor in celula cristalina. Configuratia lantului poate fi in zig-zag sau elicoidala.
a).
Configuratia in zig-zag are compactitatea maxima
si este specifica lantului de polietilena (fig. 22a).
Atomii catenari de hidrogen, avand o raza mica, sunt coplanari
si formeaza intre ei unghiuri de valenta de 109,5˚.
Atomii catenari sunt dispusi unii deasupra celorlalti si
spatiul dintre ei este suficient de mare (0,253nm, superior diametrului
atomului de hidrogen 0,234nm), pentru un aranjament relativ compact in
structura cristalina (fig. 23). In celula cristalinǎ se atinge un
grad ridicat de compactitate (φ = 0,8). Rezulta un punct de topire
relativ ridicat (130˚C), in conditiile absentei unei
legaturi intermoleculare puternice.
Daca se substitue atomii de hidrogen cu atomi de fluor, se obtine politetrafluoretilena (teflonul). Diametrul atomilor de fluor este mai mare decat spatiul dintre atomii de carbon. Se adopta o configuratie elicoidala (fig. 22b) atat in stare cristalina cat si lichida. In aceasta configuratie, compactitatea atomilor este mai redusa (φ = 0,66-0,78), dar rigiditatea si termostabilitatea sunt mai mari. Teflonul are temperatura de topire 330˚C si prezinta proprietati antiadezive.
Majoritatea polimerilor, care contin heteroatomi adopta configuratia in zig-zag. Izomerii izotactici, cum este polipropilena, adopta configuratia elicoidala a lantului molecular.
Trebuie precizat ca gradul de compactitate la polimerii organici s-a calculat pe baza razei van der Waals a atomilor, care marcheaza limita moleculelor in solidele moleculare, la care legatura covalenta face ca sferele atomice sa se intrepatrunda. Acest grad de compactitate nu poate fi comparat direct cu cel calculat la structurile metalice, in conditiile considerarii atomilor ca sfere rigide tangente.
Starea amorfa este adoptata de o serie de ceramice, polimeri organici care cristalizeaza cu dificultate si de unele aliaje metalice racite ultrarapid din faza lichida. Structura amorfa va avea, ca si lichidul din care provine, grupari de atomi sau molecule ordonate pe scurta distanta.
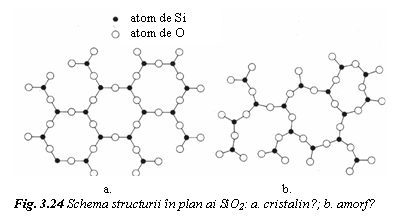
In figura 24 se prezinta prin comparatie structura cristalina si amorfa a compusului ceramic SiO2. In ambele stari, modulul structural il constitue tetraedrele SiO4-, care se leaga covalent prin ionul de oxigen. In structura amorfa legarea tetraedrelor este neregulata si intamplatoare.
La polimerii organici, vascozitatea ridicata in stare lichida si complexitatea structurii moleculare determina structuri amorfe sau semicristaline. In figura 25 se prezinta lantul molecular pentru polietilena amorfa. Segmentele de lant au suferit

rotatii, indoiri si rasuciri dezordonate, astfel incat
lantul are forma neregulata, iar capetele de lant se
gasesc la o distanta mult mai mica decat lungimea
lantului. Aceste indoiri si rasuciri dezordonate se
datoreaza faptului ca (fig. 26a), un atom de carbon se poate lega de
un alt atom din lant in orice pozitie a generatoarei conului de
revolutie, care subintinde un unghi de 109,5°. Lantul rezulta
rectiliniu in succesiunea atomilor din figura 26b sau sufera rasuciri
si indoiri in succesiunea atomilor din figura 26c.
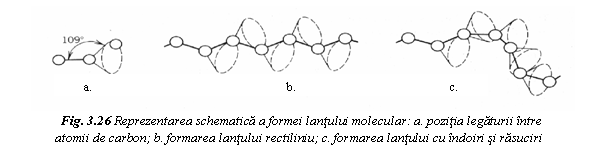 Structura
amorfa, care presupune lanturile moleculare distorsionate si
orientate intamplator, asigura a serie de proprietati, ca
de exemplu, capacitatea mare de extensie elastica a cauciucului.
Flexibilitatea de rotatie a segmentelor de lant determina
rezistenta polimerilor la vibratii mecanice sau termice. Aceasta
flexibilitate de rotatie este dependenta de structura lantului
molecular. Astfel, legaturile duble de carbon (C=C), complexitatea
moleculei si marirea grupului de atomi catenari determina
cresterea rigiditatii lantului.
Structura
amorfa, care presupune lanturile moleculare distorsionate si
orientate intamplator, asigura a serie de proprietati, ca
de exemplu, capacitatea mare de extensie elastica a cauciucului.
Flexibilitatea de rotatie a segmentelor de lant determina
rezistenta polimerilor la vibratii mecanice sau termice. Aceasta
flexibilitate de rotatie este dependenta de structura lantului
molecular. Astfel, legaturile duble de carbon (C=C), complexitatea
moleculei si marirea grupului de atomi catenari determina
cresterea rigiditatii lantului.
Pentru a descrie structura semicristalina a polimerilor, s-a acceptat de mai multi ani modelul, alcatuirii ei din cristale lamelare cu aranjament ordonat al lantului molecular, cufundate intr-o masa amorfa compusa din lanturi cu orientare intamplatoare.

Investigatii mai recente, prin microscopie electronica, asupra unor
monocristale crescute din solutii diluate au aratat ca aceste
cristale lamelare de grosimi 10-20nm si lungime 10μm au o
structura multistrat cu lanturile moleculare pliate ordonat si
compact (fig. 27). In cazul polimerilor, care cristalizeaza din topituri,
se formeaza o structura policristalina alcatuita din
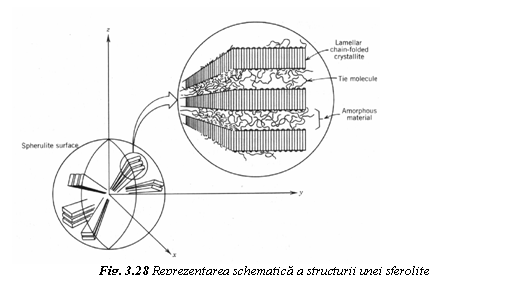
agregate semicristaline cu forma sferica numite sferolite. Sferolita
(fig. 28) este alcatuita din cristale lamelare cu lanturi
moleculare pliate, care se ramifica dintr-un germene initial. Cristalele
lamelare
 lanturi
moleculare pliate, care se ramifica dintr-un germene initial.
Cristalele lamelare
lanturi
moleculare pliate, care se ramifica dintr-un germene initial.
Cristalele lamelare
sunt separate de materialul amorf. Lanturi moleculare de legatura realizeaza conexiunea dintre lamele adiacente prin masa amorfa. Cu cat creste gradul de cristalinitate al structurii semicristaline, cu atat se maresc rigiditatea, rezistenta si termostabilitatea polimerului.
Polimorfismul este proprietatea unor substante de a-si modifica structura
cristalina la variatia temperaturii, presiunii sau concentratiei. De exemplu, compusii
ceramici SiC, Al2O3, ZrO prezintǎ polimorfism de
temperaturǎ. In cazul elementelor chimice se foloseste si
notiunea de alotropie, care poate fi de: temperatura, presiune sau
concentratie. Prezinta alotropie o serie de nemetale (C, N, O, Se,
S), metale din grupele principale (Li, Be, Ca, Sr, Tl, Sn,
Este cunoscuta alotropia de presiune a carbonului, care cristalizeaza sub forma de grafit la presiuni normale si sub forma de diamant la presiuni ridicate.
Cea mai intalnita este alotropia (polimorfismul) de temperatura. Starea elementului dintr-un anumit interval de temperatura, caracterizata prin aceeasi structura cristalina se numeste stare sau modificatie alotropica (polimorfa). Starile alotropice se noteaza prin simbolul chimic urmat de o litera din alfabetul grecesc, in ordine alfabetica, incepand cu starea alotropica de la temperatura cea mai scazuta. De exemplu, formele alotropice ale fierului se noteaza Fe, Fe, Fe. Intr-un interval de temperatura este stabila starea cu energie libera minima. La depasirea temperaturii de echilibru a starilor alotropice are loc izoterm transformarea alotropica in forma alotropica cu energie mai mica. Este o transformare in stare solida (un proces de recristalizare), bazata pe germinarea si cresterea grauntilor noii faze. Schimbarea structurii cristaline este insotita de modificarea unor proprietati fizico-mecanice. Ca urmare a modificarii compactitatii aranjamentului atomic, apar variatii ale volumului specific, care introduc tensiuni interne si maresc susceptibilitatea metalului la rupere fragila.
Reprezentativa este alotropia fierului. Fierul prezinta doua puncte de transformare alotropica la temperaturile 912C si 1394C. Sub temperatura de 912C este stabila forma alotropica Fe, care cristalizeaza in CVC. Intre 912C si 1394C este stabil Fe, care cristalizeazǎ in CFC. De la 1394C pana la 1538C - temperatura de topire a Fe, este stabila forma alotropica Fe, care cristalizeaza in CVC. La presiuni peste 150 kbari, se obtine starea alotropica Fe, care cristalizeaza intr-o structura hexagonala. Plasticitatea ridicata a Fe (CFC) sta la baza capacitatii de deformare plastica la cald a otelurilor. Transformarea alotropica Feα↔Feγ da posibilitatea modificarii structurii si proprietatilor aliajelor Fe-C prin tratamentele termice de recoacere, normalizare si calire.
Alotropia staniului este cunoscuta sub numele de 'ciuma staniului'. Staniul are doua forme alotropice: Snα cenusiu, stabil sub 13,2C, care cristalizeaza intr-o structura cubica tip diamant cu numarul de coordinatie C = 4 si Snβ alb, stabil peste 13,2C, care cristalizeaza intr-o structura tetragonala cu volum centrat, cu C = 6. Transformarea alotropica Snβ Snα are loc cu o variatie de volum specific de 25%. Apar astfel tensiuni interne care pulverizeaza Sn. Procesul este superficial, manifestandu-se prin aparitia de movilite pulverulente de Snα cenusiu pe suprafata Snβ alb, de unde si denumirea de " ciuma staniului".
Starea fizica a unei substante este data de raportul dintre energia de coeziune si energia termica. In stare solida, materialele pot adopta doua tipuri de structuri:
cristalina, caracterizata prin ordonarea pe lunga distanta a particulelor constitutive (atomi, ioni, molecule). Este specifica metalelor si unor ceramice. Datorita structurii mai complexe, polimerii adopta structuri semicristaline.
amorfa, caracterizata prin ordonarea particulelor pe scurta distanta, la fel ca lichidul din care provine. Este specifica polimerilor organici si ceramicelor.
Structura cristalina este descrisa de reteaua spatiala (o fictiune geometrica) si motiv (baza materiala asociata). Se caracterizeaza prin celula elementara - cel mai mic poliedru, care prin translatie reface imaginea retelei spatiale. Notarea planelor si directiilor in reteaua spatiala se face cu ajutorul indicilor Miller sau Miller-Bravais.
Structurile cristaline cele mai frecvent intalnite la metale sunt CFC, CVC, HC. Ele se caracterizeaza prin indicatorii de compactitate, marimea interstitiilor si sistemele de alunecare. Un sistem de alunecare este dat de un plan si o directie de alunecare in plan. Planele si directiile preferentiale de alunecare sunt de densitate atomica maxima. Plasticitatea unui metal creste cu numarul sistemelor de alunecare, iar rezistenta la deformare scade cu compactitatea planelor de alunecare. Plasticitatea este maxima la structurile CFC si CVC, cu numeroase sisteme de alunecare. Rezistenta la deformare este maxima la structura CVC. cu compactitate mai redusa.
Compusii ionici au structura determinata de valenta componentilor si raportul intre raza cationului si a anionului. Solidele cristaline cu legatura covalenta au structura data de geometria orbitalilor si modul de impachetare al atomilor.
Legatura covalenta permite realizarea de macromolecule. Pot fi polimeri organici (lantul molecular alcatuit din tetraedre de C), organo - minerali sau minerali (lantul molecular alcatuit din tetraedre de Si legate covalent prin intermediul O). Structura (liniara, ramificata bi- sau tridimensionala) si configuratia lantului molecular (in zig-zag sau elicoidala) influenteaza proprietatile polimerului.
Lantul molecular amorf are numeroase rasuciri, indoiri. In stare cristalina lantul molecular este pliat compact. Polimerii semicristalini obtinuti prin topire au o structura policristalina formata din sferolite. Sferolita este alcatuita din lamele cristaline dezvoltate radial dintr-un germene central, cufundate intr-o masa amorfa.
Polimorfismul (Alotropia) este proprietatea unei substante de a-si modifica structura cristalina la variatia temperaturii, presiunii sau concentratiei. Este o transformare in stare solida, insotita de modificarea de proprietati si variatii de volum.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |