
SUPRESORII TUMORALI
Spre deosebire de oncogene, la care datorita naturii dominante a activarii lor, este suficienta mutatia unei singure alele pentru a induce unele aspecte ale fenotipului neoplasmic, mutatiile la nivelul genelor supresorilor tumorali determina pierderea functiei. Exista doua consecinte importante ale acestor diferente:
Deoarece in majoritatea cazurilor, alelele normale ale supresorilor tumorali pot functiona in prezenta alelelor defecte, este necesar ca ambele copii sa fie inactivate inainte ca pierderea functiei sa se manifeste;
In contrast cu oncogenele a caror efecte dominante vor impiedica dezvoltarea embrionara, pierderea unei alele a unei gene supresor tumorale va fi silentioasa si va permite transmiterea in linia germinala a alelei defecte.
Transmiterea ereditara a genelor supresor tumorale mutante are efecte tragice, deoarece predispune la cancer membrii aceleiasi familii. Studiul unor asemenea indivizi permite insa identificarea genelor responsabile. Pana in prezent au fost identificate mai multe gene supresor tumorale, ale caror produsi proteici au rol important in diviziunea celulara, diferentierea celulara, apoptoza si repararea ADN.
Gena RB
Retinoblastomul este un cancer al copilariei, fiind cea mai comuna tumora a ochiului, responsabila pentru 1% dintre cauzele deceselor datorate cancerului infantil. Afecteaza 5 copii din 100.000.
Aproximativ 40% dintre aceste cancere sunt familiale, iar restul de 60% sunt sporadice. In forma ereditara retinoblastomul apare la nou-nascuti sau devreme dupa nastere, afecteaza ambele orbite si este reprezentat in medie de 3 tumori. Supravietuitorii sunt sensibili la alte tumori canceroase, ca de exemplu: osteosarcom, fibrosacom sau tumori Wilm. Spre deosebire de forma ereditara, retinoblastomul sporadic implica o singura tumora, care afecteaza o singura orbita si nu sunt predispusi la alte forme de cancer.
Knudson (1971) a emis "ipoteza celor doua lovituri" (two-hit-hypothesis) conform careia, forma ereditara a retinoblastomului apare cand o copie a genei implicate este inactivata in linia germinala si cealalta copie este inactivata prin mutatie in timpul dezvoltarii somatice. El a demonstrat ca rata cunoscuta a mutatiei in locusul RB, numarul de celule embrionare tinta (retinoblaste), penetranta formei ereditare si frecventa in populatie a formei sporadice sunt in concordanta cu aceasta ipoteza. Aparitia tumorilor multiple in cancerele ereditare se datoreaza probabilitatii ridicate ca mai mult de un retinoblast sa fie afectat de o a doua mutatie. Incidenta crescuta a altor tipuri de tumori reflecta rolul produsului genei RB in controlul proliferarii in alte tesuturi. Spre deosebire de forma ereditara, in forma sporadica tumorile multiple sunt rare deoarece este putin probabil ca mai mult de un retinoblast sa fie afectat de doua mutatii.
Modelul lui Knudson sustine ca atunci cand cea de a doua copie a genei RB este analizata, ea este in mod cert inactiva, iar inactivarea a avut loc prin mai multe mecanisme: mutatii punctiforme, deletii, non-disjunctii cromozomiale, crossing-over mitotic.
Aproximativ 5-10% din cazurile de retinoblastom ereditar prezinta o deletie partiala sau totala a benzii 13q14, ceea ce a permis localizarea genei RB in acesta regiune. Prin clonare pozitionala a fost izolata gena candidat RB si s-a determinat structura, secventa, modelul de exprimare al genei. Ulterior, s-a dovedit ca introducerea tipului salbatic in celulele tumorale a supresat dezvoltarea tumorii, inducand reversia proprietatilor canceroase ale celulelor tumorale cultivate.
Ipoteza lui Knudson a fost ulterior aplicata si la alte tipuri de cancere mostenite. Astfel:
in cancerul urogenital (tumorile Wilm) gena supresor tumorala WT1 este situata pe bratul scurt al cromozomului 11;
polipii adenomatosi sunt determinati de mutatii al genei APC situata pe bratul lung al cromozomului 5.
Proteina RB
Gena RB a fost clonata si s-a descoperit ca ea codifica o proteina nucleara (proteina RB) de 105kD, care interactioneaza cu o familie de factori de transcriptie si controleaza intrarea in ciclul celular.
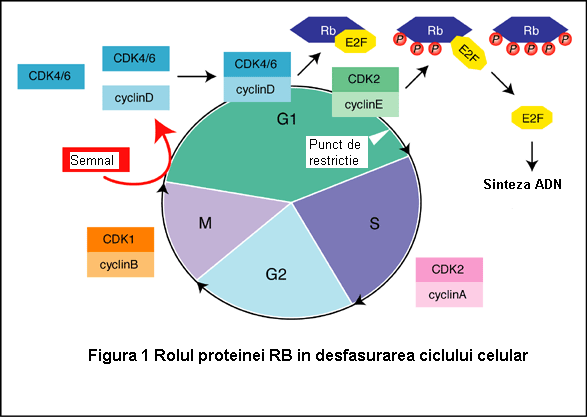
In faza G1timpurie, proteina RB nu este fosforilata si este asociata cu factorul de transcriptie E2F. Complexul RB/E2F mentine histonele in forma non-acetilata si restrictioneaza accesul la factorii de transcriptie. E2F nu se poate lega de enhancerul genelor tinta si, ca urmare, nu are loc sinteza de ADN si diviziunea celulara. In G1 tarziu proteina RB este fosforilata sub actiunea complexelor D/CDK4 si E/CDK2, iar E2F este eliberat, putand activa genele tinta. Se produc, astfel, proteine care induc parcurgerea ciclului celular (S si diviziunea mitotica) (Figura 1).
Aceasta ordine si acest progres in ciclul celular este intrerupt in celulele tumorale. Proteina RB inactivata prin mutatii (de obicei tranzitie C-T) nu se mai leaga de E2F, si ca urmare sinteza ADN si diviziunea celulara sunt continue. Daca o modalitate de control a diviziunii celulare s-a defectat, celula parcurge rapid ciclul celular, iar daca si alte mecanisme de control sunt dereglate, celulele se divid anormal si apar tumori.
Gena p53 si produsul ei proteic
Gena p53 (denumirea corecta este TP53), localizata pe cromozomul 17 este un supresor tumoral care monitorizeaza stressul si directioneaza celula spre un raspuns adecvat. Tipurile de stress la care raspunde p53 includ: anoxie, insuficiente nucleotide pentru sinteza ADN, activare inadecvata a oncogenelor, leziuni ale ADN. Exista dovezi conform carora p53 monitorizeaza lungimea telomerelor, fiind astfel implicata in senescenta celulei. Activata, p53 induce fie stoparea ciclului celular, fie apoptoza. Din acest motiv p53 a fost denumita "gardianul genomului".
Mutatiile mostenite in gena p53 sunt asociate cu sindromul Li Fraumeni, maladie caracterizata prin predispozitie la forme multiple de cancer. Mutatiile somatice care inactiveaza ambele copii ale genei p53 sunt, de asemenea, asociate cu numeroase cancere.
p53 este formata din 3 domenii: (1) TAD, domeniu de activare al transcrierii N terminale, (2) DBD, domeniu central al legarii la ADN, (3) OD, domeniu al homooligomerizarii C terminus. Majoritatea mutatiilor inactivatoare (de pierdere a functiei) sunt localizate in domeniul central, inhiband capacitatea proteinei p53 de a se lega la secvente specifice ale ADN din genele tinta. Se impiedica, astfel, activarea transcriptiei acestor gene.
Proteina codificata de p53 este un factor transcriptional de 53kD, alcatuit din 393 aminoacizi si are, asa cum am amintit, rol cheie in raspunsul celular la stress. In celulele normale nivelul p53 este scazut, in timp ce in celulele tratate cu agenti care distrug ADN nivelul p53 creste foarte mult. Acest raspuns se face pe o cale necunoscuta, care amplifica transcriptia genei p53 si determina, in acelasi timp conversia proteinei p53 intr-o forma stabila si activa (probabil prin fosforilare).
Proteina p 53 stabila (1) stimuleaza transcrierea genelor a caror produsi opresc ciclul celular si permit repararea ADN si (2) activeaza gene a caror produsi activeaza moartea celulelor afectate (Figura 2).
In blocarea ciclului celular un rol important il joaca proteina p21, care este o proteina codificata de o gena activata de p53. p21 inhiba complexul ciclina/CDK, ciclul celular este stopat, iar ADN este reparat. Aceasta "frana" in parcurgerea ciclului celular permite celulei sa-si mentina integritatea genetica. In aceste conditii, inactivarea p53 este un pas cheie spre cancer.
p53 poate declansa raspunsul suicidal la stress, intrucat celula deteriorata este programata sa se distruga. Nu se cunoaste foarte bine acest mecanism, dar pare sa implice un produs proteic al genei BAX. Proteina BAX este antagonica proteinei BCL-2, care in mod normal suprima calea mortii celulare. Cand p53 activeaza proteina BAX, aceasta face ca BCL-2 sa nu mai inhibe calea mortii celulare, deschizand astfel calea apoptotica.
Apoptoza reprezinta, asadar, un raspuns drastic la stress, eliminand celulele serios afectate. De altfel, apoptoza este importanta si in celulele nestressate. De exemplu, in embriogeneza numeroase tipuri de celule sunt programate sa moara dupa ce si-au indeplinit misiunea (celulele dintre degetele de la vertebrate), dar in aceste situatii p53 nu este importanta.
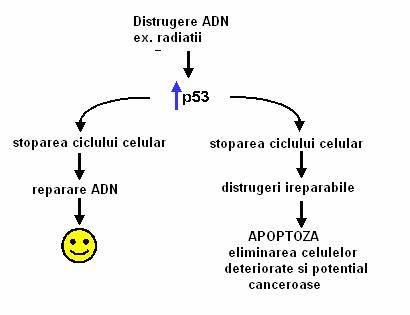
Figura 2 Rolul p53 in stoparea ciclului celular si in apoptoza
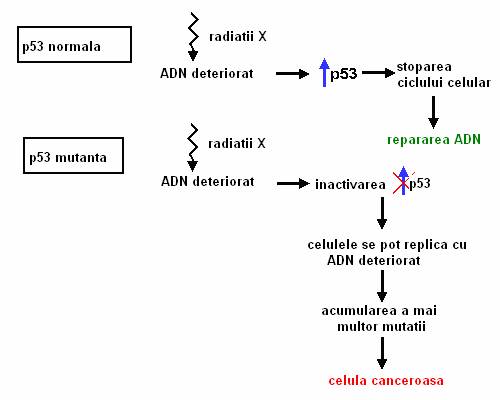
Figura 3 Inactivarea p53 poate determina malignizarea celulelor normale prin multiplicarea celulelor cu ADN deteriorat
In concluzie, daca intr-o celula p53 este afectata, celula se divide, creste instabilitatea genomului, precum si sansa de a fi dereglate alte componente ale mecanismului de control celular. Inactivarea p53 este unul dintre cele mai frecvente evenimente in cancerele sporadice.
Gena APC si proteina corespunzatoare
pAPC este o proteina de 310kD, asociata cu polipii adenomatosi colono-rectali, care adeseori duc la aparitia cancerului de colon. Aceasta proteina este codificata de gena APC, localizata in pozitia 5q21-22 (bratul lung al comozomului 5) si care contine 15 exoni.
Proteina pAPC include 2843 de aminoacizi si are rol in reglarea reinnoirii celulelor epiteliului intestinal. Nu se cunoaste foarte bine acest mecanism, dar se presupune ca pAPC controleaza proliferarea si diferentierea acestor celule. Prin pierderea functiei genei APC, celulele raman nediferentiate, se divid in continuare si genereaza polipi (tumori mici benigne) sau adenoame. Predispozitia pentru formarea polipilor se mosteneste ca o stare dominant autozomala, iar maladia este cunoscuta ca polipoza adenomatoasa familiala (FAP), care are o frecventa de 1/7000.
Pacientii cu FAP fac numeroase adenoame in adolescenta si putin dupa 20 de ani, care sunt initial benigne, iar, ulterior, exista probabilitatea ca cel putin unul sa devina malign. La varsta tanara (in medie 42 de ani) purtatorii de mutatii ale genei APC fac cancer de colon.
Mutatiile somatice ale genei APC genereaza, de asemenea, aparitia de polipi, in numar mai mare. Este important de subliniat ca indivizii fara mutatii mostenite la nivelul genei APC au rar multiple adenoame, dar pot avea totusi cateva daca gena sufera 2 mutatii somatice.
pAPC regleaza diviziunea celulara prin capacitatea de a se lega de β-catenina, formand complexele pAPC/ β-catenina. β-catenina este o proteina intracelulara, care in mod normal se leaga de factori de transcriptie citoplasmatici (LEF, TCF) care stimuleaza exprimarea genelor ce promoveaza diviziunea celulara. Este important de retinut faptul ca in epiteliul intestinal diviziunea este un proces absolut necesar, deoarece acest tesut pierde zilnic un numar enorm de celule (aproximativ 1011), iar pierderile trebuie inlocuite. In mod normal, celulele tinere pierd capacitatea de diviziune si se muta din partea regenerativa a epiteliului in partea sa matura. Celulele din zona epiteliala regenerativa receptioneaza semnale extracelulare externe care stimuleaza diviziunea, in timp ce, celulele din zona matura nu receptioneaza asemenea semnale, iar pAPC se leaga de β-catenina, care, in aceste conditii nu mai activeaza factorii transcriptionali ce stimuleaza diviziunea celulara.
Celulele cu mutatii la nivelul genei APC pierd capacitatea de a regla nivelul β-cateninei, se divid si nu se diferentiaza in celule epiteliale mature, generand tumori. Cu alte cuvinte, moleculele normale de pAPC au rol in represarea formarii tumorilor in intestin.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |