Majoritatea reactiilor nu decurg cu epuizarea totala a reactantilor si sunt prin urmare reactii de echilibru. O reactie se afla la echilibru daca toti componentii sistemului se afla la aceeasi temperatura si presiune iar compozitia sistemului nu variaza in timp. Echilibrele sunt de doua tipuri:
- echilibre fizice;
- echilibre chimice.
Indiferent de natura echilibrelor, ele au o serie de proprietati comune dupa cum urmeaza:
- echilibrul este stabil daca parametrii de stare (presiunea si temperatura) sunt mentinuti constanti;
echilibrul prezinta mobilitate, adica revine spontan la starea initiala, cand inceteaza actiunea perturbatoare externa;
- echilibrul este rezultatul a doua procese care se desfasoara cu viteze egale dar in sensuri opuse (aceasta proprietate subliniaza caracterul dinamic al starii de echilibru);
- la echilibru, energia libera a sistemului prezinta valoarea minima.
Legea actiunii maselor (LAM) este rezultatul observatiilor experimentale ale lui Berthelot, iar generalizarea matematica apartine lui Guldberg si Waage. Fie urmatoarea reactie generala :
aA+ bB ↔ cC +dD
atunci LAM afirma ca intr-o reactie de echilibru: "la o temperatura si presiune data, produsul concentratiilor produsilor de reactie deimpartit la produsul concentratiei reactantilor este constant"
Kc = [C]c [D]d / [A]a [B]b
Parantezele drepte exprima concentratia substantelor exprimata in moli/litru. Legea actiunii maselor se aplica doar acelor procese ce se gasesc la echilibru. Daca ne imaginam ca la echilibru viteza reactiei directe devine egala cu viteza reactiei inverse (Figura ), atunci putem sa scriem expresiile pentru cele doua viteze de reactie si sa le egalam:
v1 = k1 [A]a [B]b si v2 = k2 [C]c [D]d
la echilibru v1 = v2 si deci
k1 [A]a [B]b = k2 [C]c [D]d
deoarece oricare din cantitatile existente nu are valoarea 0, putem face urmatoarele operatii:
- impartim ambii membrii ai egalitatii cu k2
- impartim ambii membrii ai egalitatii cu produsul [A]a [B]b
si obtinem: k1 / k2 = [C]c [D]d / [A]a [B]b
dar raportul a doua constante este tot o constanta k1 / k2 = Kc .
Daca reactantii si produsii de reactie se gasesc in stare gazoasa, atunci concentratiile se pot exprima prin presiuni partiale dupa cum urmeaza:
Kp = [PC]c [PD]d / [PA]a [PB]b
Intre constanta de echililibru exprimata prin concentratii molare si cea exprimata prin presiuni partiale exista urmatoarea legatura:
Kc= Kp. 1/ (RT)
unde ν = (c+d)-(a+b)
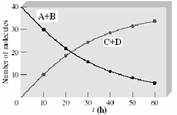
Figura 57. Vitezele reactiei directe si inverse devin egale la
instalarea echilibrului
Principiul lui Le Chatelier afirma ca "daca asupra unui sistem aflat in echilibru se exercita o anumita constrangere, atunci echilibrul se deplaseaza in asa fel incat constrangerea sa devina minima". Factorii care pot influenta echilibrul chimic sunt: temperatura, presiunea si concentratiile speciilor participante. Vom arata in continuare prin exemple cum influenteaza acesti factori diferite reactii la echilibru.
Influenta temperaturii: Fie reactia de echilibru:
2NO2 ↔ N2O4 + Q Q= -55 Kj
brun roscat incolor
Reactia de dimerizare a dioxidului de azot este exoterma ! La scaderea temperaturii, echilibrul se deplaseaza la dreapta, fapt ce poate fi usor remarcat prin disparitia culorii brun roscat a dioxidului de azot La cresterea temperaturii are loc descompunerea tetraoxidului de azot (reactie endoterma) si intensificarea culorii brun roscat a dioxidului de azot.
Influenta presiunii: Fie reactia de echilibru:
N2+3H2 ↔ 2NH3
Acesta reactie are loc cu variatie de volum: in reactie intra patru volume de reactanti si ies doua volume de produs de reactie. Prin urmare, pentru a deplasa echilibrul spre dreapta trebuie lucrat la presiune ridicata. Scaderea presiunii are drept consecinta deplasarea echilibrului spre stanga.
Influenta concentratiei: Fie reactia de echilibru:
CH3COOH + C2H5OH ↔ CH3COOC2H5 + H2O
Pentru deplasarea echilibrului spre dreapta, apa trebuie evacuata permanent din sistem; acest lucru poate fi realizat prin doua metode:
- se conduce reactia de esterificare in prezenta unui agent deshidratant (prezenta de site moleculare sau saruri anhidre care se hidrateaza pe seama apei de reactie)
- fie indepartarea continua a apei prin adaugare de toluen sau benzen cu care apa formeaza un azeotrop care distila la o temperatura inferioara si apei si toluenului.
Electrolitii reprezinta substante care in stare topita sau in solutie sunt conductori electrici. Conductivitatea electrica a solutiilor de electroliti este foarte diferita (fie ca sunt combinatii ionice sau covalente) si-n consecinta ei au fost clasificati in raport cu acest criteriu in electroliti tari si electroliti slabi.
In categoria electrolitilor tari intra:
- saruri: NaCl, KNO3, Na2SO4, Pb(NO3)2, CaCl2, CuSO4, CH3COONa;
- hidroxizi solubili: NaOH, KOH, Ba(OH)2;
- acizi minerali: HBr, HCl, H2SO4, HNO3, H3PO4;
Electroliti slabi sunt:
- acizi organici: CH3COOH, C6H5COOH;
- acizi anorganici: H2S,
H2CO3,
- baze: NH3, amine.
Formarea purtatorilor de sarcini electrice, in cazul combinatiilor covalente, are loc prin scindarea heterolitica a unor legaturi covalente:
CH3 CH2COOH
+ H2O ![]() CH3CH2COO-
+ H3O+
CH3CH2COO-
+ H3O+
NH3
+ H2O ![]()
![]() + HO
+ HO
Procesul prin care moleculele covalente se scindeaza si in urma caruia se formeaza ioni poarta numele de disociatie electrolitica. Pentru cuantificarea acestui proces se introduce notiunea de grad de disociere notat cu si a carui semnificatie rezulta din formula sa de calcul
![]()
Doar electrolitii tari au gradul de disociere egal cu 1, ei fiind complet disociati (HCl disociaza complet in apa). Pentru solutiile de electroliti tari se introduce notiunea de activitate, a care reprezinta o concentratie corectata cu un factor de corectie (f). Activitatea este definita de relatia:
a = f·c
in care f este coeficientul de activitate, c - concentratia molala. In cazul solutiilor diluate (chiar si de electroliti tari) se va considera ca f tinde catre valoarea 1
Moleculele de apa ionizeaza conform reactiei reversibile, echilibrul fiind mult deplasat spre stanga:
H2O
+ H2O ![]() H3O+ + HO-
H3O+ + HO-
S-a stabilit experimental ca, la temperatura de 25sC gradul de disociere a apei este aproximativ 18·10-10. Pentru acest echilibru se scrie expresia constantei de echilibru:
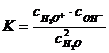
unde toate concentratiile speciilor prezente sunt exprimate in mol/l.
La acest grad de disociere, concentratia apei poate fi considerata constanta si poate fi inglobata in constanta de echilibru:
![]()
KW se numeste produsul ionic al apei. Produsul ionic al apei depinde de temperatura si creste o data cu cresterea temperaturii. Valoarea lui la 25oC este de 10-14 si deoarece concentratia ionilor H3O+ este egala cu cea a ionilor HO- putem scrie ca
![]() mol L-1
mol L-1
Sörensen a introdus notiunea de pH (exponent de hidrogen) pentru a exprima concentratia ionilor de hidrogen astfel:
![]()
Similar cu notiunea de pH a fost introdus si termenul de pOH (exponent de OH-), care este o masura a concentratiei ionilor de hidroxil:
![]()
Se poate arata usor ca la temperatura de 25 C, are loc egalitatea
pH + pOH = -lg KW = 14
Pentru apa pura valoarea pH=7. Aceasta valoare constitue centrul scalei de aciditate al solutiilor apoase. Solutii care au valoarea pH-ului < 7 sunt solutii acide, solutii care au valoarea pH-ului >7 sunt solutii bazice.
Conform teoriei disociatiei electrolitice a lui S.Arrhenius, acizii sunt substante care, in solutie apoasa, pun in libertate ioni de hidrogen H+ in timp ce bazele sunt substante care, in solutii apoase, produc ioni de hidroxil. Teoria desi generoasa nu a rezistat timpului deoarece limiteaza speciile acide si bazice doar la substantele care elibereaza in solutii apoase H+, respectiv HO- .
Teoria protolitica a acizilor si bazelor a fost elaborata de Brönsted si Lowry. Conform acesteia, reactiile acido-bazice sunt procese de transfer de protoni. Acizii sunt substante care cedeaza protoni, iar bazele sunt substante care accepta protoni.
Ionizarea acidului clorhidric are loc ca urmare a interactiunii cu apa, proces in care are loc transferul protonului de la molecula de HCl la molecula de apa:

Apa poate indeplini atat rolul de acid, cat si de baza. Astfel, la ionizarea amoniacului, transferul de protoni decurge de la moleculele de apa la moleculele de amoniac:
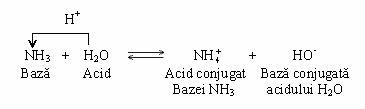
Apa este considerata amfiprotica, intrucat se comporta atat ca acid (donor de protoni), cat si ca baza (acceptor de protoni). Un acid tare (care cedeaza complet protonul apei) are o baza conjugata slaba (care se protoneaza extrem de greu).
Sunt acizi tari : HCl, HI, HCl, HNO3, H2SO4, HClO4 deoarece doneaza complet protonul apei, adica ionizeaza printr-o reactie practic ireversibila. Asta inseamna ca concentratia ionilor de hidroniu este egala cu concentratia acidului in solutie si in cazul, de exemplu al acidului clorhidric (HCl), calculul pH-ului se reduce la:
![]()
In mod similar are loc si calcul pOH-ului solutiilor de baze tari. Acizii care insa ionizeaza partial in solutie apoasa sau bazele partial ionizate in solutie au echilibrul de ionizare caracterizat de constanta de aciditate respectiv bazicitate.
Fie acidul slab AH care ionizeaza conform ecuatiei:
HA + H2O ![]() H3O+ + A-
H3O+ + A-
Pentru acest echilibru se poate scrie expresia constantei de echilibru astfel:
![]()
Deoarece in cazul acizilor slabi , echilibrul e deplasat spre stanga, concentratia apei ramine aproape constanta si se poate include in K. Se obtine astfel constanta de aciditate Ka:
![]()
Pe baza valorilor constantei de aciditate se poate aprecia taria acizilor. Acizii foarte slabi au constanta de aciditate mai mica decat 10-7 ( de exemplu H3BO3, HClO).Acizii slabi au constanta de aciditate mult sub valoarea 10-2 (de exemplu CH3COOH, HNO2), cei care se apropie de aceasta valoare pot fi considerati acizi medii. Acizii complet ionizati in solutie apoasa (dupa cum s-a mai aratat) sau aproape complet ionizati sunt acizi tari
In cazul acizilor slabi scriem echilibrul de deprotonare si expresia constantei de aciditate:
HA +H2O
![]() H3O+
+ A-
H3O+
+ A- ![]()
Concentratia acidului neionizat este [HA] = c - [H3O+]. Dupa atingerea echilibrului se observa ca [H3O+] = [A-], si inlocuind in relatia precedenta obtinem:
![]()
Liniarizand obtinem o ecuatie de gradul II, avand ca necunoscuta [H3O+]:
![]() [H3O+]2 + Ka[H3O+]
- Ka c
[H3O+]2 + Ka[H3O+]
- Ka c
care prin rezolvare conduce la doua solutii din care va fi retinuta cea cu semnificatie reala:
![]()
In situatia acizilor slabi (Ka mic) se neglijeaza primii doi termeni astfel ca solutia se simplifica si devine
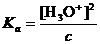
din care rezulta imediat:
![]()
Pentru o baza slaba rationamentul este similar :
![]()
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |