Pila voltaica
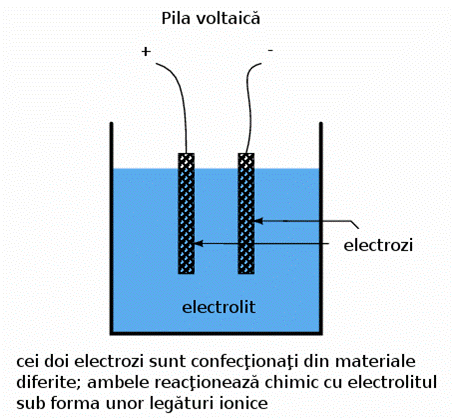
Formarea ionilor si a legaturilor ionice din atomii neutrii sau molecule (sau invers) presupune transferul de electroni. Acest transfer poate fi folosit pentru generarea curentului electric. Un dispozitiv construit special in acest scop poarta denumirea de pila voltaica sau, pe scurt, pila; aceasta este de obicei formata din doi electrozi metalici introdusi intr-o substanta chimica denumita electrolit, substanta special conceputa pentru facilitarea unei astfel de reactii electrochimice (oxidare/reducere).
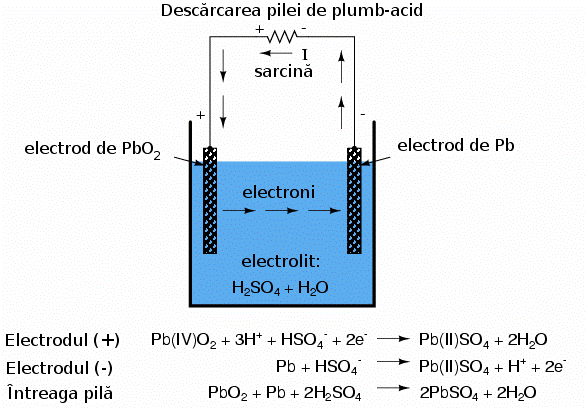
Pila folosita pentru automobile este de obicei cea de "plumb-acid". Electrodul negativ este confectionat din plumb (Pb), iar cel pozitiv din dioxid de plumb (IV) (PbO2), ambele substante fiind metalice. Solutia de electrolit este o solutie diluata de acid sulfuric (H2SO4 + H2O). Daca electrozii pilei sunt conectati la un circuit extern, astfel incat sa fie posibila deplasarea electronilor de la un electrod la celalalt, atomii de plumb (IV) din electrodul pozitiv (PbO2) vor castiga fiecare cate doi electroni pentru a produce Pb(II)O. Atomii de oxigen rezultati se vor combina cu ionii pozitivi de hidrogen (H)+ pentru formarea apei (H2O). Aceasta deplasare a electronilor spre electrodul PbO2 ii confera o sarcina pozitiva. Atomii de plumb din electrodul negativ cedeaza fiecare cate doi electroni pentru a produce plumb Pb(II), care in combinatie cu ionii de sulfat (SO4-2), produsi prin disociatia ionilor de hidrogen (H+) din acidul sulfuric (H2SO4), formeaza sulfatul de plumb (PbSO4. Deplasarea electronilor dinspre electrodul de plumb ii confera sarcina electrica negativa.
electrodul (+): Pb(IV)O2
+ 3H+ + HSO4- + 2e- --> Pb2SO4
+ 2H2O
electrodul (-): Pb + HSO4- --> Pb(II)SO4 +
H+ + 2e-
intreaga pila: PbO2 + Pb + 2H2SO4 -->
2PbSO4 + 2H2O
Acest proces prin care pila produce energie pentru alimentarea sarcinii se numeste descarcare si provine de la faptul ca aceasta isi epuizeaza rezervele chimice interne in urma acestui proces. Teoretic, dupa ce intreaga cantitate de acid sulfuric se consuma, din pila mai raman cei doi electrozi de sulfat de plumb (PbSO4) si o solutie electrolitica de apa pura (H2O); aceasta situatie nu mai permite formarea legaturilor ionice aditionale. In acest moment, pila se spune ca este complet descarcata. Stadiul de incarcare poate fi determinat in acest caz de concentratia solutiei acide.
Nu toate pilele voltaice sunt construite pe baza acelorasi reactii chimice, dar lucrul cel mai important de retinut este ca electronii sunt "motivati" sa se deplaseze intre cei doi electrozi de catre reactiile ionice dintre moleculele electrozilor si moleculele electrolitului. Reactia este activata atunci cand exista un drum exterior inchis (complet) pentru formarea curentului electric. La intreruperea acestui circuit, reactiile chimice inceteaza.
Valoarea tensiunii generate de o celula depinde de tipul reactiilor chimice ce au loc in interiorul acesteia, mai bine spus, de configuratia chimica a celulei. In exemplul de mai sus, pila de plumb-acid prezinta la bornele sale o tensiune nominala de 2,04 V, atunci cand este incarcata la maxim (concentratia de acid ridicata). Pila Edison, confectionata din oxid de nichel (electrodul pozitiv) si fier (electrodul negativ), cu o solutie electrolitica de hidroxid de potasiu genereaza o tensiune nominala de 1,2 V.
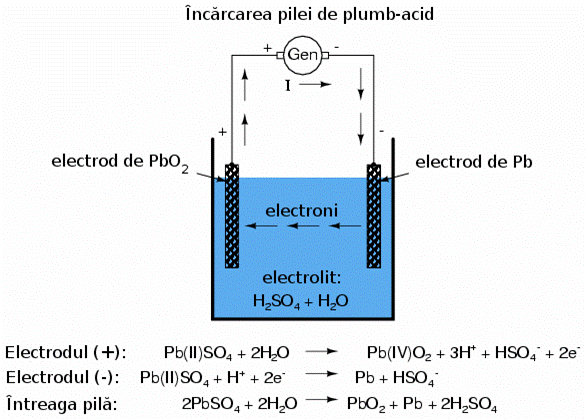
In cazul anumitor tipuri de pile, reactiile chimice pot fi inversate fortand curgerea curentului in sens invers prin pila. Acest proces poarta denumirea de incarcare. O astfel de pila re-incarcabila se numeste pila secundara. O pila a carei compozitii chimice nu poate fi readusa la starea initiala se numeste pila primara.
Incarcarea unei pile de plumb-acid printr-o sursa de curent externa duce la inversarea reactiilor chimice din interiorul acesteia:
electrodul (+): Pb(II)SO4
+ 2H2O --> Pb(IV)O2 + 3H+ + HSO4-
+ 2e-
electrodul (-): Pb(II)SO4 + H+ + 2e- -->
Pb+ HSO4-
intreaga pila: 2PbSO4 + 2H2O --> PbO2
+ Pb + 2H2SO4
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |