
Valenta si strucura cristalina
Electronii din stratul exterior, sau stratul de valenta, sunt cunoscuti sub numele de electroni de valenta. Acesti electroni sunt responsabil de proprietatile chimice ale elementelor. Acestia sunt electronii ce participa la reactiile chimice cu celelalte elemente.
Conform unei reguli chimice simplificate, aplicabila reactiilor simple, atomii incearca sa-si completeze toate locurile libere ale stratului exterior cu electroni. Atomii pot ceda cativa electroni pentru a "descoperi" un strat complet, sau pot accepta cativa electroni pentru a completa ultimul strat (stratul exterior). Ambele procese duc la formarea ionilor. Atomii pot chiar sa imparta electroni intre ei in incercarea de completare a stratului exterior, ducand la formarea legaturilor moleculare, adica, atomii se asociaza pentru formarea unei molecule.
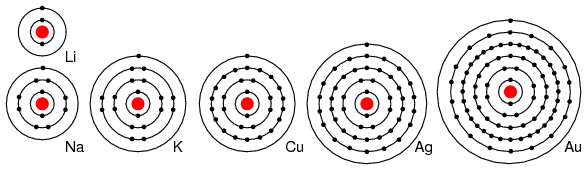
De exemplu, elementele din grupa I din tabelul periodic, Li, Na, K, Cu, Ag si Au au doar un singur electron de valenta (numarul de electroni de pe ultimul strat). Toate aceste elemente poseda proprietati chimice similare. Acesti atomi cedeaza un electron pentru a reactiona cu alte elemente, iar aceasta proprietate face ca aceste elemente sa fie conductoare excelente de electricitate. Cedarea electronilor de catre atomi duce la formarea ionilor pozitivi
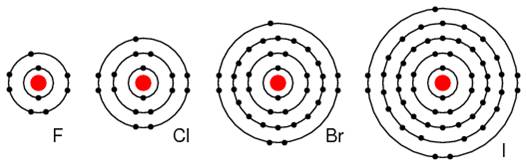
Elementele din grupa VIIA, Fl, Cl si BR, au toate cate 7 electroni in stratul exterior (stratul de valenta). Aceste elemente accepta un electron pentru completarea stratului de valenta la 8 electroni. In cazul in care aceste elemente accepta un electron, ele formeaza ioni negativi. Din moment ce nu cedeaza electroni, aceste elemente sunt foarte buni izolatori electrici.
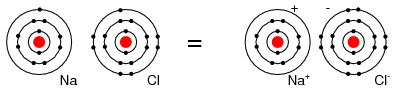
De exemplu, un atom de Cl accepta un electron al unui atom de Na devenind ion negativ Cl-, iar atomul de Na devine ion pozitiv, Na+. Un ion este un atom, molecula sau grupare de atomi care are un exces de sarcina electrica pozitiva sau negativa. Acesta este modul in care Na si Cl se combina pentru formarea NaCl, sarea de masa, care este de fapt o pereche de ioni, Na+Cl-. Fiindca sarcinile celor doi ioni sunt de semn contrar, cei doi se atrag reciproc.
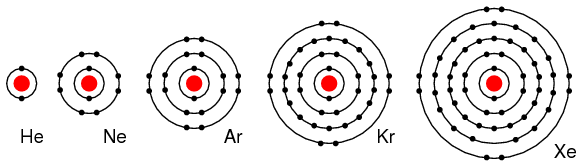
Elementele din grupa a VIIIA, He, Ne, Ar, Kr si Xe au toate cate 8 electroni pe stratul de valenta. Acest lucru inseamna ca aceste elemente nici nu doneaza dar nici nu accepta electroni, ne-participand la reactii chimice cu alte elemente. Toate sunt izolatori electrici si se gasesc sub forma de gaz la temperatura camerei.
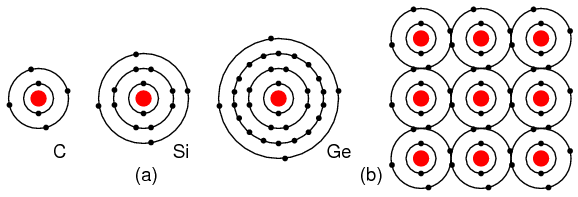
Elementele din grupa IVA, C, Si si Ge au toate cate 4 electroni in stratul de valenta. Aceste elemente formeaza compusi cu alte elemente, dar nu formeaza ioni. Acest tip de legatura este cunoscuta sub numele de legatura covalenta. Se poate observa ca atomul din centru are completat stratul de valenta prin punerea in comun a electronilor atomilor. Figura de mai jos este o reprezentare bidimensionala a unui aranjament tridimensional. Elementele din aceasta grupa prezinta proprietatile semiconductoare pe care le vom studia in continuare.
Majoritatea substantelor anorganice formeaza o structura ordonata denumita cristal atunci cand se formeaza legaturi intre atomii sau ionii acestora. Chiar si metalele sunt compuse din cristale, la nivel microscopic. Practic insa, toate metalele industriale au o structura policristalina, in afara de materialele semiconductoare ce sunt monocristaline.
Majoritatea metalelor sunt moi si usor deformabile pe cale industriala. In timpul prelucrarii, microcristalele sunt deformate, iar electronii de valenta sunt liberi sa se deplaseze prin reteaua cristalina, si de la cristal la cristal. Electronii de valenta nu apartin unui atom anume, ci tuturor atomilor.
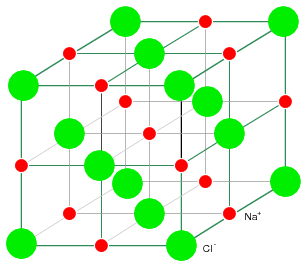
Structura cristalina rigida a NaCl prezentata in figura alaturata, este compusa dintr-o structura regulata repetitiva formata din ioni pozitivi de Na si ioni negativ de Cl. Odata ce atomii de Na si Cl formeaza ionii de Na+ si Cl- prin transferul unui electron de la Na la Cl, fara existenta electronilor liberi, electronii nu sunt liberi sa se deplaseze prin reteaua cristalina, o diferenta mare fata de metale. Nici ionii nu sunt liberi. Ionii sunt liberi sa se deplaseze doar daca NaCl este dizolvata in apa, dar in acest caz, cristalul nu mai exista. Materialele ionice formeaza structuri cristaline datorita atractiei electrostatice puternice dintre ionii incarcati cu sarcini opuse.
Materialele semiconductoare din grupa IV (C, Si, Ge), formeaza de asemenea cristale. Fiecare atom formeaza o legatura chimica covalenta cu alti patru atomi. Cristalul format este practic o singura molecula. Structura cristalina este relativ rigida si rezista deformatiilor. Exista un numar relativ mic de electroni liberi prin cristal.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |