1.Generalitati
Spre deosebire de coroziunea uniforma, generalizata, a unui material care poate fi evaluata cantitativ prin viteza de coroziune, otelurile carbon pot suferi si o coroziune localizata - tip pitting - in anumite conditii specifice. Conditia de baza pentru aparitia acestui tip de coroziune este existenta unei stari pasive a metalului in mediul respectiv. Pittingul apare atunci cand zone din suprafata metalului isi pierd pasivitatea si nemaifiind protejate de filme superficiale, incep sa sufere reactii anodice de dizolvare. Deobicei, acest tip de atac apare pe eterogenitatile suprafetei, fie ele fizice sau chimice. Pituirea unui anumit material se produce atunci cand sunt intrunite, in principal, urmatoarele doua conditii:
v prezenta unor specii agresive in mediu si
v existenta unui potential oxidant suficient de mare al acestora (de exemplu prezenta ionilor de Cl- in solutiile apoase, aerate aflate in contact cu otelul carbon sau inox).
Pittingul, prin efectele sale nefaste, poate limita sever performantele si implicit viata instalatiilor, asa incat a constituit subiectul investigatiilor multor cercetatori, Szlarska-Smialowska[31] scriind chiar un studiu monografic pe aceasta tema.
Pitting-ul este o forma de atac extrem de localizat care da nastere la cavitati sau goluri in metale sau aliaje. Deteriorarea prin pituire este una dintre cele mai periculoase tipuri de coroziune localizata, deoarece viteza de propagare si directia acestui tip de coroziune (si implicit suprafata care va fi afectata) sunt complet aleatoare si, in consecinta, nu pot fi anticipate in practica inginereasca. Piturile fiind deseori acoperite de produsi de coroziune, adancimea lor nu poate fi estimata anticipat, iar efectul coroziunii pitting devine sesizabil de-abia cand se produce perforarea materialului si cand, deci, este prea tarziu. In timp ce viteza coroziunii uniforme poate fi urmarita prin intermediul variatiei masei probei raportata la suprafata ei si la timpul de stationare in mediu, pentru evaluarea coroziunii pitting trebuie folosite alte metode. Astfel, ASTM G-46[67] si G-61[27] prezinta principalele metodologii de evaluare a coroziunii pitting si anume determinarea densitatii piturilor (np) (numarul de pituri/cm2) si a adancimii acestora. Pentru evaluarea acestor parametri, tehnica cea mai uzitata este microscopia metalografica. In acest context a fost creat si s-a incercat calcularea factorului de pituire (PF), care reprezinta raportul dintre media adancimii a 10 pituri dintre cele mai adanci si viteza medie de dizolvare uniforma a metalului. Cu cat aceste valori sunt mai inalte, cu atat va exista o susceptibilitate mai mare la pitting, iar cand factorul de pituire este egal cu unu, inseamna ca a avut loc coroziunea uniforma.
Exista doua tipuri de medii apoase utilizate pentru testarea probelor la coroziune pitting si anume:
a) cele care simuleaza conditiile reale de exploatare si
b) cele care contribuie la accelerarea proceselor de pituire.
Datorita aplicabilitatii lor directe si imediate, sunt preferate testele de tipul (a). In acelasi timp, datorita faptului ca timpul de viata al instalatiei intereseaza in cel mai inalt grad, au fost preferate testele de lunga durata in scopul confirmarii deciziilor luate pe baza testelor accelerate de laborator si pentru monitorarea coroziunii.
Pentru detectarea susceptibilitatii la coroziune pitting pot fi folosite doua tipuri de teste:
teste chimice si
teste electrochimice.
Avantajul utilizarii testelor electrochimice consta in faptul ca investigarea fenomenului de coroziune se poate face atat in solutiile de interes, cat si in medii cu diverse agresivitati, investigatiile durand o perioada de timp mult mai scurta decat in cazul testelor chimice clasice.
Cand se doreste accelerarea unui test, in mod uzual se aplica urmatoarele doua metode: cresterea temperaturii si/sau marirea concentratiei de specii agresive (Cl-, H+, etc). Accelerarea trebuie facuta cu grija pentru a nu se schimba mecanismul de atac, care trebuie sa fie identic in cele doua medii: cel real de operare si cel din solutia agresiva din punct de vedere chimic. Din cele aratate pana aici reiese ca rezultatele testelor accelerate sunt utile in selectarea materialelor, nu si in prezicerea vietii componentelor confectionate din ele.
Dintre testele electrochimice, cele mai uzitate pentru detectarea susceptibilitatii la coroziune localizata, se numara polarizarea ciclica (PC), de modul si conditiile in care ea se aplica ocupandu-se ASTM-ul G-61 [27].
Potentialul explorat este baleiat in jurul lui Ecor (sau putin sub el) in directie anodica pana la initierea coroziunii localizate, care este indicata printr-o crestere brusca a curentului (figura 1[20]). In acest punct, se inverseaza directia baleierii, iar curentul incepe sa scada, schimbandu-si in final polaritatea. Pentru exemplificare, in figura 2[20] sunt prezentate doua curbe ale polarizarii ciclice specifice otelului carbon si Incoloy-ului-800.
Conventional, s-a stabilit ca potentialul de rupere al filmului superficial (Ebd) reprezinta potentialul deasupra caruia se initiaza piturile, iar potentialul de repasivare (Erp) sau potentialul de protectie (Eprot) este potentialul sub care are loc repasivarea piturilor (figura 1a). Tinand cont de conventiile de mai sus, "Ebd" reprezinta potentialul la care apare o crestere brusca a curentului, in timp ce "Erp" este potentialul la care pe parcursul inregistrarii inverse a curentului, acesta isi schimba polaritatea, trecand prin valoarea 0. Din cele aratate mai inainte, rezulta ca cu cat valoarea lui Ebd este mai mare, cu atat aliajul este mai rezistent la initierea coroziunii localizate.
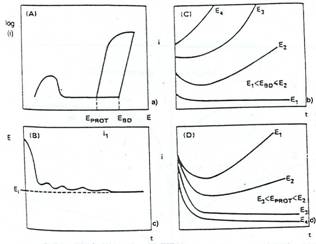
Fig.1[20] Reprezentarile schematice ale curbelor specifice evidentierii coroziunii pitting: a)curba potentiodinamica de polarizare ciclica; b)curba galvanostatica; c)curba potentiostatica in cazul in care E1<Ebd <E2; d)curba potentiostatica in cazul in care E3< Erp <E2
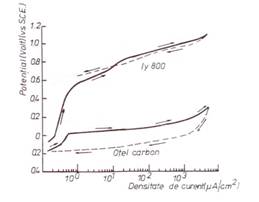
Fig.2[20] Curbele polarizarii ciclice aferente Incoloy-ului 800
si unui otel carbon
O alta caracteristica electrochimica specifica unui material este potentialul critic de repasivare, care este definit ca potentialul cel mai nobil la care piturile se vor repasiva dupa parcurgerea etapei de initiere (stimulare). In general, coroziunea localizata - odata initiata - se va propaga numai la potentiale mai pozitive decat potentialul la care s-a inchis bucla de histerezis. Cu alte cuvinte, repasivarea va avea loc la potentiale mai negative decat Ebd, dupa initierea coroziunii localizate. Deci, cu cat este mai pozitiv potentialul la care bucla de histerezis este completa, cu atat este mai putin probabil ca sa aiba loc propagarea coroziunii localizate.
In determinarea corecta a valorilor lui Ebd si Erp, o mare influenta o are viteza de baleiaj a potentialului, valoarea lui Ebd fiind corelata cu timpul de inductie necesar initierii pittingului. De aici rezulta ca o viteza mare de baleiaj a potentialului va permite o propagare prea extinsa a pittingului inainte de inversarea directiei de baleiere. Aceasta va afecta fie numarul de pituri, fie adancimea acestora, fie pe ambele.
Adancimea piturilor modifica marimea difuziei - asociata dilutiei solutiei chimice aflata in pit - necesara pentru repasivare. Acest factor afecteaza comportarea la polarizare dupa schimbarea directiei baleierii, influentand astfel si valoarea lui Eprot. S-a gasit ca valoarea potentialului de rupere al filmului superficial (Ebd) - determinata pe baza masuratorilor potentiostatice sau utilizand viteze de baleiere mai mici - este destul de apropiata de valoarea potentialului de repasivare (Erp), determinata din cresterea pitului minim [68].
Referitor la metodele electrochimice complementare polarizarii ciclice, care pot fi folosite la determinarea mai exacta a valorilor potentialelor de rupere ale filmului superficial si respectiv de repasivare a piturilor(Ebd si Erp), s-a aratat ca utilizarea, de exemplu, a metodei potentiostatice(PS) poate conduce la depasirea problemelor legate de alegerea vitezei de baleiere. Astfel, o estimare mai exacta a valorii potentialului de rupere a filmului superficial (Ebd) se poate realiza utilizand metoda potentiostatica, care consta in mentinerea probelor perioade de timp mai indelungate la potentiale situate putin sub sau deasupra valorilor lui Erp si Ebd, determinate anterior prin tehnica polarizarii ciclice (fig.1c).
Pornind de la aceste premize, Palit a folosit metoda potentiostatica pentru a determina mai exact potentialul de nucleere al piturilor [69]. Potentialul ales spre aplicare a fost un potential situat putin sub potentialul stabil de nucleere al piturilor sau sub cel aferent pittingului metastabil indicat prin oscilatiile in curentul anodic. Potentialul minim necesar initierii unui pit stabil si cresterii ulterioare a acestuia s-a considerat ca este potentialul de nucleere al pitului (Ei) in cazul unui metal neacoperit. Aceasta creare lenta a unui pit - prin dizolvarea anodica a metalului - intarzie scaderea potentialului spre valori mai mici. Numai dupa terminarea acestui proces va apare un alt proces catodic, suficient de rapid pentru a mentine pittingul. Dupa ce pitul s-a repasivat, curentul catodic necesar reducerii Fe3+ redevine minim, echilibrand astfel curentul de dizolvare in conditii de pasivitate, asa incat, in final, potentialul revine la valoarea sa anterioara mai nobila. Presupunand ca ionul metalic majoritar care apare intr-un pit anolit de pe otelul carbon este Fe2+ si determinandu-i concentratia, s-a constatat ca rezultatele experimentale au concordat bine cu calculele teoretice. Aceasta concordanta a confirmat ipoteza formarii de ioni cu valente normale in pit si totodata faptul ca dizolvarea avanseaza utilizand practic tot curentul.
2. Rezultate experimentale proprii ale investigarii coroziunii pitting
Conform recomandarilor din literatura de specialitate, pentru studierea susceptibilitatii la coroziune pitting a celor trei tipuri de oteluri carbon, au fost executate, mai intai, masuratori electrochimice la temperatura camerei utilizand metoda polarizarii ciclice(PC) in solutii de NaCl continand 2 si 20ppm ioni Cl-. In testele respective a fost utilizata o viteza de baleiaj de 1mV/sec, incepand de la valoarea potentialului de coroziune in circuit deschis (OCP). Au fost determinate urmatoarele valori ale potentialelor semnificative pentru comportarea la coroziune pitting: Ebd, Erp si respectiv DE = Ebd - Erp, care au fost inserate in tabelele 1 si 2[70]. Masuratorile electrochimice executate pe probele de otel carbon neacoperite au aratat ca otelul SA508 este mai susceptibil la pitting decat otelul SA516 (figura 3[69]).
Tabelul 1[70]Rezultatele testelor electrochimice executate in solutii continand 2mg Cl-/l si avand diferite pH - uri
|
Tip otel |
Starea supr. |
pH sol. |
Valorile parametrilor coroziunii pitting |
DE=Epit -Erp (mV) |
Ecor (mV) |
|
|
Epit |
Erp |
|||||
|
OL SA508 |
NA | |||||
|
NA | ||||||
|
NA | ||||||
|
A | ||||||
|
A | ||||||
|
A | ||||||
|
OL SA516 |
NA | |||||
|
NA | ||||||
|
NA | ||||||
|
A | ||||||
|
A | ||||||
|
A | ||||||
Argumentul care justifica afirmatia de mai sus il constituie valorile potentialelor de initiere ale piturilor(Ei) inregistrate in cazul celor doua oteluri SA508 si SA516, testate intr-o solutie de NaCl continand 2mgCl-/l, care au fost egale cu [(+68)mV] pentru otelul SA516 si respectiv [(+367mV] pentru otelul SA508. Buclele de histerezis - comparabile ca suprafata - semnifica faptul ca in cazul ambelor oteluri, densitatile piturilor sunt comparabile, eventualele diferente datorandu-se dimensiunii piturilor.
Micrografia unei probe de otel carbon SA508, initial neacoperita, supusa polarizarii ciclice intr-o solutie continand 2mg/l Cl- este prezentata in figura 4[70].
Tabelul 2[70] Rezultatele testelor electrochimice executate in solutii continand 20mg Cl-/l avand diferite pH - uri
|
Tip otel |
Starea supr. |
pH sol. |
Valorile parametrilor coroziunii pitting |
DE=Epit -Erp (mV) |
Ecor (mV) |
|
|
Epit |
Erp |
|||||
|
OL SA508 |
NA | |||||
|
NA |
5,75(i) | |||||
|
NA | ||||||
|
A | ||||||
|
A |
5,75(i) |
| ||||
|
A | ||||||
|
OL SA516 |
NA | |||||
|
NA |
5,75(i) | |||||
|
NA | ||||||
|
A | ||||||
|
A |
5,75(i) | |||||
|
A | ||||||
|
|
|
|
Fig.3[70] Curbele PC aferente otelurilor SA508 si SA516 neacoperite initial, testate in solutia continand 2mg/l Cl-(NaCl) |
Fig.4[70] Micrografia filmului superficial format pe o proba de otel SA508 neacoperita initial, polarizata ciclic intr-o solutie continand 2mg/l Cl- (NaCl) (x250) |
Ca urmare a polarizarii in solutia contaminata cu ioni de Cl-, au aparut pituri relativ dese, avand diverse marimi. Comparand comportarea la pituire a probelor neacoperite din doua tipuri de oteluri: SA508 si SA516, polarizate ciclic in solutii avand concentratii diferite in Cl-, am remarcat urmatoarele:
- valorile potentialelor de initiere ale piturilor inregistrate in solutiile mai concentrate (continand 20mg/l Cl-) sunt mai catodice decat in cazul testelor executate in solutiile continand 2mg/l Cl-. De exemplu, in cazul otelului SA508, aceste valori sunt urmatoarele:(+67)mV in prezenta a 2mg/l Cl- si (+30)mV in solutia continand 20mg/l Cl-;
- in cazul potentialelor de repasivare a piturilor (Erp), valorile potentialelor inregistrate in solutiile mai concentrate in ioni de Cl- sunt deplasate cu (10÷25) mV spre valori mai negative decat cele inregistratate in solutiile mai diluate de cloruri. De exemplu, in cazul otelului SA516 neacoperit, valorile lui Erp sunt: [(-570)]mV in solutia continand 2mg/l Cl- si respectiv [(-594)]mV in solutia continand 20mg/l Cl-.
|
|
Fig.6[70] Compararea curbelor PC aferente otelului SA516 neacoperit, testat in solutii continand 2mg/l Cl- (PC91) si respectiv 20mg/lCl-(PC171) |
Comparand susceptibilitatea la coroziune pitting a unor probe din acelasi tip de otel carbon, neacoperite si respectiv filmate prin autoclavizare in conditiile de operare ale circuitului secundar, testate in solutii continand aceeasi concentratie de Cl- (de ex.2mg/l Cl-), am constatat urmatoarele:
- potentialul de initiere al pittingului in cazul probelor acoperite (Ebd) de otel carbon este mult mai ridicat decat valorile potentialelor de initiere ale piturilor in cazul probelor nefilmate(Ei)(fig.7 si 8[70]);
- valorile potentialelor Erp sunt deplasate spre valori mai negative in cazul probelor neacoperite comparativ cu cele acoperite, fabricate din acelasi tip de otel;
- suprafata pituita (cea inchisa de bucla de histerezis) este mai mare in cazul probelor neacoperite comparativ cu cele acoperite, observatie care sustine faptul remarcat deja experimental ca probele neacoperite se pituiesc intr-o masura mult mai mare decat cele filmate.
|
|
Fig.7[70] Compararea curbelor PC aferente otelului SA508 neacoperit(PC302) si respectiv filmat(PC282), testat in solutia continand 2mg/l Cl- |
|
|
Fig.8 [70] Compararea curbelor PC aferente otelului SA516 neacoperit (PC91) si respectiv filmat (PC122), testat in solutia continand 2mg/l Cl- |
Examinand comportarea la coroziune pitting a otelurilor carbon filmate initial, supuse polarizarii ciclice in solutiile de NaCl continand doua concentratii diferite in Cl-, am constatat urmatoarele(fig.9[70]):
- cu cresterea concentratiei ionilor de Cl-, potentialele de coroziune s-au deplasat spre valori mai catodice;
- concomitent cu cresterea concentratiei in ioni agresivi, potentialul de initiere al pittingului s-a deplasat spre valori mai mici (in cazul valorilor pozitive) si respectiv spre valori mai catodice in cazul valorilor negative;
- simultan cu cresterea concentratiei in ioni de Cl-, curentii din domeniul pasiv au prezentat valori mai mari cu circa un ordin de marime.
|
|
Fig.9[70] Compararea curbelor PC aferente otelului SA106 filmat, testat in solutii continand 2mg/l Cl-(PC111) si respectiv 20mg/l Cl-(PC21) |
Aparent, probele filmate,testate in solutia de NaCl avand concentratia de 20ppmCl-, nu prezentau pituri, pentru evidentierea lor fiind necesara slefuirea probelor pana la metalul de baza (Fig.10-12).
|
|
|
|
|
Fig.10[70] Zone pituite evidentiate pe proba filmata de otel SA508, polarizata ciclic in solutia continand 20ppm Cl- (x 100) |
|
|
|
Fig.11[70] Zone pituite de pe otelul SA516 filmat, polarizat ciclic in solutia continand 20ppm Cl- (x 100) |
|
|
|
Fig.12[70] Zone pituite de pe otelul SA106 filmat, polarizat ciclic in solutia continand 20ppm Cl- (x 100) |
In figurile 10-12[70] sunt prezentate cateva micrografii ale unor zone pituite de pe cele trei oteluri carbon filmate, supuse polarizarii ciclice in solutia continand 20mg/l Cl-. Pe baza principalilor parametri ai coroziunii pitting, in cazul probelor acoperite, susceptibilitatea la coroziune pitting scade in urmatoarea ordine: SA516, SA508 si SA106.
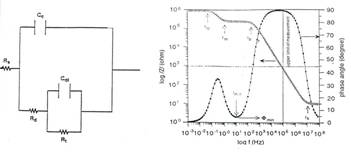
O alta metoda sensibila si eficienta pentru evidentierea diferentelor aparute intre comportarea la coroziune pitting a probelor filmate post-autoclavizare, este metoda spectroscopiei impedantei electrochimice(EIS). In general, raspunsul in impedanta al filmelor formate pe probele de otel carbon, testate in medii contaminate cu diferite concentratii in ioni de clor, poate fi evaluat si ulterior corelat utilizand nu numai curbele caracteristice ale impedantei, ci si circuitele echivalente ale unor filme avand diferite grade de imperfectiuni, prezentate in literatura. Astfel, un circuit echivalent aferent unei suprafete pituite, include urmatoarele componente (Fig.13[71]):
Rs - rezistenta blocului solutiei si a cablurilor electrice;
Rd - rezistenta acoperirii care prezinta defecte;
Rt - rezistenta aferenta proceselor care au loc cu transfer de sarcina;
Cdl - capacitatea stratului dublu electric;
Cc - capacitatea acoperirii(a filmului superficial).
a) b)
Fig.13[71] Circuitul echivalent (a) si curbele EIS(b) aferente filmelor imperfecte formate pe otelurile carbon autoclavizate in medii contaminate
Se stie ca atunci cand o acoperire este perfecta si deci protectoare, curba Bode este caracterizata printr-o singura constanta de timp, panta ei este apropiata de (-1), iar unghiul de faza este apropiat de 90o. Pe masura ce o acoperire imperfecta initial se degradeaza progresiv prin penetrarea electrolitului, curba impedantei va prezenta doua sau mai multe constante de timp. Dintre acestea, prima - asociata frecventelor inalte -, va fi corelata cu proprietatile acoperirii, in timp ce celelalte, de la frecvente mai coborate, vor fi corelate cu gradul de coroziune. Aparitia unuia sau mai multor puncte de inflexiune pe curba Bode si respectiv a mai multor minime pe curba unghiului de faza, indica prezenta unor constante de timp diferite. Punctele de inflexiune care apar in domeniul frecventelor inalte devin mai pronuntate cu cresterea timpului de imersare in solutie. Valoarea coborata a unghiurilor de faza (in jur de 40o) este specifica electrozilor acoperiti cu filme neomogene, care au ca efect o distributie neuniforma a curentilor pe aceste suprafete.
Pentru evidentierea masurii in care ionii de Cl- patrund prin filmele superficiale formate post-autoclavizare, au fost utilizate doua tipuri de masuratori de impedanta:
a) masuratori EIS efectuate pe probele polarizate ciclic in solutiile continand cele doua concentratii in ioni de Cl- si
b) masuratori EIS efectuate pe probele filmate post-autoclavizare in solutia de NaCl continand 2ppm Cl-, dupa diferite perioade de mentinere in solutie a probelor pentru a evidentia gradul de porozitate al filmelor.
Pentru a evidentia masura in care contaminarea cu concentratii variabile de ioni de clor afecteaza caracteristicile filmelor superficiale, in figura 14[70] sunt prezentate comparativ curbele Bode aferente urmatoarelor tipuri de probe, inregistrate dupa mentinerea lor timp de 0,5ore in solutia de (acid boric + borat de sodiu): proba filmata necontaminata; proba filmata supusa polarizarii ciclice in solutia continand 2ppm si respectiv 20ppm Cl-.
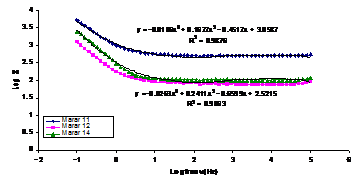
Fig.14[70] Curbele Bode aferente sistemului electrolit/otel SA508 filmat avand urmatoarele stari initiale: (▲)filmat; (♦) polarizat ciclic in solutie cu 2ppm Cl- si ( ) in solutie cu 20ppm Cl-
y =
0.0592x - 0.3477x + 4.1249 R = 0.9323 y =
-0.0028x + 0.0183x - 0.0256x - 0.0238x + 4.397 R = 0.9359 y =
-0.0281x + 0.2649x - 0.7469x + 2.4021 R = 0.9853 Log
frecv (Hz) Log Z Marar
4 Marar
7 Marar
10 marar
15 Poly.
(Marar 4) Poly.
(Marar 7) Poly.
(marar 15)
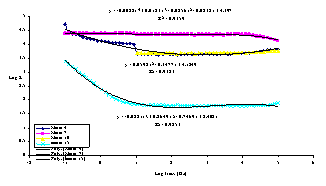
Fig.15[70] Curbele Bode aferente otelului SA 516 filmat inregistrate in:
(x) solutie de (acid boric+borax) si solutie cu 2ppm Cl- dupa urmatoarele perioade de stationare in electrolit:(♦)1/2 ore; (■) 6 ore si (▲) 24 ore
Examinand alura, pozitiile si ecuatiile curbelor din figura 14[70] ca si tipurile circuitelor echivalente alocate acestor curbe, putem conchide urmatoarele:
- filmul format pe proba necontaminata este superior celorlalte doua atat din punct de vedere al caracterului protector fata de metalul de baza cat si al aderentei;
- polarizarea ciclica in solutia continand 2ppmCl- a indus mici modificari in filmul superficial initial necontaminat, printr-o dopare slaba cu ioni de clor.Acest fapt este demonstrat de identitatea circuitelor echivalente, in care doar valorile componentelor difera putin;
- in schimb, polarizarea ciclica in solutia continand 20ppmCl- , a indus modificari importante in compozitia si structura filmului, reflectate in modificarea tipului de circuit echivalent.
Avand in vedere posibilitatea aparitiei accidentale in mediul apos din circuitul secundar a ionilor de clor, s-a considerat interesant studiul caracteristicilor filmelor superficiale de pe cele trei tipuri de oteluri carbon ca urmare a mentinerii probelor in solutia contaminata cu 2ppm ioni de clor, perioade cuprinse intre 0,5 ore si 24ore. Acest experiment a constat in inregistrarea curbelor de impedanta dupa fiecare perioada de mentinere in solutia contaminata, fitarea de curbe teoretice cat mai apropiate de cele experimentale si in final, alocarea de circuite echivalente.
Curbele Bode prezentate in figurile 14-15[70] corespund masuratorilor EIS efectuate in solutia de (acid boric + borax) pe otelurile carbon filmate prin autoclavizare in conditiile specifice de operare ale circuitului secundar si respectiv acelorasi probe filmate, mentinute diversi timpi in solutia contaminata cu 2ppmCl-. Examinand pozitiile curbelor, ecuatiile lor si circuitele echivalente corespunzatoare, putem conchide urmatoarele:
- probele filmate necontaminate prezinta o variatie normala a impedantei functie de frecventa, diferita de celelalte categorii de probe;
- mentinerea in solutia contaminata a probelor filmate perioade de timp mai mari de 6 ore, a condus la doparea filmelor cu ioni de clor, proportional cu marimea perioadei de stationare in solutie.
Deci, studierea prin metoda impedantei a filmelor superficiale formate pe probele prelevate din diverse oteluri, supuse ulterior testelor de pituire, a evidentiat urmatoarele aspecte:
- filmul superficial cel mai protector s-a format pe otelul carbon cel mai putin susceptibil la coroziune pitting - SA106-, la extrema cealalta situandu-se otelul SA516;
- caracteristicile EIS (valoarea maxima a impedantei, unghiul maxim de faza, etc.) aferente sistemelor formate din oteluri carbon filmate perioade mai indelungate de autoclavizare, mentinute in electrolitul inert, nu se modifica cu cresterea perioadei de stationare a probelor in solutia de electrolit. In schimb, curbele EIS corespunzatoare acelorasi probe filmate, testate in solutia aditivata cu 2mg/l ioni de clor, se prezinta modificate si decalate comparativ cu cea aferenta sistemului proba filmata/ solutie inerta de electrolit.De aici rezulta ca mentinerea chiar si a probelor filmate in solutia contaminata a indus schimbari in porozitatea si structura filmului, care s-au reflectat pe curbele de impedanta.
3. Consideratii referitoare la mecanismele coroziunii pitting
Examinand curbele rezultate in urma aplicarii metodei impedantei electrochimice unor sisteme formate din otel carbon aflat in stare de livrare (neacoperit)/ solutii continand diversi contaminanti producatori de coroziune pitting, cativa cercetatori au imaginat - pe baza circuitelor echivalente alocate interfetelor respective - unele mecanisme aplicabile in procesele respective.
Un circuit echivalent simplu, aplicabil probelor nefilmate, este prezentat in figura 16a,b[71]. Semnificatia componentelor din acest circuit este urmatoarea: Rs-rezistenta ohmica a electrolitului; Rp-rezistenta ionica datorata porilor; ZW-impedanta difuziei (care apare din limitarea datorata transportului de masa); Cdl-capacitatea stratului dublu electric.
|
|
Fig.16[71] Circuitele echivalente ale sistemelor metal nefilmat / solutie in care: a) reactiile au loc sub controlul preponderent al transferului de sarcina; b) sub controlul preponderent al difuziei |
Presupunand ca Rs(RW) si Cdl sunt independente de frecventa, Sagues[72] a prezentat o alta varianta mai complexa a unui circuit echivalent metal neacoperit/ solutie coroziva (Fig.17), care include impedanta anodica (Za) si respectiv catodica (Zc).
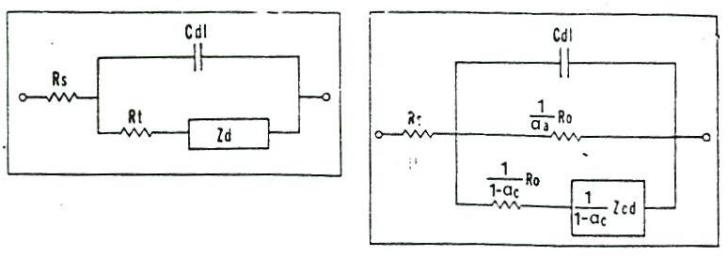
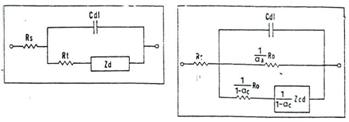
a) b)
Fig.17a,b[72] Circuitele echivalente aferente sistemelor metal neacoperit/ solutie coroziva: a)sub control faradaic si b) sub control mixt: polarizare de concentratie si control faradaic
In cazul probelor acoperite cu filme superficiale, efectuarea de masuratori de impedanta dupa diferite perioade de mentinere in solutie a probelor este justificata, deoarece cu cresterea periodei de imersare in solutie, rezistenta de polarizare a filmelor scade concomitent cu cresterea minimului unghiului de faza corespunzator curbei Bode. Aceasta comportare se datoreste patrunderii ionilor agresivi din solutie prin film, care are ca rezultat cresterea conductivitatii acoperirii si implicit scaderea proprietatilor adezive film/metal, conform mecanismului prezentat de Miszczyk in figura 18[73].
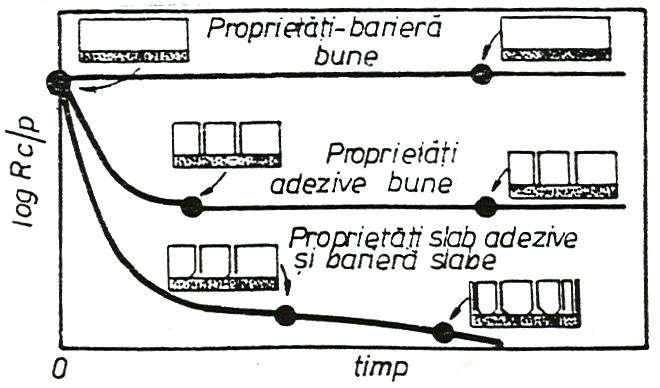
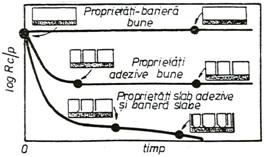
Fig.18[73] Ilustrarea influentei perioadei de stationare a probelor in solutie asupra proprietatilor adezive ale filmelor imperfecte
Mecanismele implicate in coroziunea pitting se refera la cele doua etape principale ale coroziunii pitting si anume: initierea si respectiv cresterea piturilor [74].
3.1.Etapa de initiere a piturilor
Etapa de initiere a piturilor nu este f.bine elucidata. Ea poate dura de la o perioada foarte scurta de timp - cateva zile -, pana la perioade foarte lungi - cativa ani -. Mici diferente aparute in conditiile de mediu pot atrage dupa ele pituirea sau nu a metalului. Mecanismul de initiere este specific fiecarui tip de sistem metal/ mediu.
In cazul metalelor acoperite cu filme de compusi, mecanismul de initiere implica ruperea acestui film. Exista mai multe teorii referitoare la mecanismul de initiere al piturilor pe metalele acoperite cu filme pasive si anume: teoria existentei unor defecte in filmul superficial, teoria dizolvarii ionului de Cl-, teoria peptizarii, a celulelor locale, a stresului indus, a vacantelor si cea a ruperii si ulterior a repararii filmului.
a) Teoria existentei unor defecte
Unii cercetatori au aratat ca defectele existente in unele filme pot fi puse in relatie cu defectele existente in metal, ca de exemplu dislocatiile care apar la limitele granulelor sau cele care apar prin clivajul unor zone superficiale. Aceste zone vor deveni anozi locali in care se va produce ruperea filmului. Aceasta nu constituie o regula generala, desi in cazul unor metale s-a observat ca exista o relatie intre preexistenta defectelor si apartia piturilor.
b) Dizolvarea clorurilor
Multe cloruri metalice sunt solubile in apa. Aceasta teorie sugereaza faptul ca la interfata solutie/ film pasiv, ionul de clor poate fi inlocuit de ionul hidroxil, care va forma o clorura metalica solubila in solutie. Un alt ion de clor va urma acelasi traseu si astfel procesul va continua pana cand metalul va ramane complet lipsit de film. Urmatorii ioni de clor, care vor veni in contact cu metalul de pe care a disparut filmul, vor forma primele pituri pe suprafata acestuia. Cu alte cuvinte, acest mecanism prezice ca indata ce un pit s-a format, el va continua sa creasca.
c) Teoria peptizarii
Aceasta teorie este similara cu cea de la punctul (b), cu diferenta ca ionul de clor va difuza prin filmul pasiv pana la suprafata metalului de baza, unde va cauza dizolvarea metalului. Ceilalti ioni de clor care vor sosi ulterior, vor difuza si ei prin film, intretinand astfel cresterea piturilor. Diferenta dintre acest mecanism si cel de la subpunctul (b) consta in localizarea procesului si anume, in timp ce peptizarea are loc la interfata metal/ strat pasiv, dizolvarea clorurilor are loc la interfata strat pasiv/ solutie.
d) Teoria celulelor locale
In multe aliaje exista faze secundare care au o comportare electrochimica diferita de cea a restului metalului, unele avand un caracter anodic in raport cu matricea, iar altele avand un caracter catodic.
e) Teoria stresului
Pe masura ce filmele pasive cresc, in ele sunt induse stresuri, deoarece grauntii lor au alte dimensiuni decat cele ale cristalitelor metalului de baza pe care s-au format. In acest context, ruperile locale ale filmului, concomitent cu prezenta ionilor de clor, constituie factorii care pot promova dizolvarea metalului.
f) Teoria vacantelor
Pentru ca un film pasiv sa se formeze, trebuie ca ionii metalici (cationii) sa difuzeze de la interfata metal/ film pasiv la interfata film pasiv/ solutie. In urma difuziei cationilor va apare si o difuzie a vacantelor cationice prin interfata metal/ film. Daca acest lucru se va intampla cu suficient de multe vacante, atunci se va crea un gol de-a-lungul axei concentrarii stresului. Aceasta concentrare a stresului combinata cu stresul creat in film poate conduce la ruperea filmului si implicit la initierea pittingului.
g) Ruperea si repararea filmului
Toate teoriile sus-mentionate presupun existenta unui film static anterior ruperii. Una dintre cele mai recente teorii presupune ca filmul pasiv este un sistem dinamic. Aceasta ultima teorie presupune ca intr-o zona a filmului se produce o rupere a acestuia printr-unul din mecanismele sus-amintite. Filmul are, insa, si capacitatea de a se autorepara, situatie care se produce destul de des. Totusi, cand va exista o anumita combinatie intre grosimea filmului si concentratia ionilor de clor, filmul nu se va mai putea repara si in acel moment va apare un pit. In alte zone ale filmului va fi initiat, de asemenea, un alt pit si in timp ce unele pituri vor creste, altele se vor repara. Acest model sustine ipoteza conform careia procesele de coroziune au un caracter dinamic.
3.2.Etapa de crestere a piturilor
Din punct de vedere mecanic, cresterea unui pit poate fi privita ca fiind similara procesului de coroziune in crevasa, deoarece suprafata expusa a pitului, din afara pitului care creste, este protejata catodic, intrucat pe ea are loc reactia de reducere a oxigenului la ion hidroxil:
O2 + 2H2O +4e- 4(OH-) (1)
Deoarece in acest mod este protejata catodic zona dinafara pitului, regiunea in care are loc dizolvarea metalului nu se poate extinde pe restul suprafetei din jur. In plus, aceasta suprafata catodica mare poate mentine aceasta reactie si da nastere unui raport catod mare/ anod mic, care va accelera reactia anodica. In pit, care, in general, este privit ca o mica emisfera in aceasta etapa, va avea loc reactia de dizolvare a metalului, care este o reactie anodica de forma:
M Mz+ + ze- (2)
Totusi, aceasta fiind unica reactie din pit, ea va crea un nou dezechilibru, care va genera alti ioni negativi, in special ioni de clor. In urma reactiei autocatalitice care va avea loc in pit, se va forma HCl si astfel pituirea va continua:
Mz+Cl-z + zH2O M(OH)z + z(H+Cl-) (3)
Deci, pittingul, ca si coroziunea in crevasa, este o reactie autocatalitica, care indata ce a fost initiata, va conduce la scaderea pH-ului, in timp ce concentratia de ioni clor din pit se va mari [74].
In figurile 19 si 20 sunt prezentate schematic curbe potentiodinamice care ilustreaza comportarea unui metal care prezinta o slaba rezistenta la coroziune pitting (fig.19) si respectiv a altuia care este rezistent la acest tip de coroziune(fig.20)[74].
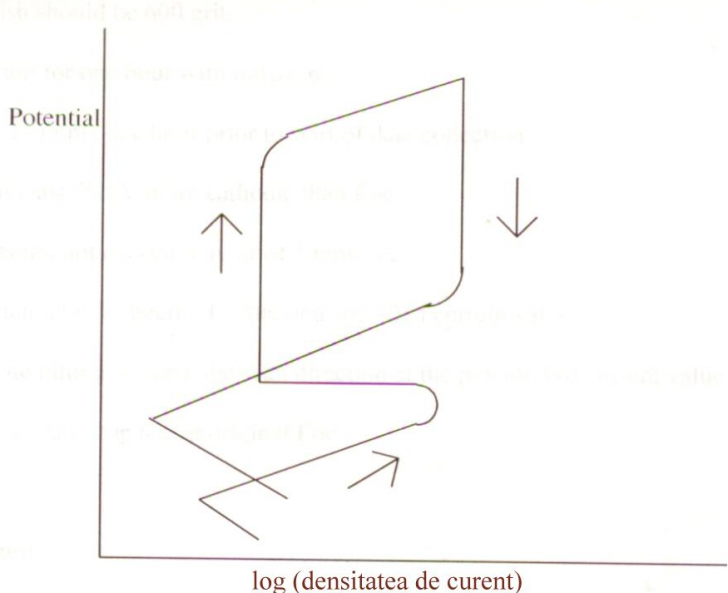
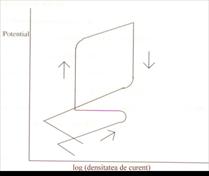
Fig.19[74] Curba potentiodinamica specifica unui metal rezistent la pitting
Conform lui Green si Fontana[75], pe masura avansarii pittingului, fie piturile mici se largesc, fie apar mai multe pituri pe suprafata, rezultand astfel o descrestere a raportului real intre suprafetele catodice si anodice. Aceasta conduce ulterior la o crestere a polarizarii catodice, asa incat se poate concluziona ca pittingul rezultat ca urmare a imersiei intr-un electrolit agresiv este un proces controlat catodic.
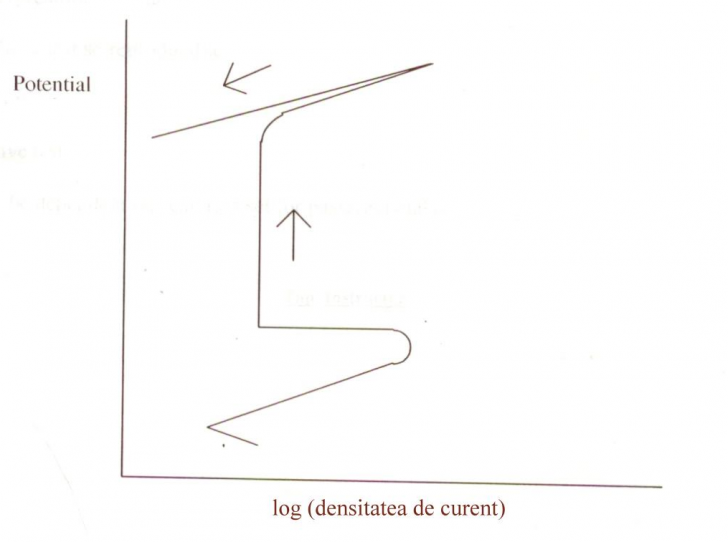
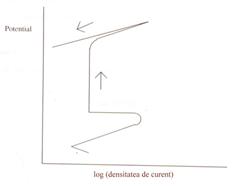
Fig.20[74] Curba potentiodinamica specifica unui metal
slab rezistent la pitting
Shibata a prezentat in figura 21[76] schema formarii si cresterii piturilor in conditii potentiostatice.
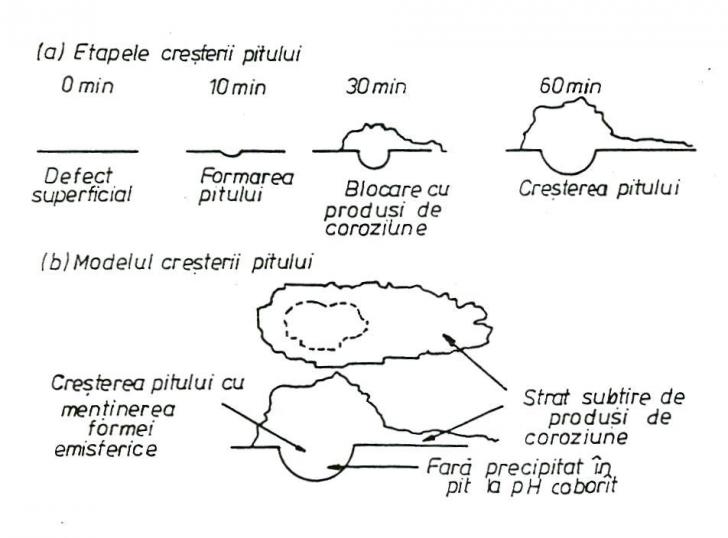
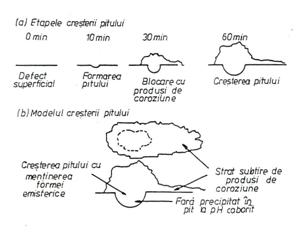
Fig.21[76] Etapele pituirii otelurilor carbon
Szklarska- Smialowska[31] a aratat ca potentialul in pit - in stadiul initial al formarii pitului - nu este foarte diferit de cel al metalului pasiv din jur. La potentiale anodice inalte, dizolvarea poate avea loc numai la curenti-limita inalti, corespunzatori dizolvarii metalului, dizolvare cauzata de concentratia inalta de Cl- si pH-ul coborat din anolitul pitului. Pe masura ce potentialul la fundul pitului scade gradat comparativ cu potentialul de la suprafata electrodului exterior, incepe dizolvarea activa in pit, care are loc in domeniul curentilor-limita. In cazul coroziunii spontane si a prezentei unui cuplaj chimic redox, dupa o ora de la inceperea experientei incep sa apara din pituri bule de gaz, care au fost identificate a fi bule de H2. S-a gasit ca potentialul masurat la fundul unui pit format pe suprafata unei probe din otel carbon este egal cu (-0,21)V (SHE), chiar in conditiile unui potential aplicat egal cu (+1,2)V (SHE).
Dupa o perioada de incubare asociata generarii micropiturilor, apar picuri sau fluctuatii ale curentului datorate cresterii si respectiv repasivarii micropiturilor. Acest stadiu, caruia ii corespund picuri de curent, include trei etape: ruperea filmului, stadiul timpuriu de crestere al pitului si repasivarea. Stadiul timpuriu de crestere al pitului a fost numit de catre Gabrielli[77] stadiul de pituire propriu-zis, din cauza ca el include generarea si repasivarea micropiturilor pana in momentul atingerii stadiului tarziu de crestere al pitului, care conduce la formarea unui macropit.
In cazul metalelor acoperite cu filme de compusi, prima etapa - cea de rupere a filmului pasiv - se caracterizeaza printr-o nucleere intamplatoare a pittingului. In timp ce acest proces de nucleere a pittingului asculta de o distributie Poisson, dupa generarea piturilor, acestea cresc conform unor legi electrochimice de viteza.
Brown[78] a studiat modul in care viteza solutiei afecteaza potentialul de pituire(Epit), aratand ca valoarea potentialului creste cu cresterea vitezei fluidului, in cazul unui regim laminar de curgere, dar descreste in cazul unei curgeri turbulente. Este necesara o analiza exacta a efectului vitezei electrolitului asupra valorii potentialului de pituire(Epit) pentru a intelege procesul generarii piturilor. Analiza statistica a demonstrat ca cresterea vitezei solutiei conduce la cresterea lui Epit, sugerand, de fapt, ca procesul de repasivare al piturilor este controlat de un proces de transport de masa intr-un micropit [76].
Pe baza datelor experimentale, s-a presupus ca chimia solutiei dintr-un micropit joaca un rol important in accelerarea generarii piturilor. Williams[79] a remarcat ca acidifierea locala datorata fluctuatiei curentului pasiv impulsioneaza ruperea filmului pasiv, care conduce la generarea de noi pituri, iar rugozitatea suprafetei si grosimea stratului-limita controleaza acidifierea locala. Faptul ca viteza repasivarii piturilor este independenta de potentialul aplicat si este slab dependenta de temperatura, confirma presupunerea ca repasivarea este controlata de un proces de transport de masa. In concluzie, este, foarte posibil ca generarea piturilor sa fie decisa, in principal, de proprietatile filmului, in timp ce repasivarea piturilor este puternic afectata de conditiile locale de mediu.Viteza medie de crestere a piturilor difera mult de vitezele instantanee datorita degajarii bulelor de H2 sau miscarii acestora in pit. S-a aratat ca depunerea de la fundul pitului, care se inalta treptat in decursul pituirii, a fost cauzata de bulele de H2, care au dat nastere unor cai de inalta rezistenta, responsabile de o cadere IR mare[80].
Pentru masurarea variatiei in timp a potentialului, se poate utiliza, de asemenea, tehnica galvanostatica(GS) cu ajutorul careia se pot determina diverse potentiale de interes, mentinand constante densitatile de curent aplicate. Valoarea potentialului respectiv este atinsa cand se observa ca curba potential/ timp tinde asimptotic spre zero. In acest mod se pot determina valorile lui Ebd si respectiv Erp , metoda fiind descrisa in ASTM G100[81].
Asa cum s-a aratat, initierea unui pit este indicata printr-o crestere a curentului. Intr-un alt tip de reprezentare - cea potentiostatica -, initierea piturilor este indusa intentionat prin aplicarea unui potential de "stimulare" mult mai mare decat Ebd, care este readus apoi rapid la potentialul preselectat sub acea valoare. Daca acest al doilea potential aplicat este situat deasupra potentialului de repasivare(Erp), propagarea piturilor existente va continua si implicit curentul va creste. In schimb, la potentiale situate sub Erp, piturile se vor repasiva, iar curentul va scadea ulterior in timp. Principala semnificatie a lui Erp consta in faptul ca valoarea lui reprezinta un parametru predictiv utilizabil in proiectare datorita dependentei lui de cresterea piturilor formate anterior. Avand in vedere ca valoarea lui Erp depinde de marimea pitului crescut anterior, rezulta ca el nu poate fi folosit ca un parametru conservativ. Daca Erp ar putea fi determinat independent de cresterea anterioara a pitului, el ar reprezenta acel potential sub care pituirea nu s-ar produce [68]. In cazul initierii de pituri multiple pe probe, densitatea de sarcina conditioneaza ambele procese: cresterea piturilor existente si initierea de noi pituri.
Pentru a studia influenta pH-ului asupra valorilor parametrilor specifici ai coroziunii pitting, Sridhar[68] a executat teste la 95oC, pH-ul fiind ajustat prin adaugarea unor cantitati de HCl. El a presupus ca repasivarea se produce cand valoarea potentialului masurat in exteriorul pitului - in afara pitului - are o asemenea valoare incat valoarea aceluia din interiorul pitului (din zona cea mai adanca) se afla sub valoarea lui Ecor specifica sistemului metal/ solutie de pituire. Diferenta dintre valorile potentialului exterior si interior este dependenta de caderea ohmica de potential (IR), datorita faptului ca solutia din interiorul pitului are o compozitie diferita de cea din restul blocului solutiei. Potentialul de dezactivare este, conform lui Starr[20], acea valoare sub care metalul este termodinamic stabil, iar potentialul de repasivare este potentialul sub care materialul - instabil din punct de vedere termodinamic - se va acoperi cu un film pasiv, care il va proteja.
Sridhar[68] a presupus ca repasivarea s-ar putea produce datorita modificarii chimismului solutiei din pit, care are loc fie prin generarea unui pH mai mare, fie prin crearea unei concentratii mai mici de ioni Cl-. Conform aceleasi aproximari, procesul invers - de crestere a pitului sau a crevasei - s-a produs printr-o coroziune activa, datorata fie unei cresteri in concentratia ionilor Cl-, fie unei descresteri a pH-ului. Cresterea concentratiei ionilor de Cl- poate conduce in final la saturarea solutiei din pit si implicit la formarea unei sari metalice pe peretii pitului [83]. Scaderea valorii potentialului zonei din exteriorul pitului va conduce la micsorarea curentului care a initiat pitul, producand astfel, implicit, o scadere a concentratiei ionilor de Cl- sub valoarea critica necesara pentru cresterea pitului, aparand astfel conditii propice pentru repasivarea pitului. De asemenea, cu cat valoarea lui Erp este mai mare, cu atat mai usor se va repasiva metalul. La potentiale cuprinse intre Ebd si Erp, are loc propagarea piturilor initiate anterior. Aceste argumente favorizeaza metalele care au ambele potentiale - Ebd si Erp - inalte. Imprastierea valorilor acestor potentiale semnifica natura statistica a nucleerii pittingului. In cazul inregistrarii inverse, imprastirea este mult mai mica, intrucat chimia locala controleaza repasivarea.
Cercetatorii au incercat, de asemenea, corelarea marimii buclei de histerezis cu gradul de susceptibilitate la coroziune localizata. Conform acestei aproximari, cu cat bucla de histerezis este mai mare, cu atat este mai probabil ca sa aiba loc propagarea piturilor deja initiate.
Desi interpretarea valorilor lui Ebd si Erp ramane controversata, au fost inregistrate, totusi, progrese legate de interpretarea gradului lor de imprastiere. Imprastierea mare constatata in valorile lui Ebd si dependenta acestora de viteza de baleiere s-a presupus ca este datorata dependentei modului de initiere al piturilor de starea initiala a suprafetei. Perioada de timp dupa care se produce initierea piturilor este puternic dependenta de chimismul zonei in care s-a produs coroziunea localizata. In plus, beneficiarii instalatiilor rezistente la coroziune utilizeaza ca parametru de baza nu valorile lui Ebd, ci anumite valori ale lui Erp, deoarece acestea din urma reprezinta potentialele sub care are loc repasivarea piturilor. Avand in vedere aceasta cerinta, accentul s-a pus pe determinarea unor valori cat mai exacte ale lui Erp. Incercandu-se corelarea perioadei in care se produce atacul localizat cu viteza de baleiaj a potentialului, s-a ajuns la concluzia ca acest timp este invers proportional cu marimea vitezei de baleiaj, un atac mai mic aparand atunci cand au fost folosite viteze mai coborate de baleiaj.
Un alt obiectiv urmarit a fost stabilirea unei corelatii intre variatia valorilor potentialului de pitting cu temperatura, cu concentratia ionilor de Cl- si cu timpul scurs anterior expunerii in apa la temperatura inalta.
Straturile de oxizi formate in apa la temperatura inalta sunt cu cateva ordine de marime mai groase decat filmul pasiv initial; conform literaturii, ele sunt imperfecte, continand pori sau fisuri [84]. Se stie ca structura defectelor din filmul preexistent este importanta nu numai din punct de vedere al numarului de pori (np) rezultati, ci si din punct de vedere a integritatii mecanice a filmului. Pentru a permite nucleerea unui pit, este necesara mai intai ruperea profunda a filmului. Aceasta rupere se produce preferential pe defectele existente in materialul de baza sau in alte zone susceptibile. De aici rezulta necesitatea ca filmul de oxid preexistent sa fie cat mai lipsit de imperfectiuni, dintre care cele mai importante sunt: incluziunile nemetalice, precipitatele din faza secunda, limitele granulelor, zgarieturile, dislocatiile si alte neomogenitati superficiale, care pot deveni locuri de initiere ale pittingului (fig.22)[84].
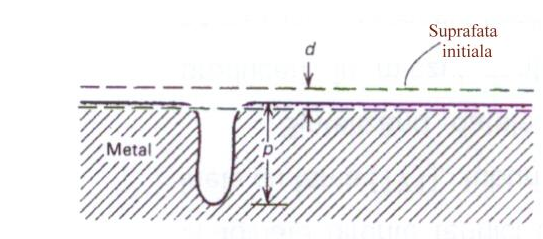
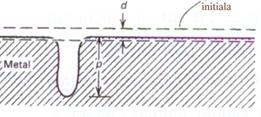
Fig.22[84] Tipul de masuratoare folosita pentru determinarea factorului de pitting p/d, in care "p" este penetratia maxima, iar "d" este penetratia medie
Timpul de inductie care se scurge inainte de initierea piturilor poate varia de la zile la ani. Timpul de inductie depinde de metal, de agresivitatea mediului si de potential. Timpul de inductie tinde sa scada atunci cand potentialul sau concentratia speciilor agresive creste. Odata piturile initiate, ele continua sa creasca printr-un proces autocatalitic (adica conditiile de coroziune din pit sunt atat stimulatoare cat si necesare pentru continuarea cresterii pitului). Cresterea pitului este controlata de viteza depolarizarii in ariile catodice. Oxigenul din mediile apoase si prezenta FeCl3 in diferite medii industriale constituie depolarizatori eficienti.
Deci, pentru ca aceasta distrugere(intrerupere) a filmului sa aiba loc, este necesara existenta unui potential critic(Eb), a unui timp de inductie derulat la un potential mai mare decat valoarea potentialului critic Eb, a prezentei unor specii agresive(Cl-, Br-, ClO-4, etc) si a unor locuri discrete de atac. Conform modelului propus de Bianchi[17], intr-o solutie contaminata cu ioni de Cl-, nucleerea piturilor ar putea fi controlata de transportul ionilor de Cl- prin reteaua filmului de oxid. In acest context, el a corelat mecanismul conductiei electronice prin retea cu mecanismul conductiei ionice, astfel: conductia tip "p", facandu-se prin intermediul vacantelor cationice din subretea, va permite transportul cationilor, in timp ce conductia tip "n" va fi corelata cu transportul anionilor. Aceasta ipoteza urmeaza sa fie verificata de la caz la caz, functie de tipul de oxid luat in considerare. De exemplu, magnetita (Fe3O4), care este un semiconductor tip "n", desi are o conductivitate electrica foarte mare la temperatura ambianta, totusi transportul de masa in retea poate fi afectat de cationi. In consecinta, contributia anionilor la transportul de masa poate fi neglijat. Conform celor aratate mai inainte, coeficientul de difuzie al oxigenului in Fe3O4 ar trebui sa fie cu cateva ordine de marime mai mic decat coeficientul sau de difuzie in fier, ceea ce contravine unor rezultate experimentale; in consecinta, aplicabilitatea generala a modelului lui Bianchi este discutabila.
De aceea, in aprecierea corecta a speciei incarcate electric care difuzeaza - cation sau anion-, trebuie luata in considerare si marimea conductivitatii electrice a filmului respectiv.
Daca se pleaca de la premiza ca cei care au difuzat preponderent prin reteaua filmelor superficiale formate pe otelurile carbon au fost anionii (Cl- in cazul nostru), aceasta difuzie ar fi putut avea loc pe doua trasee: prin vacantele anionice sau prin defectele retelei filmului pasiv.
In ipoteza difuziei prin defectele filmului, se pune problema in ce conditii si care au fost cauzele distrugerii initiale partiale ale filmului pasiv.
O alta ipoteza emisa a fost modificarea proprietatilor semiconductoare ale filmelor pe parcursul expunerii lor in continuare in diverse medii contaminate. Astfel, Bianchi[80] a atribuit cresterea valorii lui "np" in cazul otelurilor carbon unei conductivitati initiale de tip "n" a stratului de oxid preexistent. Totodata, acest efect poate fi explicat si prin instabilitatea termica a filmului initial pasiv, care poate conduce ulterior - in decursul tratamentelor termice - la o structura cu defecte, care are o sensibilitate marita la nucleierea piturilor.
In urma testelor executate la temperatura camerei in vederea determinarii susceptibilitatii la coroziune pitting a diverselor materiale, Bianchi [80] a constatat ca s-au format putine pituri adanci, toate avand gurile inguste. Suprafata probelor dupa testare arata practic necorodata. Gurile piturilor erau inconjurate de o scala alba, iar cavitatile piturilor nu contineau produsi de coroziune; in schimb, peretii piturilor prezentau un atac cristalografic destul de marcant.
Frankel a observat ca piturile metastabile formate pe otelurile carbon sunt acoperite cu filme pasive, "acoperisurile" reprezentand remanente ale filmului pasiv sau ale stratului de oxid superficial preexistent [85]. Probabil ca aceste "acoperisuri" au fost suficient de poroase daca au permis trecerea electrolitului spre pit si a ionilor metalici in afara pitului. In general, "acoperisurile" piturilor actioneaza ca bariere in calea difuziei, protejand piturile metastabile in solutii concentrate. In plus, rezistenta ohmica a porilor prezenti sub aceste "acoperisuri" stabilizeaza dizolvarea activa in piturile aflate chiar in apropierea ariei pasive. Proprietatile "acoperisurilor" piturilor si implicit ale filmului initial sunt cruciale nu numai in nucleerea piturilor, ci si in stabilizarea si cresterea lor. Astfel, cresterea piturilor poate fi afectata de pretratarile probelor. In concluzie, un "acoperis" avand o inalta integritate mecanica faciliteaza stabilitatea piturilor, permitand doar cresterea piturilor metastabile pana la dimensiuni usor observabile.
Intelegerea mecanismelor pituirii si corelarea lor cu situatiile reale intalnite in practica poate constitui o modalitate de prevenire/ micsorare a proportiei de echipamente metalice care pot fi afectate de acest tip de coroziune asa de insidios si periculos - coroziunea pitting.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |