Viteza reactiei de electrod
Viteza unei reactii electrochimice (de ex. catodica):
O + ze- R (1)
poate fi exprimata prin intermediul legilor electrolizei ale lui Faraday. Astfel, numarul de moli de substanta transformata, n, este echivalent cu cantitatea de energie electrica consumata, Q:
![]()
unde Q este definita de integrala:
Q = ò I dt, (3)
sau, pentru cazul operarii galvanostatice (la curent constant):
Q = I∙t, (3a)
astfel ecuatia (2) devine:
![]() (2b)
(2b)
Daca scriem ultima ecuatie sub forma unei diferentiale dependenta de timp, obtinem ecuatia vitezei de reactie:
![]() (2c)
(2c)
care se exprima in [mol∙s-1].
Datorita specificului reactiilor electrochimice de a se desfasura eterogen, este mai convenabil sa se exprime viteza de reactie raportata la suprafata, A, a electrodului:
![]() (4)
(4)
Densitatea de curent este o marime specifica proceselor electrochimice si se defineste prin relatia:
![]() (5)
(5)
astfel, ecuatia (4) se poate scrie:
![]() (4a)
(4a)
Ecuatia (4a) reprezinta bilantul de materiale si de electroni al interfetei electrodice si este, de fapt, un flux, N, care se poate reprezenta prin relatia:
![]() (6)
(6)
Unitatea de masura pentru fluxul N este [mol∙m-2∙s-1]. Viteza procesului poate fi raportata si la volumul RE, VR:
![]() (7)
(7)
Aceasta viteza se va numi in continuare viteza volumica, iar unitatea de masura a vitezei fiind [mol∙m-3∙s-1],
Randamentul faradaic (rF) se poate defini fie prin raportul dintre cantitatea de energie consumata pentru obtinerea produsului dorit (Q) si cantitatea totala de energie consumata (Ototal):
![]() (8)
(8)
fie prin raportul intensitatilor :
![]() (8a)
(8a)
tinand cont de rF ecuatia (2c) devine:
![]() (9)
(9)
Din considerente practice, este mult mai convenabil sa apelam la concentratia, C, a speciei care participa la reactia de electrod:
![]() (10)
(10)
caz in care, impartind ecuatia (9) cu VR, se poate scrie:
![]() (11)
(11)
sau:
![]() (11a)
(11a)
care este o noua expresie a vitezei volumice.
Prin impartirea ecuatiei (6) cu C rezulta:
![]() (12)
(12)
Daca procesul este controlat de transportul de masa, desfasurandu-se cu viteza mai mica fata de etapa de transfer de sarcina, adica la intensitatea de curent limita, (IL), atunci:
![]() (13)
(13)
ceea ce permite definirea notiunii de coeficient de transport de masa:
![]() (14)
(14)
care reprezinta fluxul de transport de masa raportat la concentratia din zona de volum a reactorului.
Daca se exprima viteza de reactie de electrod ca in cazul unei reactii chimice de ordinul r, atunci:
![]() (15)
(15)
Sa consideram cazul in care reactia (1) se desfasoara pe un catod pozitionat, intr-o reprezentare unidirectionala, la x = 0 atunci vom putea scrie:
![]() (16)
(16)
unde ![]() este o constanta
de viteza in sens catodic, desigur, pentru reactii de ordinul
intai. Este necesar sa facem distinctie intre
concentratia speciei O pe catod, (CO)x=0, si
concentratia din zona de volum a aceleiasi specii, CO,
deoarece, in momentul declansari reactie (1), daca
solutia de electrolit nu este agitata, concentratia (CO)x=0
va scadea, devenind diferita de CO.
este o constanta
de viteza in sens catodic, desigur, pentru reactii de ordinul
intai. Este necesar sa facem distinctie intre
concentratia speciei O pe catod, (CO)x=0, si
concentratia din zona de volum a aceleiasi specii, CO,
deoarece, in momentul declansari reactie (1), daca
solutia de electrolit nu este agitata, concentratia (CO)x=0
va scadea, devenind diferita de CO.
Pe de alta parte, daca exprimam viteza aceluiasi proces de electrod prin intermediul coeficient de transport de masa, km , vom avea:
![]() (17)
(17)
iar din (16) si (17) rezulta:
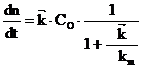 (18)
(18)
Analizand ecuatia (18), distingem doua cazuri:
(i) ![]() << km, cand etapa lenta este
reprezentata de transferul de sarcina, (procesul global este
controlat de aceasta), viteza poate fi scrisa:
<< km, cand etapa lenta este
reprezentata de transferul de sarcina, (procesul global este
controlat de aceasta), viteza poate fi scrisa:
![]() =
= ![]() ∙Co
(19)
∙Co
(19)
(ii) ![]() >> km, cand etapa lenta este
reprezentata de transportul de masa, (procesul este controlat de
acesta), atunci 1 +
>> km, cand etapa lenta este
reprezentata de transportul de masa, (procesul este controlat de
acesta), atunci 1 + ![]()
![]() , iar viteza poate fi scrisa:
, iar viteza poate fi scrisa:
![]() = km Co (20)
= km Co (20)
Cazul (i) poate fi dezvoltat pe baza cineticii electrochimice a proceselor controlate de transferul de sarcina, respectiv ecuatia Butler-Volmer. În acest caz, realizarea unei viteze ridicate (densitate de curent mare) presupune un suprapotential mare. Din contra, daca procesul de electrod este caracterizat printr-o densitate de curent de schimb (io) mare (electrocataliza), se poate asigura o viteza apreciabila a reactie in conditiile unei polarizari mai scazute.
Pentru un proces de electrod controlat de transferul de sarcina, se poate realiza un randament de curent ridicat daca reactia de electrod de interes este electrocatalizata (io mare), iar reactia secundara, nedorita, este "otravita" (io mic).
Pentru a creste viteza reactiei de electrod in cazul (ii) se poate apela la un transport de masa intensificat la suprafata electrodului. Acest caz este foarte des intalnit in cazul proceselor electrochimice aplicate la rezolvarea problemelor de mediu, cand trebuie tratate, in special, solutii diluate.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |