
ENTROPIA. INTEGRALA LUI CLAUSIUS
Pornind de la constatarea ca toate procesele reale sunt ireversibile si ca transformarile de energie au loc in sensul caderii de potential s-a pus problema ca proprietatea de reversibilitate a proceselor reale ar trebui sa fie exprimabila cu ajutorul unei marimi fizice masurabile, care sa inregistreze si ea modificari numai intr-o singura directie si sa caracterizeze starea sistemului.
Aceasta marime fizica a fost introdusa in anul 1865 de catre Clausius sub denumirea de entropie si masoara sensul preferential al transformarilor termice, ireversibilitatea unui proces termodinamic si stabilitatea sistemului termodinamic. Ea este o masura de stare extensiva si poate fi definita ca fiind energia schimbata la temperatura la care se produce acest schimb.
Pornind de la expresia randamentului ciclului Carnot:
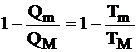
si tinand seama ca Qm reprezinta caldura cedata si este negativa rezulta:
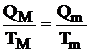 (4.12)
(4.12)
Pentru generalizare se imparte o transformare ciclica reversibila (fig.4.3) intr-o infinitate de cicluri elementare, prin transformari adiabatice:
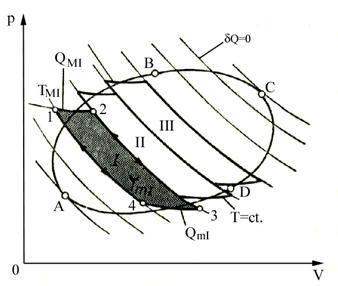
Un ciclu elementar absoarbe cantitatea de caldura ![]() respectiv cedeaza caldura
respectiv cedeaza caldura ![]()
Daca portiunile din ciclul real se inlocuiesc cu portiunile elementare de izoterme la temperaturile medii T1 si T2, se obtin cicluri elementare Carnot pentru care:
Fig.
4.3 Ciclu reversibil constituit
dintr-un numar mare de cicluri Carnot
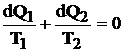 (4.13)
(4.13)
Integrand aceasta relatie intre punctele A si C unde adiabatele limita sunt tangente la conturul dat, rezulta:
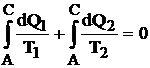 (4.14)
(4.14)
Suma acestor integrale, luate de-a lungul ciclului reprezinta integrala de contur:
![]() (4.15)
(4.15)
Aceasta integrala este cunoscuta sub denumirea de integrala lui Clausius. Intr-un ciclu reversibil integrala lui Clausius este nula, de unde rezulta ca expresia de sub integrala este diferentiala unei functii de stare care este entropia.
Deci entropia:
![]()
sau explicit:
![]() (4.16)
(4.16)
relatie care reprezinta expresia matematica a principiului al doilea al termodinamicii pentru schimbari de stare reversibile ale sistemului.
Intr-un proces reversibil deschis variatia de entropie va fi:
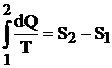 (4.17)
(4.17)
Relatia (4.17) nu permite determinarea valorii absolute a entropiei, ci exprima numai variatia de entropie. Pentru rezolvarea problemelor practice, originea pentru entropie se alege convenabil (ex: pentru abur este avantajos sa se aleaga S = 0 la T = 0oC).
Pentru un kilogram de gaz entropia specifica s este:
![]() (4.18)
(4.18)
Dimensiunile entropiei specifice sunt aceleasi ca si ale caldurii specifice, desi sensul sau fizic este altul.
Din relatia:
![]()
tinind seama ca in cazul transformarilor adiabatice dQ=0 rezulta ca si dS=0, deci transformarile adiabatice sunt in acelasi timp si transformari izentropice.
In natura toate fenomenele sunt mai mult sau mai putin ireversibile. In cazul unui ciclu ireversibil, egalitatea lui Clausius nu este valabila, relatia (4.13) devenind:
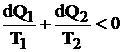 (4.20)
(4.20)
Pentru intregul contur, integrand rezulta:
![]() (4.21)
(4.21)
Deoarece la fenomenele ireversibile entropia creste, relatia (4.17) devine:
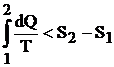
Relatia matematica a principiului al doilea al termodinamici se va scrie:
![]()
sau:
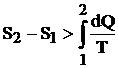 (4.22)
(4.22)
Daca
transformarea reala este adiabatica, adica ![]() , atunci
, atunci ![]() . In aceste conditii,
. In aceste conditii, ![]() deci
corpul termodinamic ajunge in stare de entropie mai mare.
deci
corpul termodinamic ajunge in stare de entropie mai mare.
Toate fenomennele spontane au loc cu cresterea entropiei.
![]() (4.23)
(4.23)
Relatia (4.23) reprezinta o forma matematica de exprimare a principiului al doilea al termodinamicii:
"Entropia unui sistem izolat creste sau ramane constanta si nu scade niciodata"
Aceasta formulare este cunoscuta sub denumirea de principiul cresterii entropiei. Deci procesele reale din natura au loc de la sine in sensul cresterii entropiei unui sistem izolat.
Din relatia (4.17):
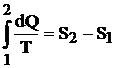
se pot trage concluzii privind legatura dintre variatia entropiei si schimbul de caldura al agentului termic cu mediul ambiant. Astfel: daca variatia entropei este mai mare decat zero, atunci si variatia de caldura este pozitiva, deci sistemul primeste caldura; daca variatia entropiei este negativa si variatia de caldura este mai mica decat zero si deci sistemul cedeaza caldura. In cazul in care variatia entropiei este nula, sistemul nu efectueaza schimb de caldura cu exteriorul, deci procesul este adiabatic reversibil sau izentrop.
Entropia joaca un rol important in studiul proceselor termice, deoarece permite evidentierea, in mod detaliat, a pierderilor care insotesc transformarile si da indicatii referitoare la masurile care trebuiesc luate pentru imbunatatirea randamentului masinilor termice si pentru marirea eficientei cu care se foloseste energia disponibila.
Diagramele entropice
Introducerea entropiei ca parametru de stare derivat a permis utilizarea in reprezentarile grafice ale proceselor termodinamice a unor diagrame, in care una din coordonate este entropia. Aceste diagrame se numesc diagrame entropice si pot fi diagrame T-S sau diagrame I-S.
Deoarece diagramele T-S sunt cele mai utilizate, in continuare se va face referire la ele.
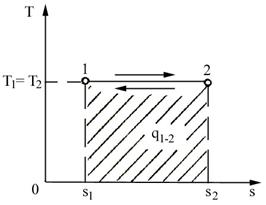
Considerand o transformare reversibila dintr-o stare 1 intr-o stare 2 (figura 4.4), aceasta va fi reprezentata in diagrama T-S printr-o curba continua intre punctele A (S1, T1) si B (S2, T2). Pe timpul acestei transformari, agentul de lucru schimba cu mediul o cantitate de caldura:
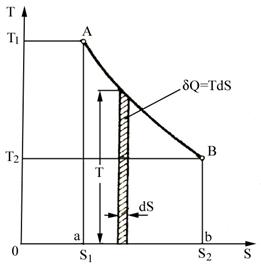
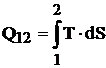 (4.28)
(4.28)
Fig.
4.4 Reprezentarea schimbului de caldura in diagrama T-S
Din figura se observa ca
aceasta integrala reprezinta aria de sub curba cuprinsa
intre punctele ABbaA. Datorita acestui fapt, diagrama T-S permite
determinarea imediata a schimbului de caldura si se mai
numeste diagrama calorica.
Din relatia (4.28) se observa ca sensul schimbului de caldura este pozitiv (caldura absorbita) cand curba transformarii este parcursa de la stanga spre dreapta si negativ (caldura cedata) cand este parcursa de la dreapta spre stanga.
Transformarile reversibile simple ale gazului ideal, prezentate in capitolul 3 pot fi reprezentate foarte usor in diagrama T-S, dupa cum urmeaza:
a) Transformarea izocora (V = ct; dV = 0) se reprezinta in diagrama T-S printr-o curba logaritmica (figura 4.5), avand panta tangentei:
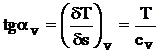 > (4.29)
> (4.29)
Ecuatia care stabileste variatia entropiei pe parcursul acestei transformari este:
![]() (4.30)
(4.30)
din care, prin integrare, obtinem:
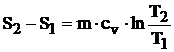 (4.31)
(4.31)
b) Transformarea izobara (p =ct; dp = 0) este reprezentata tot printr-o curba logaritmica (figura 4.6) pentru care panta tangentei se calculeaza cu relatia:
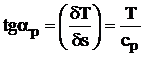 > (4.32)
> (4.32)
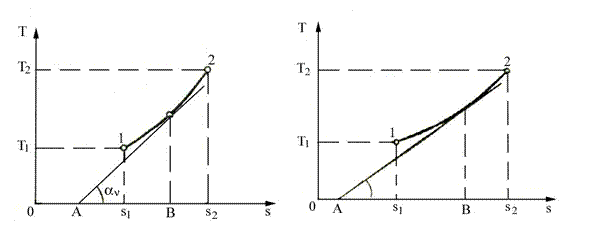
Fig. 4.5 Reprezentarea transformarii Fig. 4.6 Reprezentarea transformarii
izocore in diagrama T-s izobare in diagrama T-s
Pentru determinarea ecuatiei in coordonate T-S, se exprima schimbul de caldura elementar pentru o izobara:
![]() (4.33)
(4.33)
obtinindu-se:
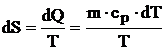 (4.34)
(4.34)
din care:
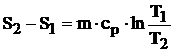 (4.35)
(4.35)
c) Transformarea izoterma este reprezentata printr-o dreapta paralela cu axa entropiei (figura 4.7). In cursul acestei transformari, variatia entropiei se determina cu relatia:
![]()
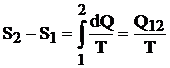 (4.36)
(4.36)
Deoarece, conform relatiei (3.65):
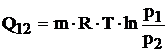
relatia (4.36) devine:
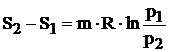 (4.37)
(4.37)
izoterme in diagrama T-s adiabatice in diagrama T-s
Semnul variatiei entropiei este determinat de semnul caldurii. Procesul izoterm de la 1 la 2 se caracterizeaza prin cresterea entropiei, deci agentul termic primeste caldura si efectueaza lucru mecanic, adica are loc o destindere. In procesul izoterm 2 - 1 entropia scade, agentul termic cedeaza caldura si primeste lucru mecanic din exterior, deci are loc o comprimare.
d) Transformarea adiabatica (dQ = 0) se caracterizeaza prin entropie constanta: dS = 0 sau S2 = S1 si deci se va reprezenta in diagrama T-s printr-o dreapta paralela cu axa temperaturilor (figura 4.8). Transformarile in sensul scaderii temperaturii reprezinta destinderi iar cele ce se desfasoara in sensul cresterii temperaturii reprezinta comprimari.
e) Transformarea politropa Din ecuatia caldurii pentru transformarea politropa:
![]()
obtinem:
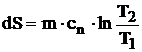 (4.38)
(4.38)
ceea ce arata ca si transformarea politropa se reprezinta prin curbe logaritmice, a caror panta este in functie de coeficientul politropic n:
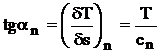 (4.39)
(4.39)
Tinand seama de relatia:
![]()
relatia (4.39) devine:
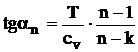
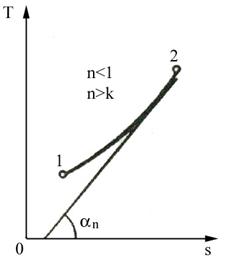
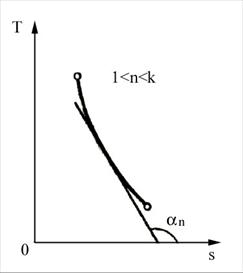
a. b.
Fig. 4.9 Reprezentarea transformarii politropice in diagrama T-s
a) cu panta pozitiva; b) cu panta negativa
Pentru k < n < 1 panta este pozitiva (figura 4.9), iar pentru 1< n < k panta este negativa.
Considerand diferitele transformari simple drept forme ale transformarii politropice se obtine reprezentarea din figura 4.10.
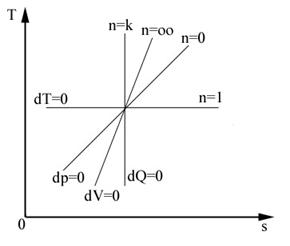
transformarii politropice
Din figura 4.4 se observa ca din punct de vedere al schimbului de caldura, orice transformare reversibila poate fi inlocuita, folosind aproximarea unor infiniti mici de ordinul doi, printr-o succesiune de transformari elementare izoterme si adiabatice.
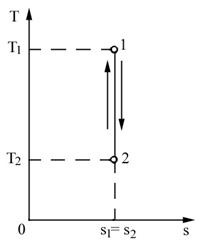
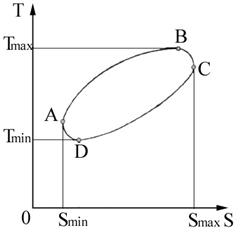
Reprezentarea ciclurilor in diagrama T-S. Un ciclu se reprezinta in diagrama T-S printr-un contur inchis (figura 4.11), deoarece agentul de lucru care sufera transformari revine in starea initiala la terminarea ciclului. Pe parcursul ciclului, entropia si temperatura variaza intre doua valori extreme corespunzatoare starilor A si C, respectiv B si D.
Aria cuprinsa in interiorul conturului (aria ciclului), masurata in unitati calorice reprezinta schimbul de caldura pe parcursul ciclului si tinand seama de echivalenta dintre caldura si lucru mecanic, reprezinta totodata si lucrul mecanic dezvoltat (consumat) pe timpul ciclului.
Ciclul Carnot este reprezentat in diagrama T-s printr-un dreptunghi (figura 4.12). Randamentul ciclului Carnot in functie de variatia entropiei de-a lungul transformarii izotermice va fi:
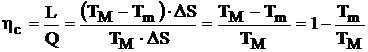 (4.41)
(4.41)

T
q
TM
Tm
qo
DS s
Similar, expresiile ciclului inversat vor fi:
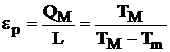 (4.42)
(4.42)
respectiv:
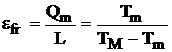 (4.43)
(4.43)
relatii similare cu cele prezentate la descrierea ciclului Carnot.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |