Hidroliza sarurilor. La dizolvarea unor saruri in apa, se produce o reactie reversibila intre apa si ionii sarii cu refacerea acidului si bazei din care a provenit sarea, fenomen numit hidroliza (gr. hydar, hydastos, apa + gr. lysis, desfacere, descompunere). In urma reactiei solutia devine acida sau bazica dupa cum acidul rezultat este mai tare decat baza (Ka > Kb) sau invers (Ka < Kb). Pot hidroliza urmatoarele categorii de saruri:
Saruri provenite din acizi tari cu baze slabe ca: NH4NO3, Al2(SO4)3, (NH4)2SO4 etc cand solutia devine acida:
![]() NH4+
+ NO3- + H2O
NH4+
+ NO3- + H2O
NH4OH + (H+ + NO3-)
![]() NH4+
+ H2O NH4OH + H+
NH4+
+ H2O NH4OH + H+
sau pe caz general
![]() M+ + H2O
MOH + H+
M+ + H2O
MOH + H+
Saruri provenite din acizi slabi cu baze tari ca: Na2CO3, CH3COONa, KH2PO4, sarurile acizilor organici cu metalele alcaline etc., cand solutia devine bazica:
CH3COO- +Na+ +H2O
![]()
CH3COOH+ (Na++OH-)
CH3COO- + H2O
![]()
![]() CH3COOH + OH- sau pe caz general
CH3COOH + OH- sau pe caz general
X- + H2O HX + OH-
Saruri provenite din acizi slabi cu baze slabe ca: (NH4)2CO3, (NH4)2S, CH3COONH4, etc., solutia devenind slab acida sau slab bazica dupa cum Ka > Kb sau Ka < Kb:
CH3COO- + NH4+ + H2O
![]()
CH3COOH + NH4OH
Nu hidrolizeaza sarurile provenite din acizi tari si baze tari ca NaCl sau KCl, a caror solutie prezinta caracter neutru. Caracteristic pentru solutiile de saruri hidrolizabile este constanta de hidroliza, gradul de hidroliza si pH-ul solutiilor. Acestea se calculeaza in continuare pe un caz general de sare binara MX in care, in prima categorie de saruri reactioneaza cu apa cationul (M+), in a doua categorie anionul (X-), iar in ultima categorie, atat cationul cat si anionul.
Pentru prima categorie de saruri reactia generala este:
![]() M+ + H2O MOH + H+
M+ + H2O MOH + H+
la care constanta de
echilibru este: 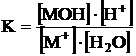
La o hidroliza
slaba se consuma putina apa incat, se aproximeaza
concentratia apei dupa hidroliza ca fiind neschimbata, deci
[H2O] = const. De aceea, se trece in membrul stang [H2O]
incluzandu-se in valoarea constantei de echilibru sub denumirea de constanta de hidroliza Kh: ![]()
Inlociund valoarea [H+] din produsul ionic al apei [H+]=Kw/[OH-], ecuatia devine:
 unde [MOH]/[M+][OH-]
= 1/Kb (inversul constantei de bazicitate) incat relatia care
exprima valoarea Kh devine:
unde [MOH]/[M+][OH-]
= 1/Kb (inversul constantei de bazicitate) incat relatia care
exprima valoarea Kh devine: 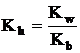
Pentru sarurile provenite din acizi slabi si baze tari reactia generala este: X- + H2O HX + OH-
iar Kh calculata dupa
procedeul de mai sus devine :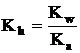
![]() Pentru a treia
categorie de saruri se poate scrie reactia: M+ + X- + H2O
MOH + HX si
Pentru a treia
categorie de saruri se poate scrie reactia: M+ + X- + H2O
MOH + HX si 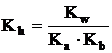
Formulele constantei de hidroliza prezinta in toate cazurile la numarator constanta autoprotolitica a apei Kw, iar la numitor fie constanta de ionizare a acidului slab rezultat prin hidroliza, fie a bazei slabe, fie ambele.
Gradul de
hidroliza h reprezinta raportul dintre cantitatea de sare care
hidrolizeaza si cantitatea totala de sare care se dizolva![]() Atunci cand
se prepara o solutie 1 molara de sare, numitorul=1, iar
relatia devine: h = numarul de molecule de sare hidrolizata.
Atunci cand
se prepara o solutie 1 molara de sare, numitorul=1, iar
relatia devine: h = numarul de molecule de sare hidrolizata.
In acest caz, din reactiile generale ale hidrolizei pentru primele doua categorii de saruri, rezulta:
h = [MOH] = [H+] si h = [HX] = [OH-]
Daca insa concentratia in sare dizolvata are o valoare c, concentratia in sare hirolizata este c·h:
c·h = [MOH] = [H+]
c·h = [HX] = [OH-]
Concentratia in sare ramasa nehidrolizata dupa stabilirea echilibrului, in ambele cazuri, este egala cu diferenta dintre concentratia initiala c si cea hidrolizata ch:
[M+] = c – ch = c(1 – h) [X-] = c – ch = c(1 – h)
Efectuand inlocuirea
rezulta: 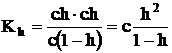 iar pentru
o hidroliza foarte slaba (h 0,01) se aproximeaza
ca 1-h1 si deci relatia devine:
iar pentru
o hidroliza foarte slaba (h 0,01) se aproximeaza
ca 1-h1 si deci relatia devine:
Kh=ch2 sau ![]() Deci,
gradul de hidroliza creste cu dilutia (definitie
asemanatoare cu gradul de ionizare la acizi si baze).
Deci,
gradul de hidroliza creste cu dilutia (definitie
asemanatoare cu gradul de ionizare la acizi si baze).
Sarurile provenite din acizi slabi si baze slabe hidrolizeaza.La echilibru, cantitatea de sare hidrolizata devine:
ch = [MOH] = [HX]
iar cea a sarii nehidrolizata: [M+] = [X-] = c(1-h)
Inlocuind in relatia constantei de hidroliza, rezulta:
![]()
Daca hidroliza
este slaba (h 0,01); 1-h1, iar relatia devine: ![]()
Rezulta ca la sarurile provenite din baze slabe cu acizi slabi, gradul de hidroliza nu depinde de concentratia sarii (sau de dilutie).
In cazul unei
solutii de sare provenita din acid tare cu baza slaba, se
observa ca [MOH] = [H+]. La un grad de hidroliza mic,
cand h 0,01, se poate aproxima concentratia de sare dupa
hidroliza ca fiind egala cu concentratia initiala: [M+]
= c. Deci, relatia devine:![]() Inlocuind
valoarea constantei Kh rezulta:
Inlocuind
valoarea constantei Kh rezulta:
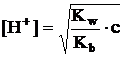 iar prin logaritmare:
iar prin logaritmare:
lg[H+] = 1/2·lgKw - 1/2·lgKb + 1/2·lgc
pH = 7 + 1/2·lgKb - 1/2·lgc
Rationamente asemanatoare duc la urmatoarea relatie a pH-ului unei solutii de sare provenita din acid slab si baza tare:
pH = 7 - 1/2·lgKa + 1/2·lgc
iar pentru sarurile provenite din acizi slabi si baze slabe:pH = 7 - 1/2·lgKa + 1/2·lgKb
Rezulta din ultima relatie ca sarurile provenite din acizi slabi si baze slabe au in solutie pH-ul independent de concentratie, spre deosebire de celelalte tipuri de saruri.
![]() Cunoasterea
fenomenului de hidroliza este deosebit de importanta pentru
aprecierea ingrasamintelor chimice in sol, in solutii
nutritive etc. Hidroliza are insa foarte multe aplicatii in chimia
organica si biochimie. Numeroase substante sunt obtinute pe
cale industriala prin reactii de hidroliza. Astfel, pentru
exemplificare, se da reactia generala de hidroliza a
derivatilor halogenati la alcooli in prezenta NaOH: R-X + H2O
Cunoasterea
fenomenului de hidroliza este deosebit de importanta pentru
aprecierea ingrasamintelor chimice in sol, in solutii
nutritive etc. Hidroliza are insa foarte multe aplicatii in chimia
organica si biochimie. Numeroase substante sunt obtinute pe
cale industriala prin reactii de hidroliza. Astfel, pentru
exemplificare, se da reactia generala de hidroliza a
derivatilor halogenati la alcooli in prezenta NaOH: R-X + H2O
R-OH + HX
Asemenea reactii mai pot fi date in general de derivatii functionali ai acizilor (esteri, nitrili, amide, halogenuri de acizi), derivatii substituiti ai acizilor (acizi halogenati, hidroxiacizi) ca si de numeroase alte substante. In domeniul biochimiei, numeroase reactii care se petrec in organismele vegetale si animale decurg cu ajutorul enzimelor, in special cu ajutorul hidrolazelor capabile sa hidrolizeze foarte multe substante. In numeroase cazuri, lupta impotriva poluarii apelor si solului se face pe cale hidrolitica, utilizandu-se enzimele.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |