
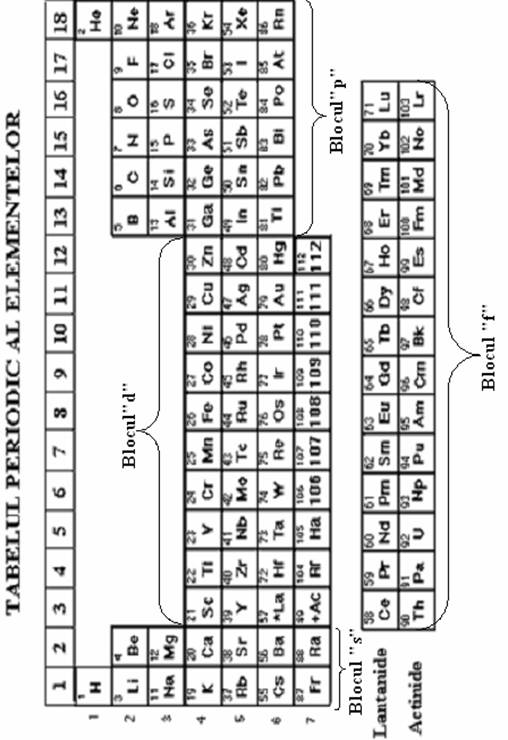
La mijlocul secolului al XIX s-a incercat prima sistematizare a elementelor cunoscute la acea vreme , nume pretigioase fiind legate de ideea ordonarii elementelor dupa proprietatile lor chimice. Nume pretigioase precum Chancurtois, Newlands si Lothar Meyer au premers prin lucrarile lor descoperirea legii periodicitatii enuntata de D.I.Mendeleev (1869). Acesta a ordonat cele 63 de elemente cunoscute la acea vreme in ordinea crescatoare a maselor lor atomice observand ca proprietatile fizice si chimice ale elementelor se repeta periodic, si a afirmat ca proprietatile fizico-chimice ale elementelor sunt functii periodice ale maselor lor atomice. Ulterior Moseley a dat enuntul legii periodicitatii care este acceptat si astazi: "proprietatile fizico-chimice ale elementelor sunt functii periodice ale numarului lor atomic Z". Forma actuala a tabelului periodic al elementelor este prezentata in cele ce urmeaza. Sistemul periodic al elementelor este alcatuit din 7 siruri de elemente ( pe orizontala) numite perioade si din 18 coloane de elemente (pe verticala) denumite grupe. Tabelul periodic este in stransa corelatie cu structura electronica a elementelor. In tabel, elementele sunt asezate in ordinea crescatoare a numarului atomic Z (care indica atat numarul de protoni cat si numarul de electroni al atomului). Fiecare element din dreapta altui element contine un proton in plus in nucleu si un electron in plus in invelisul electronic. Electronul prin care un element se deosebeste de cel precedent se numeste electron distinctiv. Pozitia acestuia in invelisul electronic este de cea mai mare importanta pentru comportarea chimica a elementului respectiv. Electronul distinctiv se afla pe nivelul energetic cel mai ridicat. Asocierea asezarii elementelor in sistemul periodic cu structura invelisului electronic al atomilor duce la urmatoarele aprecieri:
1.Fiecare perioada incepe cu completarea cu electroni a orbitalilor ns si se termina prin completarea orbitalilor np. Ocuparea completa a orbitalilor s si p duce la configuratii de octet ns2 np6.
2. Toate elementele din aceeasi grupa au aceeasi configuratie electronica a ultimului si/sau penultimului strat.
3. Numarul perioadei in care se afla un element este egal cu numarul nivelelor electronice (straturi) ocupate sau in curs de ocupare cu electroni.
4. Repetarea periodica a proprietatilor elementelor este determinata de repetarea dupa un numar de elemente a configuratiei electronice exterioare a acestora.
5. In tabel se disting urmatoarele blocuri de elemente:
blocul s - contine elementele grupelor 1 si 2 si au aceeasi configuratie electronica pe
ultimul strat: ns1 respectiv ns2
blocul p - contine elementele grupelor 13-18 si au configuratia electronica a ultimului
strat ns2np1→6 (susbtratul p in curs de competare)
blocul d - contine elementele grupelor 3-12 si au configuratia electronica a ultimului, respectiv penultimului strat, (n-1)d1→10ns2 (substratul d in curs de completare). Cele 10 elementele din blocul d se numesc metale tranzitionale.
blocul f - este ceva mai special deoarece contine doua serii de 14 elemente ce isi completeaza orbitalii din antepenultimul strat si au configuratia electronica (n-2)f(1→14)(n-1)d1ns2 (substratul f in curs de completare). Prima serie de 14 elemente din perioada 6 sunt toate asemanatoare lantanului, motiv pentru care se mai numesc lantanide (sau pamanturi rare) si ar trebui sa fie plasate "instivuit" deasupra lantanului. A doua serie de 14 elemente din perioada 7 sunt toate asemanatoare actiniului, motiv pentru care se mai numesc si actinide si ar trebui sa fie plasate "instivuit" deasupra actiniului.
5. Tabelul contine: perioada 1 cu 2 elemente (din grupele 1 si 18)
perioadele 2 si 3 cu 8 elemente (din grupele 1,2 si13- 18)
perioadele 4 si 5 cu 18 elemente (din grupele 1- 18)
perioadele 6 si 7 cu 32 elemente (din grupele 1-18, + lantanidele si
actinidele)
Asa dupa cum s-a mai aratat, intre configuratia elctronica a unui element si pozitia lui in sistemul periodic exista o legatura organica. Simpla scriere a configuratiei electronice a unui element ne perimte sa precizam care este pozitia lui in sistemul periodic. Configuratia electronica a tuturor elementelor din tabelul periodic este prezentata de exemplu in indicatia bibliografica 13.
Exemplu: care este pozitia in tabelul periodic a elementului corespunzator numarului atomic Z = 41?
Se scrie configuratia electronica cu ajutorul tablei de sah a lui Goldanski:
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d3
si se observa urmatoarele:
- Ultimul electron adaugat (electronul distinctiv) este pe un orbital d =>, elementul face parte din blocul d, deci este un metal tranzitional;
- cea mai mare valoare a lui n este 5 => elementul este in perioada 5-a
- deoarece elementul se afla in perioada a 5-a, numarul grupei se afla prin insumarea electronilor din ultimele susbtrate ocupate (s si d): 2+3=5 => elementul este in grupa 5-a.
Tabelul periodic este alcatuit din metale, nemetale si elemente care au atat caracter metalic cat si nemetalic (metaloizi). Fiecare perioada incepe cu un metal alcalin si se termina cu un gaz rar (nemetal). Parcurgand perioada de la stanga la dreapta se constata pierderea treptata a caracterului metalic o data cu cresterea numarului grupei si aparitia caracterului nemetalic pana la limita gazului nobil ce incheie perioada. Cu cat perioada este mai mare cu atat mai multe elemente sunt metalice si cu atat mai aproape de gazul inert apare caracterul nemetalic. Pierderea treptata a caracterului metalic pe masura ce creste Z si numarul grupei, nu este asa de neta cum este aparitia lui la inceputul fiecarei perioade. In tabelul periodic predomina caracterul metalic in blocul elementelor s, d si f . In blocul elementelor p (ce contine atat metale cat si nemetale) predomina caracterul metalic atata timp cat suma np +12 (unde np este numarul perioadei) este mai mare sau cel putin egal cu numarul grupei ng. Elementele pentru care suma np +12 = ng au atat caracter metalic cat si nemetalic; elementele pentru care suma np +12 < ng au caracter nemetalic. Marea majoritate a elementelor sunt metale (aproximativ 80). Unele grupe au denumiri consacrate precum:
-grupa 1 - grupa metalelor alcaline
-grupa 2 - grupa metalelor alcalino-pamantoase sau alcalino-teroase
-grupa 16- grupa calcogenilor
-grupa 17 - grupa halogenilor
-grupa 18 - grupa gazelor rare (sau nobile)
Toate metalele sunt solide cu exceptia mercurului (Hg) care este lichid. Toate nemetalele sunt fie gaze, fie solide cu exceptia bromului (Br) care este lichid.
Proprietatile elementelor se pot clasifica in doua categorii: proprietati neperiodice si proprietati periodice. Proprietatile neperiodice sunt numarul atomic (Z) si masa atomica (A). Proprietatile periodice sunt la randul lor de doua tipuri: proprietati periodice fizice (cum sunt, raza atomica, raza ionica, volumul atomic, energia de ionizare, etc) si proprietati periodice chimice (caracterul electrochimic, valenta).
A) Proprietati neperiodice a) Numarul atomic Z creste continuu de la 1 la 112. b) Masa atomica A creste continuu in paralel cu numarul atomic cu exceptia a 5 inversiuni K/Ar, Ni/Co, I/Te,Pa/Th, si U/Np.
B) Proprietati periodice
a) Proprietati fizice
Raza atomica depinde de situatia in care se afla atomul: izolat sau aflat intr-un anumit tip de retea. Raza atomica creste in grupe de sus in jos si scade in perioade de la stanga la dreapta (mai dezordonat la elementele tranzitionale). Cele mai mari raze atomice le au metalele alcaline.
Raza ionica raza ionica creste in grupe de sus in jos si in perioade scade de la dreapta spre stanga. Aceste consideratii sunt valabile doar pentru serii de ioni de aceeasi sarcina. De regula raza ionica unui cation este mai mica decat a atomului din care provine datorita contractiei nivelelor de energie, cauzate de deficitul de electroni in timp ce raza ionica a unui anion este mai mare decat cea a atomului din care provine datorita excedentului de sarcina (vezi anexa).
Volumul atomic se refera la volumul unui atom al unui element aflat in stare gazoasa. Daca se cunoaste raza atomica , atunci volumul atomic (presupunand pentru orice atom o simetrie sferica) poate fi estimat cu formula Vat = N A/ ρ (unde N-numarul lui Avogadro, A-masa atomica, densitatea elementului respectiv). Cele mai mici volume atomice le au metalele tranzitionale. In tabelul periodic volumele atomice cresc in grupe de sus in jos (o data cu cresterea numarului de straturi electronice) , iar in perioade volumele atomice scad in general cu cresterea lui Z pana la grupa a 10-a, dupa care incep sa creasca pana la grupa 18.
Energia de ionizare este energia consumata pentru indepartarea unui electron dintr-un atom aflat in stare gazoasa. Cu cat raza atomica este mai mare cu atat energia consumata pentru indepartarea unui electron este mai mica. Energia consumata pentru indepartarea primului electron si trecerii atomului in ion pozitiv (+1) se numeste prima energie de ionizare Ei1. Energia de ionizare va scadea in grupa de sus in jos si va creste in perioada, in general de la stanga la dreapta. O data ce primul electron a fost extras, extragerea celui de-al doilea (Ei2) necesita un consum mult mai mare de energie. Cele mai mici valori ale energiilor de ionizare le au elementele din coltul din stanga jos al tabelului periodic ( elemente cu caracterul metalic cel mai pronuntat) ,iar elementele care au valorile cele mai mari ale energiei de ionizare prezinta caracter electronegativ (caracter nemetalic).
Afinitatea pentru electron este energia eliberata atunci cand un atom in stare gazoasa capteaza un electron si se transforma in ion negativ. In general afinitatea pentru electron scade in grupele 13-18 de sus in jos Cele mai mici afinitati pentru electron le prezinta elementele grupelor 18 si 1. In perioade afinitatea pentru electron scade de la dreapta la stanga (metalele tranzitionale nefiind luate in considerare).
Electronegativitatea reprezinta capacitatea unui atom implicat intr-o legatura chimica de a atrage norul electronic al legaturii inspre el. In sistemul periodic electronegativitatea creste in perioada de la stanga la dreapta si scade de sus in jos in grupa(vezi anexa). Elementul cel mai electronegativ fiind florul iar elementul cel mai electropozitiv este cesiul. Gazele rare nu au electronegativitate.
b) Proprietati chimice periodice
Proprietatile chimice periodice ale elementelor din tabelul periodic sunt: caracterul electrochimic si valenta.
Caracterul electrochimic apreciaza capabilitatea elementelor de a ceda sau accepta electroni pentru a forma ioni. Tendinta elementelor de a ceda electroni si a trece in ioni pozitivi este cunoscuta sub numele de caracter electropozitiv; creste in grupa de sus in jos iar in perioada de la dreapta la stanga. Caracterul electropozitiv este asociat cu caracterul metalic.
Tendinta elementelor de a accepta electroni si a forma ioni negativi este cunoscuta sub numele de caracter electronegativ, creste in grupa de jos in sus iar in perioada de la stanga la dreapta. Caracterul electronegativ este asociat cu caracterul nemetalic.
Valenta este capacitatea atomilor unui element de a se combina cu atomii altui element in scopul atingerii configuratiei de gaz inert, dand nastere unei noi substante. Ea se numeste electrovalenta in cazul in care configuratia de gaz inert se realizeaza prin cedare sau acceptare de electroni, sau covalenta in cazul in care configuratia de gaz inert se realizeaza prin punere in comun de electroni. Elementele din tabelul periodic pot avea una sau mai multe valente in functie de partenerul la care se raporteaza. Valenta elementelor din grupele 1,2,3 fata de hidrogen este egala cu numarul grupei; valenta elementelor din grupele 15, 16, 17 de exemplu este egala cu diferenta dintre cifra 18 si numarul grupei.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |