
Teoria electronica a legaturii chimice (clasica) W.Kossel, G.N.Lewis (1916)
Prin combinare chimica atomii isi modifica straturile exterioare de electroni, realizand configuratii mai stabile, identice cu ale gazelor nobile sau apropiate de acestea. Teoria electronica a legaturii chimice se bazeaza pe cateva principii si anume:
- tendinta de combinare este cauzata de nestabilitatea configuratiei electronice a atomilor liberi,
- stabilitatea configuratiei de gaz nobil realizarea octetului electronic,
- tendinta de folosire cat mai completa a electronilor si orbitalelor disponibile.
Prin combinare chimica atomii isi modifica straturile exterioare de electroni, realizand configuratii mai stabile, identice cu ale gazelor nobile sau apropiate de acestea.
Kossel in 1916 a elaborat teoria electronica a legaturii ionice. Aceasta legatura ia nastere intre elemente cu caracter chimic diferit, deci cu diferente mari de electronegativitate. Conform acestei teorii formarea legaturii ionice presupune doua etape:
- formarea ionilor
- atractia electrostatica dintre ioni.
Formarea ionilor are loc prin pierdere sau castig de electroni:
metalele puternic electropozitive, cu un numar mic de electroni pe ultimul nivel fata de configuratia de gaz nobil (mai ales din grupele 1 si 2), cedeaza acesti electroni, trecand in ioni pozitivi numiti cationi. De exemplu:
Li0 e = Li+
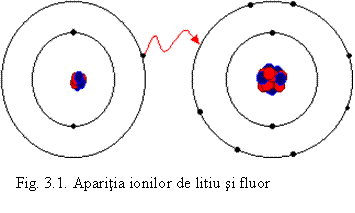 Acestia au configuratia
electronicǎ a elementului precedent. Pentru litiu, prezentat mai sus:
Acestia au configuratia
electronicǎ a elementului precedent. Pentru litiu, prezentat mai sus:
[He]2s1 e- → [He]
- nemetalele puternic electronegative cu deficit mic de electroni fata de configuratia de gaz nobil, primesc electroni, trecand in ioni negativi numiti anioni. De exemplu:
F0 + e = F-
 Acestia
vor avea configuratia electronica a gazului nobil urmator:
Acestia
vor avea configuratia electronica a gazului nobil urmator:
[He]2s22p5 + e- → [Ne]
Reamintim cǎ legatura ionica ia nastere intre elemente cu caracter chimic foarte diferit cu electronegativitati diferite elemente aflate la extremitati in sistemul periodic. Elementele de la mijlocul sistemului periodic (metale sau nemetale) pot ceda sau primi un numar limitat de electroni.
Metalele tranzitionale (din blocul d) nu totdeauna realizeaza configuratii de gaz nobil. Acestea pot realiza configuratii de 14, 16 sau 18 electroni devenind ioni pozitivi. De asemenea au o pronuntata tendinta de a da mai multe stari de oxidare valenta variabila iar legatura ionica apare doar la sarcini mici +1 sau +2.
Starea de oxidare a elementelor in combinatii ionice este egala cu sarcina ionului respectiv si nu poate fi mai mare decat trei la ionii simpli, deoarece numarul electronilor cedati sau primiti nu poate fi mai mare. Energia de ionizare creste cu fiecare electron cedat, iar afinitatea pentru electron scade cu fiecare electron acceptat de atom. Tendinta de formare a ionilor mai depinde si de dimensiunile atomilor: atomii cu dimensiuni mici formeaza mai usor anioni (primesc electroni), iar cei cu dimensiuni mari formeaza cationi (cedeaza usor electroni). Un ion cu sarcina electrica mare si raza mica ar avea un camp electric foarte intens, care ar polariza puternic ionii de semn contrar, legatura devenind practic covalenta. De aceea ionul H+ nu poate exista liber in solutie, ci doar legat covalent de moleculele de apa de exemplu. Razele cationilor sunt mult mai mici decat ale atomilor initiali, iar razele anionilor sunt ceva mai mari decat ale atomilor din care provin.
Exista si ioni poliatomici sau complecsi, care sunt de fapt molecule incarcate electric, formate prin legaturi covalente, de exemplu: NH4+, H3O+, OH-, SO42-, [Cu(NH3)4]2+, etc.
Nu exista molecule ionice ci numai ioni intr-o retea cristalina, in care fiecare ion este inconjurat de un num de ioni de semn contrar, astfel incat atractiile electrostatice sa fie maxime si respingerile minime, asigurandu-se neutralitatea retelei in ansamblu. Legatura ionica nu se satureaza, se respecta doar neutralitatea sistemului.
La formarea combinatiilor ionice se degaja energie cu cat aceasta este mai mare, stabilitatea combinatiei este mai mare. La aceasta contribuie:
- atractia coulombiana dintre ioni (in stare gazoasa),
- energia de retea a cristalelor ionice (se degaja),
- solvatarea ionilor.
Δx: 0,5 1,0 1,5 1,8 2,0 2,5 3,0 3,2
%caract. ionic: 622 43 55 63 79 89 92
Conventional, se considera ionica o legatura dintre elemente ale caror electronegativitati difera cu mai mult de 1,8, deci procentul de caracter ionic este mai mare de 55%.
- au caracter salin (majoritatea sunt saruri),
- au puncte de topire (tt) si de fierbere (tf) ridicate,
- se dizolva in soventi polari (apa), in solutie apoasa are loc fenomenul de hidratare a ionilor prin care ionii se inconjoara cu moleculele dipolare ale apei.
- in stare solida sunt izolatori,
- solutiile substantelor ionice in apa conduc curentul electric, de aceea se numesc electroliti sau conductori electrici de ordinul II, avand conductibilitate ionica. In acelasi mod conduc curentul electric si topiturile ionice.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |