TRAUMATISMELE CRANIOCEREBRALE
II.1. Incidenta-etiologie
II.3. Efectele traumatismelor craniocerebrale asupra sistemului nervos central
IV.1. Ulcerul de stres si epidemiologia ulcerului de stres
IV.2. Anatomia patologica a ulcerului de stres
IV.3. Mecanismele fiziopatologice ale ulcerului de stres
IV. 4. Diagnosticul hemoragiilor digestive superioare prin ulcer de stres
IV. 5. Tratamentul hemoragiilor digestive prin ulcer de stres
VI.1. Masuri generale
VI.2. Masuri specifice
Societatea moderna, alaturi de o seama de aspecte pozitive, atrage dupa sine si laturi negative, intre care accidentele (de circulatie, industriale, sportive, etc.) se disting prin frecventa si gravitate. Astfel de pacienti, frecvent politraumatizati, cu asocieri morbide complexe ce ridica numeroase probleme diagnostice, de etapizare terapeutica si furnizeaza procente importante de mortalitate.
Afectarea extremitatii cefalice in cadrul politraumalismclor ce este prezenta, intr-un procent ce depaseste frecvent 70%, face sa consideram ca traumatismul craniocerebral (cu diverse grade de gravitate) reprezinta regula.
Perfectionarea metodelor diagnostice si terapeutice a permis prelungirea vietii unor astfel de pacienti, cu mult peste limitele imaginate candva, dar a deschis si calea unor complicatii grave, care in alte conditii nu ar fi avut timp sa apara. Cele mai frecvente complicatii inregistrate sunt cele de ordin respirator, urmate indeaproape de cele digestive, intre care hemoragiile digestive superioare se detaseaza prin frecventa, gravitate si dificultati terapeutice.
Deseori aceste situatii grave, necesita decizii terapeutice de urgenta, la pacienti comatosi, cu tare asociate semnificative, necunoscute (frecvent tare digestive), ceea ce creste exponential riscul de hemoragii digestive superioare. Aceasta situatie genereaza agravari reciproce (ale suferintei neurochirurgicale si a celei digestive), facand dificila secventialitatea masurilor terapeutice si crescand semnificativ mortalitatea.
Suferinta neurochirurgicala, grava prin ca insasi, complicata cu hemoragie digestiva superioara si adesea si cu alte circumstante patologice de ordin respirator, renal, etc. genereaza o situatie complexa diagnostica si terapeutica a carei solutionare necesita o colaborare activa intre chirurg, neurochirurg si anestezist-reanimator.
Chirurgul generalist ce trebuie sa trateze o hemoragie digestiva superioara la un bolnav complex, va avea mari dificultati, avand in vedere ca diagnosticul, monitorizarea si tratamentul va trebui sa aiba in vedere intregul context clinic, in vederea armonizarii masurilor terapeutice, mai ales in conditiile in care aceasta secventialitate nu este codificata.
Afectiunile sistemului nervos central, ce necesita o solutie terapeutica chirurgicala, reprezinta in general circumstante patologice complexe: coma de diferite grade, stari de șoc, ce afecteaza structuri de maxima sensibilitate si care presupun interventii chirurgicale de amploare, grevate de multiple riscuri.
II.1. Incidenta-etiologie
Leziunea craniocerebrala apare frecvent intr-un context mult mai complex, politraumatismul, intelegand prin acesta, acea situatie patologica consecutiva unui accident, caracterizata prin multiplicitatea leziunilor concomitente, cauzate de agenti vulneranti care actioneaza cel putin la nivelul a doua zone anatomo-topografice. In contextul actual se poate afirma ca politraumatismul este regula, iar traumatismul izolat (singular), este exceptia. Din aceasta perspectiva, problemele legate de diagnosticul si managementul terapeutic al politraumatizatilor sunt dintre cele mai complexe.
In asocierile traumatice cranio-vertebro-toraco-abdominale, diagnosticul leziunilor poate fi incorect sau incomplet, prin aditie sau sustragere de simptome de catre leziunea cerebrala sau medulara, iar in acest context stabilirea tabloului lezional si tratamentul sunt dificile, iar prognosticul sever.
Frecventa estimata a localizarilor topografice interesate in cadrul traumatismelor este urmatoarea:
- extremitatea cefalica - 70%;
- torace - 30 %;
- membre inferioare - 30 %;
- abdomen - 18%;
- vertebrala - 13%;
- membre superioare - 10%;
- regiunea gatului - 7%.
Criteriul major pentru clasificarea politraumatismelor este insa starea functiilor vitale, criteriul care permite aprecierea cat mai exacta a gradului de afectare a functiilor vitale si dicteaza atitudinea terapeutica.
In functie de acest criteriu politraumatismele apartin uneia din urmatoarele categorii:
1. Politraumatismul cu alterarea functiilor vitale, care necesita interventii energice de resuscitare:
a. politraumatismul cu stare de moarte aparenta
b.politraumatismul cu stare asfixica
c.politraumatismul cu stare de colaps
d.politraumatismul cu stare de coma
2. Politraumatismul cu leziuni evidente, grave, dar cu functii vitale stabile.
3. Politraumatismul cu functii vitale stabile si leziuni aparent minore.
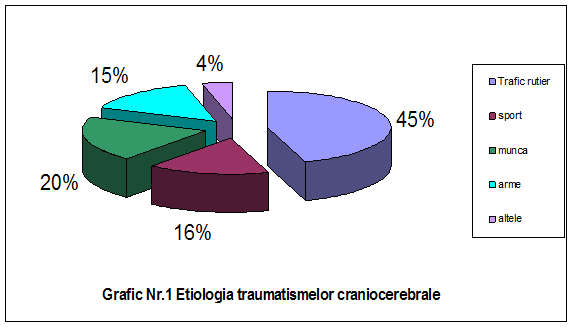
Cele mai frecvente cauze ale acestor traumatisme sunt considerate:
- accidentele de trafic rutier (automobil si motocicleta - 45%)
- accidentele de munca (cadere de la inaltime sau contactul cu obiecte care cad - 20%);
- accidente de sport (caderi, plonjon in apa putin adanca - 16%);
- traumatismele directe prin arme de foc - 15%;
- alte tipuri de traumatisme (4%).
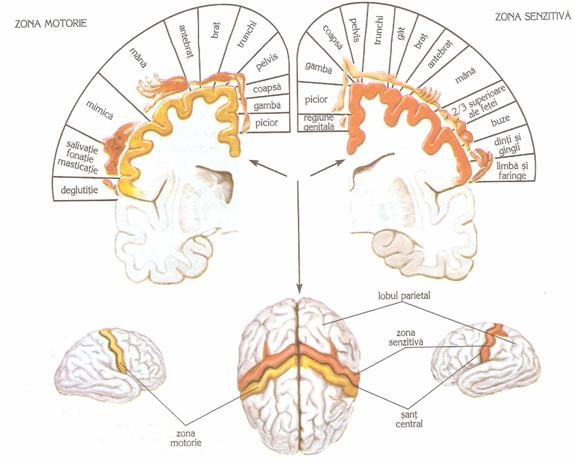
Zonele somatice implicate
II.3. Efectele traumatismelor craniocerebrale asupra SNC
Stabilirea bilantului lezional cerebral presupune diagnosticarea procesului patologic de baza (contuzie de diverse gravitati, dilacerare cerebrala, ele.) cu topografia si gravitatea specifica, la care se adauga prezenta unor colectii sanguine intracraniene si efectele subsecvente.
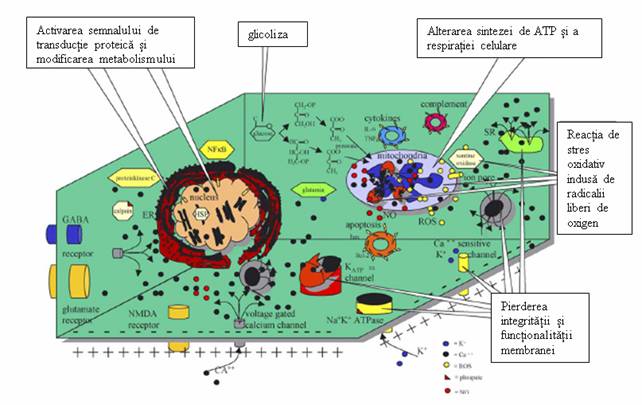
Fig.. Cascada ischemica postinjurie cerebrala.
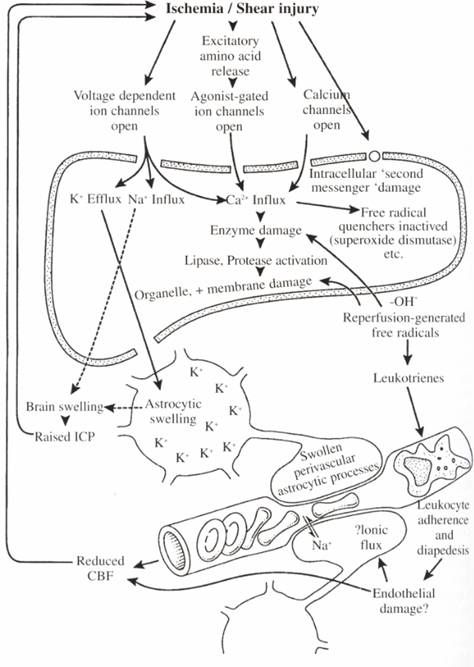
Fig.. Cascada mediatorilor ischemiei.
Gravitatea traumatismului craniocerebral a fost stabilita pe baza Glasgow Coma Scale
Tab.. GLASGOW COMA SCALE (GCS)
|
Reactia la stimuli |
Nr. puncte |
|
Deschiderea ochilor |
|
|
Spontana | |
|
La stimuli verbali | |
|
La stimuli durerosi | |
|
Nu se produce | |
|
Cel mai bun raspuns verbal |
|
|
Converseaza, orientat temporospatial | |
|
Confuz | |
|
Cuvinte inadecvate | |
|
Sunete neinteligibile | |
|
Absenta raspunsului verbal | |
|
Cel mai bun raspuns motor |
|
|
Executa comenzi verbale | |
|
Localizeaza durerea | |
|
Flexie cu directie/flexie orientata/retragere | |
|
Flexie anormala/flexie reflexa (decorticare) | |
|
Extensie (decerebrare) | |
|
Absenta raspunsului motor | |
Traumatismele craniocerebrale, fiind leziuni dinamice, se clasifica in functie de momentul aparitiei in: efecte traumatice primare si secundare.
A. Efectele traumatice primare sunt leziuni ireversibile, ce apar in momentul traumatismului, fiind rezultatul direct al acestuia. Sunt reprezentate de: plagile scalpului, fracturile oaselor craniului, hematoamele posttraumatice intracraniene (extradurale, subdurale, intraparenchimatoase), hemoragia subarahnoi-diana posttraumatica, hemoragia intraventriculara, contu-zia cerebrala, dilacerarea cerebrala, comotia cerebrala, leziunile axonale difuze.
1. Comotia cerebrala
Este un efect posttraumatic primar difuz, produs prin forte dinamice, inertiale. Se manifesta prin abolirea starii de constienta, cu durata cuprinsa intre cateva secunde si 6 ore. Nu are substrat lezional cerebral, fiind datorata unor tulburari functionale: abrupta depolarizare a membranei neuronilor din formatiunea reticulata a trunchiului cerebral. Efectul este tranzitoriu, reversibil si fara repercursiuni imediate sau tardive. Comotia cerebrala nu este acompaniata de complicatii digestive sau de alta natura.
2. Leziunile axonale difuze (diffuse axonal injury, DAI)
Reprezinta un efect posttraumatic primar difuz, produs prin forte dinamice inertiale si/sau cu contact. Se manifesta clinic prin coma prelungita, instalata imediat posttraumatic, in absenta unui proces expansiv intracranian posttraumatic sau a leziunilor ischemice. Apar in aproximativ jumatate din traumatismele craniocerebrale grave, fiind cauza deces la 35-50% dintre acesti pacienti.
Modificarile sunt microscopice si depind de intervalul de supravietuire al pacientilor. La pacientii cu supravietuire scurta (zile) se pun in evidenta numerosi "bulbi axonali" in substanta alba cerebrala, cerebeloasa si din trunchiul cerebral. La pacientii cu supravietuire medie (saptamani) se pun in evidenta "clusteri de microglie" in substanta alba. La pacientii cu supravietuire indelungata (luni) se evidentiaza degenerescenta walleriana la nivelul emisferelor cerebrale, trunchiului cerebral si maduvei. In DAI severe leziunile axonale microscopice sunt insotite si de leziuni vasculare specifice: hemoragie focala in corpul, leziune focala in unul sau ambele cadrane dorsolaterale ale regiunii rostrale a trunchiului cerebral, de cele mai multe ori prinzand si pedunculii cerebelosi superiori, contuzii hemoragice punctiforme ("gliding contusions") parasagitale, la nivelul substantei albe frontale si parietale, hemoragii punctiforme ("tissue tear hemorrages") profunde (periventriculare, talamice, lenticulare).
Gravitatea simptomatologiei este disproportionta fata de aspectul CT-scan. 50-80% dintre imaginile CT sunt normale. Pacientii prezinta coma persistenta, 90% dintre ei ramanand in stare vegetativa.
Din punct de vedere clinic se descriu trei clase:
a. DAI minore (coma cu durata 6-24 ore, semnele de trunchi cerebral dispar dupa cateva ore, dupa 24 de ore pacientii executa comenzile examinatorului),
b. DAI moderate (coma cu durata zile-saptamani, semnele de trunchi cerebral dispar dupa 24 de ore)
c. DAI severe (coma profunda si persistenta, semnele de trunchi cerebral se mentin mai mult de 24 de ore, hipertonie simpatica cu hipertensiune arteriala, hipersudoratie si hipertermie).
Complicatiile pulmonare, digestive si sistemice apar frecvent la acesti bolnavi.
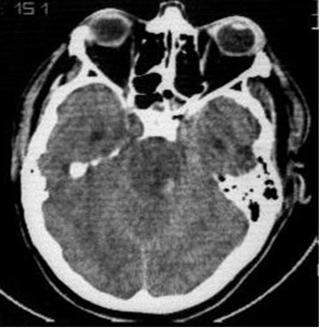
Figura. 8. Leziuni axonale difuze severe. Hemoragie in regiunea rostrala a trunchiului cerebral (regiunea dorsolaterala a mezencefalului).
3. Contuzia cerebrala
Este un efect traumatic primar focal, caracterizat prin prezenta unei arii hemoragice, de dimensiuni variabile, frecvent cu localizari particulare (polul frontal, subfrontal, polul temporal, suprafata laterala si inferioara a lobului temporal). Specific pentru contuzia cerebrala este integritatea leptomeningelui. Efectul lezional traumatic este indus de modificari locale directe sau perturbari vasomotorii reflexe la distanta (vasodilatatie sau chiar vasoplegii, vasospasme, iar uneori cele doua mecanisme alternante) ce induc extravazari in parenchim producand leziuni anatomice si biochimice la acest nivel. Hemoragia poate avea origine arteriala, capilara sau venoasa. Se deosebesc mai multe forme de contuzie cerebrala in functie de mecanismul de producere: contuzia de fractura, contuzia directa ("coup contusion"), contuzia de contralovitura ("contre coup contusion"), contuzia de alunecare ("gliding contusion"), contuzia de hernie cerebrala.
Se manifesta clinic prin alterare a starii de constienta, care poate sa evolueze cu coma de durata si profunzime variate, cu semne neurologice mai mult sau mai putin exprimate, ca o consecinta a leziunii parenchimului cerebral.
Se descriu trei forme clinice de contuzii:
a. Contuzia minora: manifestari neurologice minore, cu pierderea starii de constienta de maximum o ora
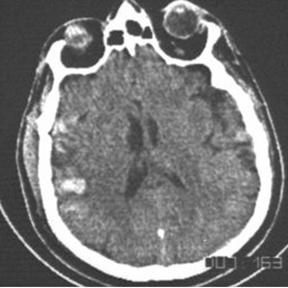
Fig.. Contuzie hemoragica temporala dreapta. Hematom epicranian temporal drept.
 b. Contuzia medie: abolirea starii de constienta
de cateva ore-zile, semne neurologice de focar, cu remisiunea neurologica
partiala, uneori apar complicatii respiratorii sau digestive.
b. Contuzia medie: abolirea starii de constienta
de cateva ore-zile, semne neurologice de focar, cu remisiunea neurologica
partiala, uneori apar complicatii respiratorii sau digestive.
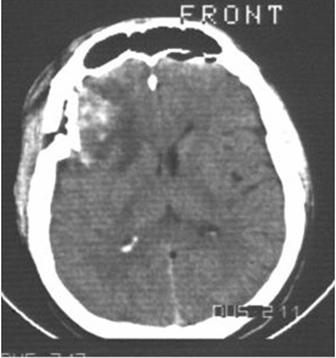
Figura. 10. Fractura cu infundare frontala dreapta si contuzie frontala dreapta subiacenta focarului de fractura.
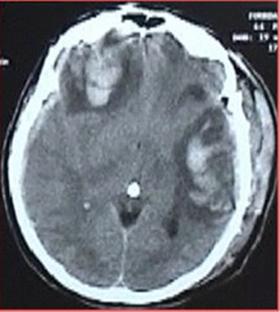 c. Contuzia grava: coma profunda si
persistenta, poate avea predominanta emisferica sau de
trunchi cerebral, semne neurologice de focar, se asociaza frecvent cu
manifestari vegetative, complicatiile respiratorii si/sau
digestive sunt regula).
c. Contuzia grava: coma profunda si
persistenta, poate avea predominanta emisferica sau de
trunchi cerebral, semne neurologice de focar, se asociaza frecvent cu
manifestari vegetative, complicatiile respiratorii si/sau
digestive sunt regula).
Figura. 11. Contuzii edemato-hemoragice frontala dreapta si temporala stanga.
Contuzia cerebrala minora poate asocia un hematom subdural. Contuzia cerebrala medie si grava asocia revarsate sanguine intracraniene cu diverse localizari sau revarsate lichidiene (meningite seroase).
4. Dilacerarea cerebrala
Reprezinta un efect traumatic primar focal, produs prin mecanisme dinamice cu impact si/sau inertiale, caracterizat prin prezenta unei arii hemoragice sau necrotice, ce intereseaza cortexul si substanta alba subiacenta. Caracteristic este efractia leptomeningelui, cu hemoragie subarahnoidiana de insotire.
Dilacerarea cerebrala se manifesta clinic cu sau fara abolirea starii de constienta si cu semne neurologice de focar.
Dilacerarea cerebrala poate fi:
a. Dilacerare directa: produsa prin corpi straini penetranti sau prin fragmente osoase cu sau fara plagi ale scalpului; este apanajul traumatismelor craniocerebrale deschise.
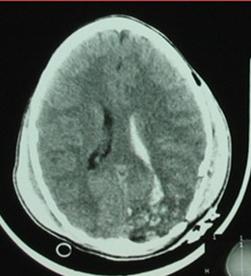
Figura. 12. Fractura parieto-oocipitala stanga. Dilacerare parieto-occipitala stanga. Hemoragie intraventriculara ventriculul lateral stang.
b. Dilacerarea indirecta: produsa de proiectarea masei cerebrale pe reliefuri dure, taioase endocraniene; apar in polul temporal si regiunile fronto-bazale.
Dilacerarile cerebrale pot asocia hematoame eu diverse localizari si fistule LCR.
5. Hematomul extradural
Este un efect primar, focal, exclusiv traumatic, produs de forte dinamice cu contact, caracterizat prin aparitia unui revarsat sanguin in spatiul virtual dintre dura mater si endocraniu.
Formele clinice sunt:
a. Hematom extradural supraacut
b. Hematom extradural acut (cel mai frecvent)
c. Hematom extradural subacut
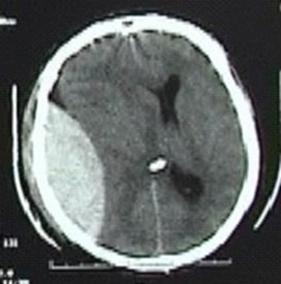
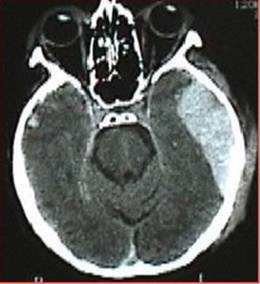
Fig.13. Hematom extradural acut de Fig.14. Hematom extradural temporal stang.
emisfer drept. Efect de masa asupra
structurilor adiacente (deplasarea liniei
mediene spre stanga cu cca 2 cm, colabarea
sistemului ventricular de partea dreapta)
Formele topografice sunt:
a. Hematomul temporal: sursa de sangerare este artera meningee medie; reprezinta 70-80% dintre totalul hematoamelor extradurale
b. Hematomul fronto-temporal: sursa de sangerare este ramul anterior al arterei meningee medii
c. Hematomul temporo-occipital: sursa de sangerare este ramul posterior al arterei meningee medii
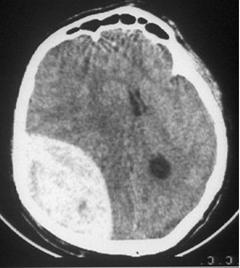
Figura. 15. Hematom extradural temporo-parieto-occipital drept.
d. Hematomul frontal
e. Hematomul median: sursa de sangerare este sinusul sagital superior
f. Hematomul bazal
g. Hematomul fosei posterioare; dau cel mai mare procent de fenomene vegetative; apar la copii si adultii tineri.
Fracturile insotesc in 30-91% din cazuri hematoamele subdurale.
Hematomul subdural
Este un efect traumatic primar focal, determinat de mecanisme inertiale. Se poate prezenta ca o entitate anatomo-clinica de sine-statatoare sau asociat cu o contuzie hemoragica subiacenta.
Colectia hematica este situata intre dura mater si arahnoida. De cele mai multe ori sunt localizate fronto-parietal parasagital si provin din ruptura "bridging" venelor aferente sinusului sagital superior. Hematoamele temporo-parietale au sursa de sangerare arteriala, subsecventa dilacerarii arterelor corticale. Hematoamele de fosa cerebrala posterioara prezinta sindrom HIC foarte pronuntat.
Hematoamele subdurale sunt acute si cronice.
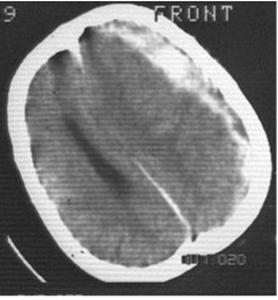
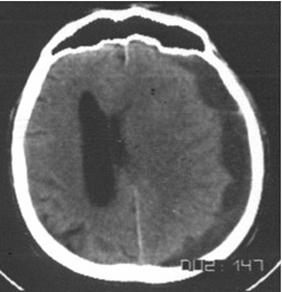
Fig. 16. Hematom subdural acut de emisfer Fig. 17. Hematom subdural cronic de
stang. emisfer stang.
7. Hemoragia subarahnoidiana
Reprezinta unul dintre cele mai frecvente efecte posttraumatice primare focale. Brain Trauma Foundation constata ca hemoragia subarahnoidiana este intalnita la 26-36% dintre pacientii cu traumatisme craniocerebrale severe. Poate fi consecinta unui hematom intraparenchimatos, ce se dezvolta progresiv, a carui crestere in volum determina dilacerari secundare ale parenchimului cerebral evoluand fie spre ventriculul ipsilateral in care se varsa, fie spre contextul contuzionat pe care il efractioneaza impreuna cu pia mater si continutul hematomului se varsa in spatiul subarahnoidian.
Clasificarile Hunt si Hess si WFNS (World Federation of Neurologic Surgeons) se coreleaza bine cu prognosticul hemoragiei subarahnoidiene.
Tab.. CLASIFICAREA HEMORAGIEI SUBARAHNOIDIENE HUNT SI HESS
Grad I - Asimptomatic sau cefalee minima si minima redoare de ceafa
Grad II - Cefalee moderata sau severa, redoare de ceafa, fara deficite neurologice focale, cu exceptia unor pareze de nervi cranieni
Grad III Alterarea usoara a starii de constienta (confuzie, somnolenta), deficite neurologice focale minime
Grad IV - Stupor, hemipareza moderata sau severa, posibil rigiditate prin decerebrare si tulburari vegetative
Grad V - Coma profunda, rigiditate de decerebrare, muribund
Tab.. CLASIFICAREA HEMORAGIEI SUBARAHNOIDIENE WFNS (World Federation of Neurologic Surgeons
Grad 1 - GCS 15 puncte, deficit motor absent
Grad 2 - GCS 13-14 puncte, deficit motor absent
Grad 3 - GCS 13-14 puncte, deficit motor absent
Grade 4 - GCS 7-12 puncte, deficit motor absent sau prezent
Grade 5 - GCS 3-6 puncte, deficit motor absent sau prezent
Clasificarea Fischer este predictiva pentru aparitia vasospasmului, una dintre cele mai temute complicatii ale hemoragiei subarahnoidiene.
Tab..CLASIFICAREA CT FISHER A HEMORAGIEI SUBARAHNOIDIENE
Grad 1 - Absenta sangelui
Grad 2 - Sange subarahnoidian difuz repartizat, fara cheaguri sau straturi verticale cu grosimea mai mare de 1 mm
Grad 3 - Cheag localizat si/sau straturi verticale cu grosimea mai mare de 1 mm
Grad 4 - Cheag intracerebral sau intraventricular
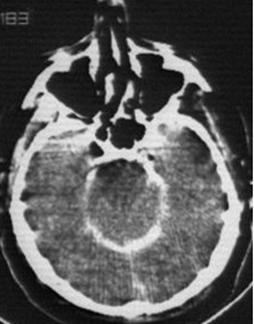 Prezenta sangelui la nivelul cisternelor bazale are
semnificatie predictiva nefavorabila pentru aproximativ 70%
dintre bolnavi. Cele trei sisteme sunt utile in stabilirea indicatiei
chirurgicale si a riscului operator.
Prezenta sangelui la nivelul cisternelor bazale are
semnificatie predictiva nefavorabila pentru aproximativ 70%
dintre bolnavi. Cele trei sisteme sunt utile in stabilirea indicatiei
chirurgicale si a riscului operator.
Figura. 18. Hemoragie subarahnoidiana posttraumatica (la nivelul girilor si marginilor libere ale tentoriului. Edem cerebral (Stergerea cisternelor perimezencefalice).
8. Hematomul intraparenchimatos
Este un revarsat sanguin care se dezvolta in plin parenchim cerebral intr-o arie de contuzie cerebrala. Cel mai frecvent, 80-90%, sunt intalnite in substanta alba a lobilor frontal si temporal temporal.
Este o leziune circumscrisa, bine delimitata si se dezvolta preferential subcortical si in plina substanta alba. Poate fi:
a. Hematom intraparenchimatos primar
b. Hematom intraparenchimatos secundar
posttraumatic
- prin malformatii cerebro-vasculare complicate
- prin tumori cerebrale primitive
- prin metastaze cerebrale.
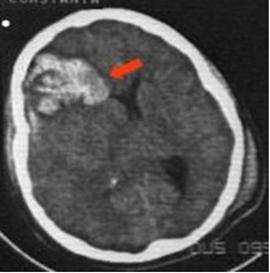
Figura. 19. Hematom intraparenchimatos posttraumatic frontal drept.
B. Efectele traumatice secundare sunt toate modificarile subsecvente ce apar la nivel cerebral. Acestea sunt initiate in momentul impactului, dar se exprima clinic dupa o perioada variabila de timp si au caracter reversibil. Sunt reprezentate de: efectele sistemice (hipotensiune arteriala, hipercabnie, hipertermie, anemie, tulburari electrolitice), hipoxia/ischemia cerebrala, edemul cerebral (citotoxic, vasogen), infectiile (meningita, abcese), hipertensiunea intracraniana, colectiile sanguine intracraniene posttraumatice intarziate, herniile cerebrale, crizele posttraumatice, colapsul cerebroventricular, accidentele vasculare posttraumatice.
Efectul cumulativ al acestora alaturi de efectele traumatice primare are un rol de agravare a starii pacientului. Nici unul din efectele subsecvente nu sunt specifice traumatismelor craniocerebrale fiind intalnite si in alte stari patologice.
1. Edemul cerebral
Este o modalitate reactionala, nespecifica, complexa, aparand ca efect al unor procese patologice cerebrale (tumori, abcese, traumatisme, parazitoze, vasculopatii, etc.) cat si extracerebrale {intoxicatii, boli de sistem).
Edemul cerebral poate fi:
-generalizat
-predominant intr-o anumita zona (emisfer cerebral, trunchi cerebral, etc.)
- focal
In geneza sa intervin o multitudine de factori dintre care doar o parte sunt cunoscuti: biochimici (hipoxie, hipercapnie, etc), biofizici (modificari de permeabilitate a membranei celulare si a barierei (hemato-encefalice).
Gravitatea edemului cerebral este data de:
* cresterea volumului parenchimului cerebral antreneaza angajarea circumvolutiei cerebrale, cu semne de decerebrare si tulburari respiratorii asociate
* cresterea volumului cerebral antreneaza reducerea patului vascular, iar in cazul in care tensiunea intracraniana este mai mare decat presiunea de perfuzie a creierului, apare ischemia ireversibila
Efectele edemului cerebral sunt urmatoarele:
* in substanta cenusie se produc alterari neuronale si gliale
* in substanta alba se produc demielinizari si alterari vasculare
Edemul cerebral cu varsaturile incoercibile care il insotesc este responsabil in buna masura de efractiile de mucoasa gastrica cu sangerari consecutive.
2. Colapsul cerebroventricular (sindromul de hipotensiune intracraniana)
Nu este un efect traumatic specific. Poate fi regasit si in circumstante netraumatice in care survin, fie deperditii hidrice, fie spoliere de LCR. Cele mai frecvente forme sunt cele posttraumatice si cele postoperatorii, formele aparent primitive fiind foarte rare.
3. Accidentele vasculare posttraumatice
a. Tromboza arteriala posttraumatica
b. Tromboza venoasa posttraumatica
c. Fistulele carotido-cavernoase
Ischemia si sau hipoxia cerebrala pot apare ca urmare a socului, stenozei sau obstructiei vasculare, vasospasmului, neurotraumei sau a stopului cardiac.
Leziunea ischemica sau hipoxica declanseaza o cascada de mecanisme fiziopatologice care duc la moartea neuronala.
Prima faza a cascadei ischemice este de acumulare de acid lactic rezultat in urma glicolizei anaerobe. Aceasta duce la cresterea permeabilitatii membranare cu aparitia edemelor.
Deoarece metabolismul anaerob nu este eficient in a mentine rezervele energetice celulare, are loc depletia rezervelor de ATP cu insuficienta secundara a pompelor ionice membranare ATP-dependente .
In a 2-a etapa a cascadei ischemice are loc depolarizarea membranara prin eliberarea neurotransmitatorilor excitatori (glutamina, aspartat) cu activarea canalelor ionice de Na+ si Ca2+ NMDA, AMPA si voltaj dependente.
Cresterea consecutiva a influxului de Na+ si Ca2+ activeaza procesele catabolice intracelulare.
Ca2+ activeaza lipidperoxidazele, proteazele si fosfolipazele care la randul lor cresc concentratia intracelulara de AGL si radicali liberi de oxigen.
In plus, activarea caspazelor (proteine ICE-like), translocazelor si endonucleazelor initiaza modificari structurale progresive ale membranelor biologice si ale AND-ului nucleozomal.
Impreuna toate aceste evenimente duc la degenerarea membranara a structurilor vasculare si celulare cu necroza sau apotoza consecutiva.
Strategiile de protectie cerebrala fata de leziunile ischemic-hipoxice se bazeaza pe cunoasterea si intelegerea mecanismelor fiziopatologice.
Cele mai importante si mai eficiente masuri de neuroprotectie sunt mentinerea unei presiuni normale de perfuzie cerebrala, normoxia si decompresia chirurgicala. In completarea acestora sunt metodele farmacologice ce cuprind masurile de crestere a fluxului sanguin cerebral in teritoriul ischemic, scadarea metabolismului cerebral si a presiunii intracraniene, inhibitia acumularii de acid lactic si a activitatii neurotransmitatorilor excitatori, blocarea influxului de Ca2+, inhibitia lipidperoxidarii si indepartarea radicalilor liberi.
Mecanismele de neuroprotectie propuse cuprind: scaderea metabolismului cerebral si a presiunii intracraniene, supresia activitatii electrice si a tonusului simpatic, precum si modificarea termoreglarii. Mecanisme suplimentare: scaderea concentratiei de Ca2+ intracelular si prevenirea acumularii de radicali liberi.
Isofluranul, sevofluranul si desfluranul produc supresia maximala a metabolismului cerebral in paralel cu cresterea concentratiei ET > 2 MAC. Acest fenomen sugereaza ca anestezicele volatile pot corecta dezechilibrul dintre aportul si cererea de O2 din timpul ischemiei cerebrale focale.
Studiile efectuate la animale cu ischemie cerebrala focala sau emisferica au aratat ca isofluranul, sevofluranul si desfluranul pot scadea marimea ariei infarctate si imbunatatesc prognosticul atunci cand sunt administrate inainte de evenimentul ischemic.
Aceste date experimentale sunt completate de studii privind administrarea sevofluranului la pacientii la care s-a practicat endaraterectomie carotidiana si care au aratat cresterea tolerantei la nivele scazute ale fluxului sanguin cerebral cu mentinerea functiei neuronale in timpul clamparii carotidiene, comparativ cu halotanul sau enfluranul.
In contrast cu cele afirmate mai sus anestezicele volatile nu au proprietati neuroprotectoare in conditii de ischemie cerebrala globala sau atunci cand sunt administrate dupa trigger-ul ischemic.
Este discutabil daca efectele antinecrotice ale anestezicelor volatile observate in diferite modele de ischemie sunt permanente.
Mecanismele de moarte neuronala sunt necroza (tumefiere celulara, pierderea potentialului membranar mitocondrial, scaderea productiei de ATP, liza membranelor biologice cu captarea detritusurilor celulare de catre macrofage) sau apoptoza (degradarea progresiva a membranei nucleare, condensarea cromatiniana si fragmentarea ADN-ului) sau cu producerea unor mici particule continand resturi celulare (corpi apoptotici) daca tesutul este supus unui grad mai mic de hipoxie sau ischemie.
Studiile efectuate la sobolani privind ischemia cerebrala focala au aratat ca necroza celulara a fost semnificativ redusa la 2 zile de la ischemie la grupul care a primit in aceasta perioada anestezic volatil (isofluran) comparativ cu grupul nu a primit anestezie.
Cu toate acestea, la 14 zile de la evnimentul ischemic leziunile corticale si subcorticale au fost similare in cele doua grupuri, sugerand ca anestezicele volatile scad consumul energetic in teritoriul ischemic, cu scaderea consecutiva a necrozei neuronale imediate.
Shift-ul metabolic necesar reducerii consumului enegetic este insuficient pentru a restabili in totalitate integritatea neuronala si initierea apoptozei va contracara efectul neuroprotector initial.
Studiile la animalele de laborator au aratat ca barbituricele, precum si propofolul reduc aria de infarct si inbunatatesc prognosticul neurologic dupa ischemia cerebrala focala sau globala incompleta pe durata experimentului.
In timp ce datele experimentale sustin efectele neuroprotectoare ale agentilor hipnotici, datele clinice sunt mai putin convingatoare.
In interventiile chirurgicale ce necesita by-pass cardio-pulmonar, normotermia obtinuta prin administrarea de thiopental (doza max. 39,5±8,4 mg/Kc iv) a fost eficienta in a reduce deficitele neurofiziologice in perioada postoperatorie.
Prin contrast, barbituricele administrate la pacientul comatos in prima ora dupa resuscitarea cardio-pulmonara a fost ineficienta in a scade mortalitatea sau deficitele neurologice la supravietuitori comparativ cu pacientii care au primit terapie STI standard.
Administrarea hipnoticelor inainte de trigger-ul ischemic poate creste toleranta neuronilor la ischemie.
Barbituricele pot avea efecte benefice la pacientii cu TCC grav si HIC refractara. Aceasta afirmatie se bazeaza pe o serie de studii clinice in care administrarea barbituricelor a fost eficienta pentru a reduce PIC si mortalitatea dupa traumatismul crebral, cu conditia mentinerii echilibrului hemodinamic.
Recent si propofolul este propus ca alternativa la barbiturice in interventiile cardio-vasculare sau pentru sedare in traumatismele cerebrale.
Desi, comparativ cu sufentanilul, propofolul nu reduce deficitele neurofiziologice secundare interventiilor valvulare cardiace, s-a demonstrat eficienta sa in tratamentul PIC crescute, cu un prognostic neurologic in TCC similar celui obtinut prin administrarea de opioide.
Manitolul este un agent osmodiuretic care scade PIC, creste presiunea de perfuzie cerebrala si imbunatateste fluxul sangvin cerebral.
Aceste efecte se datoreaza cresterii volumului plasmatic, cu scaderea hematocritului, a vascozitatii plasmei si a volumului sanguin cerebral, ca si mobilizarea lichidului extracelular conform gradientului osmotic.
Tratamentul HIC prin administrare de manitol (0,25-1 g/Kc/zi, max. 4g/Kc) este mult mai eficient decat utilizarea barbituricelor.
Se recomanda ca administrarea sa se faca dupa scheme de algoritm riguroase, si nu in perfuzie continua pentru un control bun al PIC.
Ca raspuns la variatiile rapide ale osmolaritatii poate apare necroza tubulara acuta, astfel incat e necesara monitorizarea osmolaritatii plasmatice ce trebuie mentinuta la valori < 320 mosm/l.
Precautii privind efectul de rebound al manitolului (acumulare in spațiul extracelular) sunt necesare in situatiile in care durata tratamentului depaseste 4 zile sau cand este alterata bariera hematoencefalica.
Manitolul poate fi folosit atata timp cat PIC crescuta ramane osmosensibila.
Alternativa la manitol este solutia salina hipertona (7,5 %).
La pacientul cu leziuni multiple, solutia salina hipertona utilizata pentru resuscitarea volemica va creste PA paralel cu scaderea PIC. In mod curent, solutia salina hipertona reprezinta o optiune si nu un standard in tratamentul PIC crescute, in absenta unor date clinice care sa-i demonstreze superioritatea fata de manitol.
Studii efectuate pe animalul de laborator si la om, au aratat ca hiperglicemia se asociaza cu agravarea prognosticului dupa AVC sau TCC.
Mecanismele prin care normoglicemia poate proteja tesutul neuronal sunt:
Scaderea acidozei lactice intracelulare
Scaderea permeabilitatii membranare si a edemului celulelor endoteliale, nevrogliilor si neuronilor
Concentratia plasmatica a glucozei trebuie evaluata la fiecare 2 ore pentru a fi mentinuta intre 100-150 mg/dl.
Mecanismele de neuroprotectie ale blocantelor de calciu sunt: vasodilatatia cerebrala, preventia vasospasmului, scaderea influxului de calciu si modularea metabolismului AGL. Studiile la animale sunt contradictorii.
In timp ce o serie de studii au demonstrat diminuarea leziunilor neuronale si imbunatatirea prognosticului dupa ischemia focala, altele au esuat in a demonstra vreun beneficiu.
Efecte neuroprotectoare a avut doar Ca2+ antagonistul SNX-111, tipul N, la modele animale in administrarea la < 24 ore de la leziunea ischemica.
Trialurile clinice au testat efectele neuroprotectoare ale nimodipinei (tipul L) la pacientii cu AVC ischemic acut sau hemoragie subarahnoidiana.
O metaanalizacuprinzand 9 trialuri cu un numar total de 377 pacienti cu AVC acut a aratat ca administrarea nimodipinei in primele 12 ore de la debut imbunatateste prognosticul pacientilor.
Blocantele canalelor de calciu pot induce hipotensiune arteriala sub pragul ischemic individual astfel incat o scadere semnificativa a tensiunii arteriale va contracara efectul neuroprotector. Acesta afirmatie este concordanta cu cea mai recenta analiza Cochrane care nu a identificat vreun beneficiu al nimodipinei la pacientul cu AVC ischemic sau hemoragie posttraumatica.
Nimodipina administrata oral scade riscul cu 5,1 % la pacientul cu hemoragie subarahnoidiana.
Neurotransmitatorii excitatori (glutamatul, aspartatul) stimuleaza receptorii NMDA.
Activarea acestor receptori initiaza procese catabolice intracelulare astfel incat blocarea receptorului NMDA poate proteja țesutul cerebral.
Ketamina, MK-801 (dizocilpina), Aptiganel, Dextrometorfan, Dextrorfan si magneziul sunt antagoniști non-competitivi ai NMDA.
La modele animale cu ischemie cerebrala incompleta, Ketamina si MK801 au redus leziunea neuronala si au imbunatatit prognosticul.
Perfuzia cu Selfotel (antagonist NMDA-CGS 19755) a redus aria de infarct din ischemia globala sau focala.
Trialurile clinice in care s-au administrat MK801 s-au incheiat prematur datorita efectelor adverse toxice si efectului de vacuolizare mitocondriala.
Administrarea de dextrometorfan si dextrorfan s-au insotit de efecte adverse precum halucinatii, agitatie si sedare.
Sunt in desfasurare trialuri clinice de faza III cuprinzand pacienti cu AVC sau TCC la care se administreaza Aptiganel. Comitetele de supraveghere au semnalat in aceste cazuri aparitia de fenomene halucinatorii severe.
Alte 4 trialuri clinice s-au terminat prematur datorita efectelor adverse ale Selfotelului.
Singurul antagonist NMDA cu efect neuroprotector dovedit este drogul antiepileptic Remacemid. Administrarea lui in perioada post-operatorie la pacientii cu by-pass coronarian a redus semnificativ deficitele neurofiziologice avand ca singur efect advers ameteala.
Mecanismele propuse prin care GC reduc leziunile neuronale sunt:
Indepartarea radicalilor liberi
Preventia acumularii de AGL prin inhibitia lipidperoxidarii
Cresterea stabilitatii bistratului lipidic
Studii efectuate la pacienti cu AVC sau post resuscitare cardiaca, nu au demonstrat o reducere semnificativa sau imbunatatirea prognosticului neurologic dupa pev. cu GC (dexametazona, metilprednisolon), contrar rezultatelor pozitive obtinute experimental.
De asemenea, trialurile clinice controlate nu au putut exclude beneficiile sau reactiile adverse ale administrarii de dexametazona sau metilprednisolon la pacientii cu AVC ischemic sau leziuni cerebrale posttraumatice. Se considera ca anumite subgrupe de pacienti pot beneficia de efectele benefice de inhibitie a lipidperoxidazelor ale GC.
Comparativ cu administrarea de GC in TCC sau AVC, pev. cu metilprednisolon 30 mg/Kc bolus, urmata de 5,4 mg/Kc/24 ore initiata in primele 3 ore de la trauma sau 30 mg/Kc bolus urmata de 5,4 mg/Kc/48 ore la 3-8 ore de la trauma, poate reduce deficitele motorii si imbunatateste functia tracturilor nervoase senzitive.
Tirilazadul mesilat (U-74006F) este un inhibitor potent al radicalilor liberi de O2 rezultati in urma lipidperoxidarii.
Majoritatea investigatiilor de laborator au aratat ca tirilazadul reduce aria de infarct si imbunatateste prognosticul neurologic la modelele experimentale cu ischemie cerebrala tranzitorie sau permanenta, focala sau globala, chiar si in administrarea postinjurie.
Prin contrast, trialurile clinice de faza III au esuat in a confirma efectele neuroprotectoare la pacientii cu AVC acut, hemoragie subarahnoidiana sau TCC.
Superoxiddismutaza (SOD) este un antioxidant natural prezent cu 2 izoforme: SOD citosolica Cu-Zn si SOD mitocondriala Mn.
Studiile efectuate pe culturi celulare si soareci transgenici, au aratat ca SOD reduce maxim stresul oxidativ celular.
Deoarece SOD are o penetrabilitate redusa prin bariera hematoencefalica si membranele celulare, a fost conjugata cu PEG (polietilenglicol) pentru a-i creste biodisponibilitatea.
Desi trialurile clinice de faza II au aratat ca PEG-SOD in concentratii mari a redus mortalitatea la pacientii cu TCC grav, trialurile clinice de faza III cuprinzand un numar de 463 pacienti cu TCC nu au confirmat efectele neuroprotectoare ale PEG-SOD.
Nicaravenul reduce deficitele neurologice la pacientii cu hemoragie subarahnoidiana de cauza anevrismala (trial clinic de faza III).
Interesul fata de aceasta metoda se datoreaza informatiilor recente despre efectele cerebrale ale hipotermiei usoare si moderate.
Studii la animalul de laborator, dar si la om au aratat ca o usoara reducere a temperaturii cerebrale protejeaza sesutul neuronal in situatiile de PIC crescuta sau ischemie cerebrala.
S-a sugerat ca efectul protector al hipotermiei se datoreaza supresiei proceselor biochimice majore si inhibitiei generarii de radicali liberi sau acumularii produsilor de lipidperoxidare.
Alte studii au indicat ca mici variatii ale temperaturii diminua fluxul sanguin cerebral si previn hipo sau hiperperfuzia postischemica si formarea edemului cerebral.
Studii de faza I sau II ce au cuprins pacienti cu TCC, stop cardiac sau AVC sugereaza ca deficitele neurologice si mortalitatea sunt semnificativ reduse, daca hipotermia este indusa in primele 6-24 ore de la injurie si mentinuta pentru 24-48 ore.
In timp ce 2 trialuri multicentrice au confirmat efectele neuroprotectoare ale hipotermiei dupa stopul cardiac, utilitatea hipotermiei in interventiile neurochirurgicale-microchirurgicale (anevrisme cerebrale) este in curs de investigare.
Rezultatele promitatoare ale unui studiu de faza II la pacienti cu TCC nu au fost confirmate de un trial randomizat de faza II.
Pentru utilizarea terapeutica a hipotermiei la pacientii cu boala cerebrovasculara acuta, trebuie definite conditiile in care se va desfasura aceasta:
Timpul optim de initiere a hipotermiei
Temperatura optima
Durata perioadei de hipotermie
Regimul optim pentru reincalzire
In timp ce efectele benefice ale hipotermiei raman neclare, hipertemia trebuie combatuta agresiv la pacientii cu ischemie cerebrala.
Evacuarea rapida a colectiilor epidurale, subdurale si intraparenchimatoase este o metoda eficienta de tratament a leziunilor secundare. Craniectomia decompresiva este o optiune terapeutica in HIC refractara secundara TCC, CPR sau AVC.
Studii observationale ce au utilizat informatii provenind de la Banca de Date a Comelor Traumatice sugereaza aceea ca craniectomia decompresiva larga FTP bilaterala combinata cu plastie de dura scade mortalitatea si imbunatateste prognosticul neurologic in special la pacientii tineri.
In timp ce decompresia chirurgicala e considerata linie terapeutica secundara impreuna cu hiperventilatia si hipotermia, s-a sugerat ca trebuie efectuata precoce pentru a evita leziunea neuronala urmare a HIC.
Cele mai importante si eficiente masuri neuroprotectoare sunt:
Mentinerea presiunii de perfuzie cerebrala la valori normale sau crescute
Normoxia
Decompresia chirurgicala
Interventiile de crestere a fluxului sanguin cerebral in teritoriile ischemice, scaderea metabolismului cerebral, preventia acidozei lactice si a activitatii neurotransmițatorilor activatori, preventia influxului de calciu, inhibiția lipidperoxidarii, indepartarea radicalilor liberi au fost propuse ca masuri protectoare in ischemia cerebrala.
Cu greu, aceste masuri terapeutice si-au dovedit eficienta in conditii de ischemie.
Folosind cunostintele actuale, urmatoarele interventii fizice si farmacologice par a fi protectoare intr-o varietate de stari fiziopatologice:
Anestezicele administrate inaintea instalarii ischemiei par a creste toleranta la ischemie a neuronilor. Barbituricele pot scade PIC crescuta si imbunatatesc prognosticul neurologic.
Hiperglicemia se asociaza cu un prognostic nefavorabil in caz de AVC sau neurotrauma. Glicemia trebuie mentinuta intre valori de 100-150mg/dl, prin monitorizare la fiecare 2 ore.
Normotermia trebuie mentinuta in toate cazurile; efectele hipotermiei moderate raman neclare
Nimodipina este ineficienta la pacientii cu infarct cerebral ischemic sau hemoragic.
In general, GC nu au efect (pozitiv sau negativ) semnificativ la pacientii cu TCC sau AVC acut Megadozele de metilprednisolon aduc o imbunatatire usoara a functiei motorii si senzoriale in traumatismele vertebromedulare
Decompresia chirurgicala trebuie considerata un caz de HIC refractara
MONITORIZAREA IN STI A TCC
1) Presiunea de perfuzie cerebrala si presiunea arteriala
Monitorizarea invaziva a presiunii arteriale este obligatorie la orice pacient cu o injurie cerebrala semnificativa. Monitorizarea ICP si calcularea constanta a CPP trebuie facuta la fiecare pacient cu traumatism cranian care prezinta anomalii CT si GCS mai mic sau egal decat 8. Legat de pacientii cu SAH gradul presiunii intracraniene este direct corelat cu statusul clinic al pacientului independent de marimea ventriculilor. Aceasta se datoreaza faptului ca presiunea intracraniana crescuta rezulta cel mai adesea din combinatia de hidrocefalie si edem cerebral evident datorate restrictiei circulatorii cerebrale initiale. Acesta este motivul pentru care se recomanda cu fermitate masurarea ICP la fiecare pacient dupa SAH, exceptie facand doar coma post sedare excesiva sau postcritic.
2) Fluxul sanguin cerebral adecvat
a) Doppler transcranial
TCD masoara velocitatea hematiilor care circula intr-un vas. Ea are o singura dimensiune pe unitatea de timp (uzual masurata in cm/s). Pe de alta parte CBF este o masuratoare tridimensionala a volumului de sange livrat pe unitatea de tesut cerebral, pe unitatea de timp (masurata uzual in ml/100g/min). Cei 2 parametrii sunt cantitativ diferiti, corelatia dintre valorile absolute ale FV si CBF este saraca. Oricum zona lor de intersectare ramane constanta, CBF si FV vor varia in mod direct una in functie de cealalta. Diametrul MCA pare a fi relativ constant in conditiile schimbarii BP si a presiunii CO2 in creierul normal, asa cum s-a demonstrat la voluntarii sanatosi si la pacientii clinic stabili. La pacientii instabili cu injurii acute cerebrale, diametrul MCA poate fi alterat de schimbarile in ICP si de efectele vasospasmului reducand fundamentul relatiei dintre CBF relativ si FV. Relatia variabila dintre FV absolut si CBF absolut este un dezavantaj clar reflectat de variatia normala la nivelul MCA FV intre 35 si 90 cm/s in statusul repausului. Astfel TCD impune precautie in interpretare cand incercam sa estimam CBF din FV izolat fata de alti parametri la pacientii cu trauma craniana. Forma undei MCA si FV obtinuta prin folosirea TCD este dependenta de forma unei presiuni arteriale a sangelui si de proprietatile vascoelastice ale patului cerebrovascular care fac ca reologia sangelui sa ramana constanta. Astfel daca variabile ca diametrul BCA si BP raman constante, pulsabilitatea fluxului sanguin prin vasele de conducere reflecta rezistenta cerebrovasculara distala. Determinantii comuni ai schimbarii pulsatilitatii MCA includ tensiunea, CO2 si CPP. S-au formulat o serie de indici descriptivi pentru pulsatilitatea sangelui, cel mai comun este indexul pulsatilitatii (PI al lui Gosling)
Gosling PI=(FVs-FVd)/Fvmean
In traumatismul cranian PI este bine corelat cu CPP, masurarea continua a velocitatii medii MCA este mai putin eficienta decat SvjO2 pentru monitorizarea continua a perfuziei cerebrale din 2 motive: primul este practic, mentinerea probelor Doppler in limite normale in ciuda nursingului este aproape imposibila pentru o perioada lunga de timp. Al doilea este absenta valorilor normale.
b) Monitorizarea SvjO2
Ca pentru orice alt organ saturatia sangelui venos venit de la creier depinde de Sa O2 Hb, CMR O2 si CBF conform ecuatiei urmatoare:
SvjO2 = Sa O2 - CMR O2 / 1.34.Hb.CBF.10
daca Sa O2, continutul de hemoglobina si CMR O2 raman constante. De exemplu, daca pacientul este hemodinamic stabil si sedat continuu, SvjO2 este invers proportionala cu CBF: orice modificare in CBF va duce la o schimbare in sens opus in SvjO2.
Svj O2 la indivizii normali este 65%. Un Svj O2 < 50% indica ischemie si o alterare a schimburilor dintre CBF si metabolism. Atunci cand tehnica este folosita, masuratoarea Svj O2 are urmatoarele limite:
Masuratoarea este efectuata prin cateter introdus percutan in vena jugulara interna si plasat in directie retrograda. Varful cateterului trebuie sa fie localizat in bulbul jugular si poziția sa fie verificata prin radiografie sau CT.
Svj O2 poate fi masurata atat discontinuu prin extragerea unei mostre de sange din cateter si masurarea saturatiei de oxigen printr-un co-oximetru, cat si continuu prin folosirea unui cateter fibrooptic. Eficacitatea unui cateter cu fibra optica este limitata, deoarece adesea varful cateterului este in contact strans cu peretele vascular si intensitatea luminoasa reflectata este marcat redusa si citirea este incorecta. Aceasta se intampla deoarece cateterul este introdus in contracurent venos. In orice caz, calibrarea cateterului necesita prezenta foarte apropiata de pacient a aparatului de masurare a gazelor sanguine pentru a nu aparea supraestimarea Pa O2 si Svj O2 ce apar datorita timpului tardiv de efectuare.
3) volemia si debitul cardiac
a) simptome clinice
prezenta hipovolemiei este cel mai bine evaluata prin semne clinice ca hipotensiunea, tahicardia, incapacitatea de a tolera agentii anestezici si variatia inspir-expir a presiunii arteriale in ventilatia cu presiune pozitiva
b) biochimie: ureea, proteine, hematocrit, troponina
nu sunt modificari biochimice folosite ca indicatori ai hipovolemiei in contextul leziunii cerebrale. O crestere a troponinei in contextul traumei craniene favorizeaza ipoteza asocierii unei traume toracice sau cardiace. Cresterea troponinei in contextul SAH indica implicarea cardiaca cu leziune miocardica cu origine simpatica (23-25). Se recomanda intens in acest caz o ecografie transesofagiana.
c) Cateter Swan-Ganz, PiCCo si TTE/TOE
Este regula folosirea monitorizarii invazive atata vreme cat pacientul prezinta insuficienta cardiaca combinata sau nu cu edem pulmonar. Introducerea cateterului Swan-Ganz este obligatorie la pacientii cu insuficienta cardiopulmonara secundara leziunii cerebrale. Functia cardiaca trebuie verificata repetat prin ecografie transesofagiana. Acest lucru este cel mai corect atat timp cat pacientul prezinta un argument pentru vasospasm. Insuficienta cardiaca este un factor bine cunoscut pentru sechelele ischemice in contextul de spasm. In acest caz particular, permiterea unei volemii si a unui debit cardiac scazut datorita unei cresteri a presiunii arteriale pot conduce la o degradare ulterioara a debitului sanguin cerebral si accentuarii leziunii cerebrale.
Strategii terapeutice
presiunea de perfuzie cerebrala CPP, compusa din MAP minus ICP, este stimulul la care apare raspunsul de autoreglare vasculara. Pragul autoreglarii variaza invers proportional cu PaCO2, ex. in conditii de hipercapnie, pragul este redus. Sub aceasta limita perfuzia depinde in mod critic de presiune. Peste aceasta limita, rezistenta vasculara creste si debitul sanguin cerebral scade, reducand ICP. Leziunea traumatica deplaseaza curba de autoreglare cerebrala la dreapta datorita cresterii rezistentei vasculare cerebrale si in mod critic a presiunii de inchidere. CPP trebuie sa fie mentinuta deasupra limitei inferioare a autoreglarii estimata (26,27). Sub aceasta limita perfuzia este in mod critic dependenta de presiune. Acelasi mecanism apare la pacientii cu SAH si edem cerebral cel mai adesea secundar hipoperfuziei cerebrale initiale. Totusi, in acest ultim caz, presiunea arteriala poate fi crescuta doar dupa ce anevrismul a fost tratat fie prin embolizare sau chirurgical. Acesta este unul din principalele motive pentru tratamentul imediat al anevrismului.
La pacientii cu leziune cerebrala severa, aparitia hipotensiunii a fost asociata in unele studii cu un prognostic neurologic prost. Hipertensiunea indusa implica cresterea perfuziei cerebrale la cel putin 70 mmHg. La pacientii cu SAH, terapia "triplu H" este recomandata pentru tratamentul spasmului. Desi nu este documentata, folosirea preventiva a terapiei "triplu H" castiga teren, si este din ce in ce mai larg folosita in sectia de terapie intensiva neurochirurgicala. Atitudinea este posibila doar dupa ce anevrismul a fost securizat prin chirugie sau embolizare.
norepinefrina este catecolamina cea mai usor de folosit. Trebuie administrata printr-un cateter central ca unic drog pe cale. Circulatia cerebrala are putini receptori alfa si de aceea nu apare vasoconstrictie directa in teritoriu cerebral.
Normovolemia trebuie sa fie mentinuta. Cel mai folosit lichid perfuzat este cristaloidul. Solutiile hipertonice pot fi administrate daca edemul cerebral este prezent folosirea lui trebuie sa se faca daca ischemia cu intreruperea barierei hematoencefalice este prezenta deoarece se exacerbeaza edemul in acest caz.
Se pare ca contrar a ceea ce include terminologia de terapia de triplu "H", hemodilutia insasi trebuie evitata. Ekelund si colaboratorii au demonstrat ca in SAH cresterea globala a CBF indusa prin hemodilutie (hematocritul redus sub 36% pana la 28%) este contrabalansata printr-o reducere pronuntata a capacitatii de furnizare a oxigenului, astfel scazand rata de eliberare a oxigenului la nivel cerebral.
Folosirea lor in cazul insuficientei cardiace acute secundare leziunii cerebrale nu difera de folosire lor generala, cu exceptia faptului ca insuficienta cardiaca secundara leziunii cerebrale este adesea tranzitorie. Pacientii sunt adesea incarcati de pe inotropi dupa cateva zile.
Diabetul insipid este tratat cu desmopresina (1 microgram iv o data pe zi cel mai adesea). Pierderile de sare pe cale renala secundare raspunsului cerebral de pierdere a sarurilor, reactioneaza bine la terapia hormonala mineralocorticoida (fludrocortizon acetat 0,1-0,4 mg/zi) (29). Unii autori au recomandat sa se inhibe siostematic natriureza dupa SAH cu fludrocortizon acetat in cursul terapiei hipervolemice (30)
pentru grupul cu risc mare ca pacientii cu trauma craniana, utilizarea hipertensiunii induse poate creste incidenta si severitatea ARDS simptomatic. Efectul hipertensiunii induse asupra incidentei si severitatii ARDS la populatia cu trauma craniana a fost studiata de Constant si colaboratorii (31) care a comparat doua strategii de management al starilor acute de leziune cerebrala severa: un protocol ce prevede mentinerea unui debit sanguin cerebral tinta si celalalt in care scopul a fost o anumita presiune intracraniana tinta. Primii pacienti au primit un aport lichidian mare si doze mari de vasopresor comparativ cu martorul. Ca o consecinta, incidenta ARDS a fost de 5 ori mai mare la cei cu debitul sanguin tinta decat la cei cu protocolul de mentinere a presiunii intracraniene (15% comparativ cu 3,3%).
dupa hemoragia subarahnoidiana, combinatia dintre hipervolemie, hemodilutie si hipertensiune reprezinta "piatra de hotar" al tratamentului vasospasmului. Initierea terapiei "triplu H" ca regim profilactic trebuie luata in balans cu posibilele complicatii vitale, ca edemul pulmonar. Solenski a investigat complicatiile SAH si au gasit o incidenta a edemului pulmonar de 23%. Ei au observat ca folosirea lichidelor si manipularea creierului in cursul operatiei contribuie la geneza edemului pulmonar. Tratamentul vasospasmului atat profilactic cat si curativ cu terapia "triplu H" a fost asociata cu o frecventa mai mare a edemului pulmonar, cel mai probabil datorita inducerii statusului hipervolemic (32). Reactiile adverse pulmonare ale terapiei "triplu H" pot fi si mai mult agravate prin leziunile endoteliului capilar pulmonar consecutive vasoconstrictiei pulmonare din hemoragia subarahnoidiana anevrismala.
In caz de ischemie, terapia "triplu H" trebuie administrata cu precautie pentru a nu se accentua edemul in zonele ischemice si a favoriza infarctul hemoragic (33).
In concluzie, tulburarile hidroelectrolitice si disfunctia cardiaca aparute in contextul leziunii cerebrale sunt secundare cresterii ICP si scaderii CPP. Aparte de tratamentul simptomatic, corectarea acestor doi parametri este obligatorie in ordine cu restabilirea statusului hemodinamic normal. Statusul hemodinamic sistemic joaca un rol major in hemodinamica cerebrala si justifica atentia particulara ce trebuie acordata pacientilor cu leziune cerebrala.
MALFORMATIILE ARTERIOVENOASE CEREBRALE, SUPURATIILE CEREBRALE , TUMORILE CEREBRALE POZE vezi CD de la mine
Bolile neurochirurgicale de mai sus, MAV arteriovenoase cerebrale, supuratiile cerebrale, tumorile cerebrale duc in evoluția lor la aparitia disfunctiei cerebrale cu afectarea starii de constienta, in functie de localizare, de tipul histopatologic, gradul de compresie, sangerare intracerebrala. Complicatia de temut a MAV cerebrale, hemoragia intracraniana, supuratia cerebrala si procesele inlocuitoare de spatiu au in centru afectarea ischemica neuronala, cu declansarea cascadei ischemice si inducerea apoptozei, cu impact negativ pe statusul neurologic al pacientului si pe recuperarea neuromotorie a pacientului pe termen scurt sau lung.
MAV si anevrisme cerebrale
Malformațiile arterio-venoase sunt definite ca leziuni vasculare cerebrale, caracterizate prin prezenta unui sunt arterio-venos, prin care sangele curge direct din sistemul arterial in cel venos, fara a mai trece prin sistemul capilar. Apar de obicei ca un ,,nidus" alimentat de un numar variabil de artere drenate de o serie de vene hipertrofiate.
Incidenta malformatiilor arteriovenoase este apreciata la 0,14 %. Malformatiile arteriovenoase sunt leziuni congenitale, dezvoltate in perioada prenatala, cu crestere postnatala sub influenta VEGF (vascular endothelial growth factor) si FGF-β (fibroblast growth factor β).
In interiorul nidusului se gasesc structuri cavernoase care nu prezinta structura specifica arterelor sau venelor, dar dezvolta o circulatie turbionara cu riscul de ruptura al peretelui vascular si constituirea hemoragiilor subarahnoidiene sau intraparenchimatoase. POZE
Anevrismele cerebrale reprezinta dilatatii sacciforme sau fuziforme ale peretelui arterial intalnite mai frecvent la nivelul modificarilor de traiect si bifurcatii.
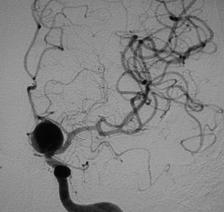
Fig.. Anevrism de artera comunicanta anterioara, injectat din artera carotida interna stanga.
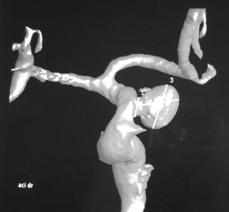
Fig.. Anevrism de artera carotida interna dreapta (3DSA).
Ele se dezvolta ca rezultat al proceselor degenerative ale peretelui arterial, conjugate cu efectele "turbulentei" hemodinamice, care sunt mai pregnante la nivelul zonelor sus amintite. Incidenta anevrismelor este estimata la 1-6%.
Cele mai comune cauze ale anevrismelor intracraniene sunt: leziunile vasculare degenerative sau hemodinamic-induse, ateroscleroza, vasculopatiile (displazia fibromusculara), patologiile cu flux crescut (malformatii arteriovenoase, fistule). Alte situatii mai rar implicate in etiopatogenia anevrismala sunt: alterarile structurii colagenului (sindromul Marfan, sindromul Ehlers-Danlos tip IV), boala polichistica renala, traumatismele, infectiile, neoplaziile primare sau secundare, unele medicamentele, contraceptivele orale, consumul de alcool, consumul de droguri (cocaina), fumatul, abuzurile alimentare, etc.
Complicatia majora ce poate surveni in astfel de situatii este ruptura anevrismului care se produce la nivelul fundului anevrismal sau la coletul sau, acolo unde si solicitarile create de hemodinamica viciata si degenerescenta parietala sunt maxime.
Consecintele acestei situatii sunt reprezentate de hemoragii subarahnoidiene sau intraparenchimatoase cu consecinte vitale sau functionale grave.
Tumorile cerebrale
Reprezinta aproximativ 50% din procesele expansive intracraniene (PEIC).
Tumorile cerebrale se deosebesc de pseudotumori, care prezinta o simptomatologie de tumora cerebrala, inclusiv fenomene de HIC, produse in afara unui PEIC (infectii, intoxicatii, tulburari metabolice, endocrinopatii).
Clasificarea tumorilor cerebrale a fost stabilita de OMS in 1993 și a fost revizuita la Lyon in 2000.
Tab.. CLASIFICAREA TUMORILOR SISTEMULUI NERVOS (OMS - 1993, REVIZUITA LA LYON - 2000)
TUMORI ALE TESUTULUI NEUROEPITELIAL
Tumori astrocitare
Astrocitom difuz
Astrocitom fibrilar
Astrocitom protoplasmatic
Astrocitom gemistocitic
Astrocitom anaplazic
Glioblastom
Glioblastom cu celule gigante
Gliosarcom
Astrocitom pilocitic
Xanloastrocitom pleomorf
Astrocitom subependimar cu celule gigante
Tumori oligodendrogliale
Oligodendrogliom
Oligodendrogliom anaplazic
Glioame mixte
Oligoastrocitom
Oligoastrocitom anaplazic
Tumori ependimare
Ependimom
Celular
Papilar
Cu celule clare
Tanicitic
Ependimom anaplazic
Ependimom mixopapilar
Subependimom
Tumori ale plexului coroid
Papilom de plex coroid
Carcinom de plex coroid
Tumori gliale cu origine incerta
Astroblastom
Gliomatosis cerebri
Gliom cordoid de ventricul III
Tumori neuronale si mixte, neurono-gliale
Gangliocitom
Gangliocitom displazic al cerebelului (Lhermitte-Duclos)
Astrocitom/gangliogliom desmoplazic infantil
Tumora neuroepiteliala disembrioplazica
Gangliogliom
Gangliogliom anaplazic
Neurocitom central
Liponeurocitom cerebelos
Paragangliom de filum terminale
Tumori neuroblastice
Neuroblastom olfactiv (estezioneuroblastom)
Neuroepiteliom olfactiv
Neuroblastoame ale glandelor suprarenale si sistemului nervos simpatic
Tumori ale parenchimului pineal
Pineocitom
Pineoblastom
Tumori ale parenchimului pineal cu diferentiere intermediara
Tumori embrionare
Meduloepiteliom
Ependimoblastom
Meduloblastom
Meduloblastom desmoplazic
Meduloblastom cu celule mari
Medulomioblastom
Meduloblastom melanotic
Tumori neuroectodermale primitive (PNET) supratentoriale
Neuroblastom
Ganglioneuroblastom
Tumora atipica teratoid-rabdoida
TUMORI ALE NERVILOR PERIFERICI
Schwannom/Neurinom/Neurilemom
Celular
Plexiform
Melanotic
Neurofibrom
Plexiform
Perineurom
Perineurom intraneural
Perineurom al tesuturilor moi
Tumora maligna a tecii nervilor periferici (MPNST)
Epitelioida
MPNST cu diferentiere divergenta meyenchimala si/sau epiteliala
Melanotica
Melanotica psamomatoasa
TUMORI ALE MENINGELOR
Tumori cu celule meningoteliale
Meningiom
Meningotelial
Fibros (fibroblastic)
Tranzitional (mixt)
Psamomatos
Angiomatos
Microchistic
Secretor
Bogat in limfoplasmocite
Metaplazic
Cu celule clare
Cordoid
Atipic
Papilar
Rabdoid
Meningiom anaplazic
Tumori mezenchimale non-meningoteliale
Lipom
Angiolipom
Hibernom
Liposarcom (intracranian)
Tumora fibroasa solitara
Fibrosarcom
Histiocitom fibros malign
Leiomiom
Leiorniosarcom
Rabdomicrn
Rabdomiosarcom
Condrom
Condrosarcom
Osteom
Osteosarcom
Osteocondrom
Hemangiom
Hemangioendoteliom epitelioid
Hemangiopericitom
Angiosarcom
Sarcom Kaposi
Leziuni melanocitare primare
Melanocitoza difuza
Melanocitom
Melanom malign
Melanomatoza meningeala
Tumori cu histogeneza incerta
Hemangioblastom
LIMFOAME SI NEOPLASME HEMATOPOIETICE
Limfoame maligne
Plasmocitom
Sarcom granulocitic
TUMORI CU CELULE GERMINALE
Germinom
Carcinom embrionar
Tumora de sac Yolk
Coriocarcinom
Teratom
Matur
Imatur
Teratom cu transformare maligna
Tumori mixte cu celule germinale
TUMORI ALE REGIUNII SELARE
Craniofaringiom
Adamantinomatos
Papilar
Tumora cu celule granulare
TUMORI METASTATICE
Desi tipul histopatologic este important sub aspect terapeutic si din punct de vedere al prognosticului, forma anatomopatologica a tumorii nu reprezinta un criteriu determinant pentru geneza complicatiilor digestive, in special a hemoragiilor digestive superioare. Mult mai importanta este insa localizarea formatiunii tumorale prin rapoartele pe care le are cu structurile nobile, pe care le poate afecta si prin posibilitatile variabile si riscurile diferite pe care le presupune abordul chirurgical.
Clasificarea principalelor formatiuni tumorale este facuta din punct de vedere al originii histologice si topografiei.
Pentru studiul tulburarilor gastrointestinale (HDS, ileus, sindroame dispeptice) la bolnavii cu tumori cerebrale, MAV, supuratii endocraniene, se fac referiri la urmatoarele situații clinice:
PEIC, MAV neoperate la care se inregistreaza un episod de HDS, ileus, etc.
PEIC, MAV operate unde stresul anestezicochirurgical, poate fi incriminat in cresterea procentelor de sangerari digestive;
Situatii clinice complexe - bolnavi cu tumori operate ce fac diverse complicații care necesita uneori ingrijiri de lunga durata sau reinterventii asociate cu stari de soc cum sunt comele prelungite, ramolismentul cerebral in patul tumoral, sangerari secundare de la acest nivel.
Tuberculoamele intracraniene si parazitozele cerebrale
Desi numarul tuberculoamelor intracraniene a scazut in ultima perioada cazurile de parazitoze cerebrale, in special chistul hidatic cerebral, se mentin la cifre inca ridicate.
Si in aceste cazuri, se aplica masuri energice de neuroprotectie cerebrala atat in cazurile neoperabile cat si in cele operabile atat in preoperator cat si in postoperator.
Prognosticul MAV cerebrale (arteriale si venoase) s-a imbunatatit in ultimii ani, la fel si in cazul tumorilor cerebrale si supuratiilor cerebrale deoarece masurile de investigatie si tratamentul in urgenta s-au imbunatatit si dezvoltat: embolizarea MAV in urgenta, tratamentul Gamma Knife, noi antibiotice cu spectru largit de actiune si eficienta ridicata, monitorizare si tratament in ATI.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |