Metoda orbitalelor moleculare (OM)
Legatura σs (s-s) - Molecula H2
Prin contopirea a 2 orbitale atomice s rezulta 2 orbitale moleculare
- 1 OM de legatura σs (– prin suprapunerea OA de acelas semn
- 1 OM de antilegatura σs* (cu energie mai ridicata) - prin suprapunerea OA de semn contrar neprezentata in fig. 3.6.
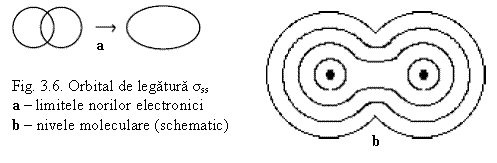
- OM de legatura se ocupa cu o pereche de electroni cu spini opusi
- electronii sunt atrasi de ambele nuclee
- densitatea electronica este maxima intre nuclee – in OM de legatura
- in OM de antilegatura densitatea electronica este minima – probabilitatea de a gasi electronul este minima, dar nu este zero.
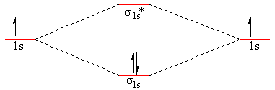
Din punct de vedere energetic noua situatie este avantajoasa deoarece prin popularea cu electroni a celor doua orbitale rezulta o situatie in care molecula H2 (cu o pereche de electroni prezenti pe acelasi orbital σ1s) are o energie mai coborata decat suma enegiei atomilor individuali asa cum reiasǎ din schema de mai jos:
![]()
![]()
Legatura σsp (sigma s-p ) de exemplu molecula HF
Aici, OA de tip s a hidrogenului se suprapune cu o OA de tip p a fluorului – rezulta doua OM: una de legatura σsp si o altǎ OM de antilegatura σs*. Reprezentarea doar pentru orbitala de legǎturǎ σsp este:
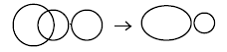
Legatura
σpp. MoleculaF2 posedǎ o
astfel de legǎturǎ a cǎrei formare care se reprezinta
astfel:
F F F2
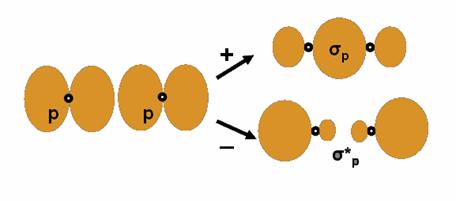
Norul electronic are densitatea maxima intre atomii ce formeaza molecula si mai exista doua planuri nodale situate lateral. Pe langa acesta mai apare si o orbitala de antilegatura σ*pp.
Legatura π (dubla). Se mai pot combina si doua orbitale p cu axele paralele dupa ce s-au combinat doua OA pe aceeasi axa (cu formare de legatura σp) – astfel ia nastere legatura πp - dubla – (prin suprapunerea a douǎ orbitale pz) care constituie a 2-a legatura dupa formarea legaturii simple σ.
Suprapunerea OA se realizeaza in doua zone si nu mai exista o axa de rotatie dar exista un plan nodal. Formarea acestei legaturi se poate reprezenta schematic astfel:
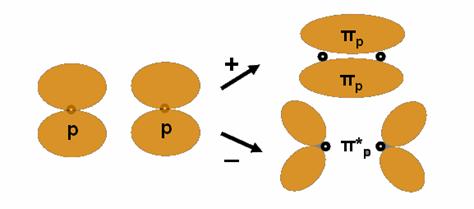
O astfel de legǎturǎ apare in urmǎtoarele exemple:
O2 O = O,
C2 , >C = C < sau
N2 ; N≡N - in ultimul caz existǎ in moleculǎ o legatura tripla (o legatura σ si doua legaturi π) este ilustrata pe fig 3.7. Se observa aici si forma orbitalilor de antilegatura, faptul ca volumul orbitalilor se mareste cu n dar si faptul cǎ noua distributie a energiei orbitalilor ocupati dupa principiile ocuparii cu electroni a orbitalilor.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |