
Surse de poluare cu metale grele
Alaturi de substantele organice si produsele petroliere, metalele in deosebi cele grele sunt substante toxice pentru mediu.care. Sunt considerate metale acele elemente care pierd cu usurinta electronii de valenta, dand nastere la ioni pozitivi, deci avand caracter electro pozitiv. Metalele cu densitatea > 5 g.cm‾³ sunt denumite metale grele.
In tabelul 4.1 sunt mentionate principalele caracteristici ale metalelor grele:
Principalele metale grele Tabelul 4.1
|
Denumire |
Simbol |
Grupa |
Numar atomic |
Masa atomica |
Densit. g/.cm3 |
Temp. de topire sC |
Temperatura de fierberesC |
Raza metalica Å |
|
Cupru |
Cu |
Ib | ||||||
|
Zinc |
Zn |
IIb | ||||||
|
Cadmiu |
Cd |
IIb | ||||||
|
Mercur |
Hg |
IIb | ||||||
|
Staniu |
Sn |
IVa | ||||||
|
Plumb |
Pb |
IVa | ||||||
|
Crom |
Cr |
VIb | ||||||
|
Cobalt |
Co |
VIIIb | ||||||
|
Nichel |
Ni |
VIIIb |
Sectorul industrial care polueaza mediul inconjurator cu metale si oxizi ai metalelor in principal, este sectorul metalurgiei extractive si al siderurgiei. Alaturi de aceste sectoare, turnatoriile si in general sectoarele metalurgice constituie surse de poluare cu metale, dar si cu alte substante chimice, substante ce rezulta in urma aplicarii tehnologiilor de fabricatie.
Dintre metalele utilizate cel mai frecvent in sectoarele industriale, cele mai poluante pentru mediul inconjurator sunt: plumbul, mercurul, cobaltul, cadmiul, cromul, nichelul si zincul. Aceste metale sunt obtinute prin procedee metalurgice, de regula in apropierea zonelor in care exista aceste zacaminte si in urma proceselor de prelucrare a acestor minereuri, respectiv: concentrare si aglomerare ele pot fi transportate si in alte zone spre a fi prelucrate. Acest fapt duce la o extindere a zonelor poluate cu aceste metale. Din pacate marea majoritate a metalelor sau a oxizilor acestor metale au tendinta de a se acumula in organism agravand starea de sanatate.
Plumbul (Pb)
Plumbul nu se gaseste liber in natura, ci numai sub forma de combinatii chimice. Principalele minerale ale plumbului sunt: galena (PbS), anglezitul (PbSO4), ceruzitul (PbCO3) si croroitul (PbCrO4). Minereul principal utilizat in metalurgia plumbului este galena care contine 86,6% plumb. De obicei zacamintele de galena contin si alte sulfuri metalice ca: blenda, pirita, calcopirita etc. cu care formeaza minereuri complexe.
In scoarta pamantului plumbul se gaseste intr-o proportie destul de redusa, procenul sau este de doar circa 0,002%.
Minereurile, care au un continut relativ scazut de plumb (1,5 - 6%), se imbogatesc prin flotatie, gravimetrie si diferenta de densitate. Pentru obtinerea plumbului exista metode pirometalurgice, hidrometalurgice si electrolitice. Importanta cea mai mare o au procedeele pirometalurgice.
In acest caz intervin urmatoarele operatii: prajire, aglomerare, topire reducatoare si rafinare.
Prin prajire se urmareste transformarea sulfurii de plumb in oxid de plumb si se desfasoara la 700 - 750sC potrivit reactiei:
2PbS + 3O2 = 2PbO + 2SO2
Gazele rezultate sunt formate din dioxid de sulf, trioxid de arsen si stibiu. Dioxidul de sulf este folosit la fabricarea H2 SO4, iar trioxidul de arsen si stibiu se recupereaza sub forma de praf.
Concentratului prajit i se adauga fondanti (silice si calcar), iar aglomeratul este supus operatiei de reducere si topire conform reactiilor:
PbO + C = Pb + CO
PbO + CO = Pb + CO2
Plumbul brut (94 - 96% Pb) obtinut contine un numar mare de impuritati ca: Cu, Ni, Co, Sn, As, Sb, Bi, S, Fe, Zn, si metale nobile, in primul rand argintul. Unele dintre acestea se separa cu metoda Harris. Plumbul din care s-a eliminat mai intai cuprul prin tratare cu sulf se trateaza cu o topitura de NaOH si NaCl la care se adauga azotat de sodiu si se agita intreaga topitura.Oxizii de arsen, staniu, stibiu si zinc reactioneaza cu hidroxidul de sodiu separandu-le din plumbul topit. Metalele pretioase se separa prin zincaj. Zincul in cantitate mica se adauga la plumbul topit. Aurul si argintul sunt foarte solubile in zincul topit. Zincul in care s-a dizolvat aurul si argintul se ridica la suprafata dupa agitare.
Industria este sursa majora de poluare cu plumb. Deci ca sursa de poluare cu plumb putem aminti:
mineritul;
industria metalurgica - obtinerea aliajelor;
fabricile de acumulatori si atelierele de recuperare a acumulatorilor;
fabricile de coloranti si vopsele - folosesc PbO, minereu de plumb (PbO si PbO2);
industria termoelectrica (carbunii si pacura contin plumb);
industria chimica - ca material anticoroziv (industria acidului sulfuric);
industria cauciucului si ebonitei;
industria cosmetica (coloranti pentru par, sapunuri);
industria ceramica, a sticlei si emailurilor;
ateliere de prelucrare ce folosesc aliaje ale plumbului cu diverse metale din care se fabrica lagare, ventile, pompe, cuzineti;
industria pesticidelor.
Intoxicatia cu plumb sau compusi ai sai este cea mai raspandita in mediile profesionale dupa cea cu oxid de carbon. Ea provine din alimente, aer, apa sau diverse produse industriale.
Intoxicatiile cu plumb si compusi ai sai au ca efect:
plumbismul - caracterizat cu crampe abdominale, dureri de cap, constipatie, pierderea poftei de mancare, oboseala, anemie, paralizia nervilor motorii, encefalopatie, stomatite, gingivite;
alterarea sintezei hemoglobinei si a timpului de supravietuire a globulelor rosii din sange;
perturbarea functionarii rinichilor;
saturnismul - anemie, guta, colici, dureri in abdomen, hipertensiune, artemie, provoaca avorturi, mortalitate infantila, predispozitii la tuberculoza.
Odata intrat in organism, plumbul este retinut de cortexul renal si ficat, dupa care este depozitat in oase prin inlocuirea Ca2+. Pb2+ in sange variaza in functie de gradul de expunere. Plumbul se elimina din organism foarte incet, mai ales prin bila si fecale, iar dupa alti autori preponderent prin urina.
Concentratia maxima admisa in apa potabila conform STAS 1342 - 91 este de 0,05 mg./dm³.
Mercurul (Hg)
Mercurul se afla raspandit in natura in proportie redusa (0,000007%) atat in stare nativa (mai putin), dar in cea mai mare parte, sub forma de minerale. Mineralul de baza folosit pentru extragerea mercurului este sulfura de mercur (HgS) numita si cinabru. Aceasta insoteste adesea sulfurile de fier, arsen, stibiu, plumb sau zinc.
Tehnologia de extragere a mercurului cuprinde operatia de prajire oxidant volatilizanta si are loc la temperatura de 700 - 750sC.
HgS + O2 = Hg +SO2
Gazele rezultate din zona de prajire sunt supuse unei desprafuiri si apoi sunt trecute in condensatoare ceramice sau metalice unde vaporii de mercur condenseaza separandu-se de celelalte gaze.
Mercurul, astfel obtinut, se filtreaza in scopul eliminarii impuritatilor solide dupa care se rafineaza prin distilare in vid sau prin electroliza.
Sursele de poluare cu mercur sunt:
industria miniera;
industria metalurgica;
industria chimica - obtinerea produselor clorosodice, coloranti, vopsele, pesticide, catalizatori;
industria electrotehnica - in care se produc instrumente de masurat, lampi de iluminat, redresoare de curent electric, sigurante electrice;
industria termoenergetica.
Din mediul abiotic (apa, aer, sol) mercurul trece in corpul plantelor si animalelor si din acestea, odata cu hrana, la om. Intoxicatiile cu mercur afecteaza sistemul digestiv si rinichii si se manifesta prin gust metalic, greata, dureri abdominale, voma, diaree, dureri de cap si albuminurie, apoi prin stomatite, gastrite, caderea dintilor si ulcer la buze si obraz.
Expunerile la doze severe produc tensiune si greutate in piept, greutate in respiratie si tuse, iar in stadiul final lipsa somnului, dureri de cap, ticuri faciale, tremuratul degetelor, delir, halucinatii si chiar moartea.
Simptomele uzuale la intoxicarile cronice sunt erethismul, gingivitele si tremuratul muscular si uneori nelineste nervoasa, insomnie, pierderea poftei de mancare. Cazurile severe de intoxicare pot duce la totala necoordonare a miscarii, deteriorarea auzului, inabilitate de a scrie sau a vorbi.
Compusii alchilici si arilici ai mercurului sunt cei mai periculosi si in primul rand (CH3)2Hg - metil mercur.
Concentratia maxima admisa in apa a mercurului conform STAS 4706- 88 este de 0,001 mg./dm³.
Cuprul (Cu)
Cuprul se gaseste in natura in stare nativa (in cantitati reduse) si indeosebi sub forma de combinatii chimice.
Din punct de vedere chimic mineralele cuprului sunt oxidice sau sulfuroase. Principalele minerale sunt: cuprit - Cu2 O (88,8% Cu), malachit - CuCO3 Cu(OH)2 care este cel mai raspandit minereu oxidic (57,4% Cu) si azurit - 2CuCO3 Cu(OH)2 (55,3% Cu), Calcozina - Cu2 S (79,8% Cu) care este materia prima de baza, calcopirita - CuFeS2 (34,6% Cu), care este al doilea mineral ca importanta si covelina - CuS (66,5% Cu).
Minereurile de cupru sulfuroase se prelucreaza pirometalurgic, iar concentratele oxidice cu concentrat de cupru mai scazut se prelucreaza pe cale hidrometalurgica.
Minereul de cupru este concasat, macinat si flotat pentru a se obtine un concentrat. Concentratul supus prelucrarii pirometalurgice suporta urmatoarele operatiuni: prajire, topire pentru obtinerea matei, convertizarea matei si rafinarea.
Prin prajire se urmareste indepartarea excesului de sulf, sulfurile de cupru disociindu-se, iar cele de plumb, zinc si fier se transforma in oxizi dupa reactiile:
2CuFeS2 + O2 = Cu2 S + 2FeS + SO2
PbS + 3/2O2 = PbO + SO2
ZnS +3/2O2 = ZnO + SO2
FeS + 3/2 O2 = FeO + SO2
Prin topire se separa sulfurile de oxizi, rezultand mata - un amestec de sulfuri - in stare lichida si zgura in care s-au adunat oxizii metalici. Topirea se face la peste 1400sC, iar zgura fiind mai usoara se decanteaza la suprafata.
Mata rezultata este trecuta intr-un convertizor unde se sufla aer sau oxigen pentru obtinerea cuprului brut.
In prima faza se oxideaza sulfura de fier la oxid de fier care impreuna cu un fondant adaugat (nisip) formeaza zgura, care este indepartata.
FeS + 3/2 O2 = FeO + SO2
2FeO + SiO2 = SiO2 (FeO)2
Prin oxidarea sulfurei de cupru se obtine cupru brut:
Cu2 S + 3/2 O2 = Cu2 O + SO2
Cu2 S + 2Cu2 O = 6Cu + SO2
Deoarece cuprul brut rezultat contine multe impuritati (Pb, Zn, Fe, Ag, etc.) se rafineaza in scopul elimininarii si recuperarii lor si rezulta cupru de puritate 99,99%.
Prin flotatie se obtine un concentrat cu 20 - 30 % Cu si un steril care contine 0,2 - 0,3 % Cu.
Sursele de poluare cu cupru sunt:
industria metalurgica - electrotehnica si fabricarea aliajelor;
industria chimica;
industria termoenergetica.
Cupru este un component normal al organismului, necesarul zilnic de cupru fiind de 1 - 2mg.
Cuprul este un element care in urme este necesar vietii. Lipsa de cupru produce lipsa de pofta de mancare, slabire, impiedica cresterea, anemie si sterilitate. La tratarea anemiei oamenilor cu solutie de CuSO4 se suporta usor cantitatile de cateva miligrame zilnic.
Sarurile de cupru sunt nocive pentru stomac, ataca inima, doza letala de CuSO4 fiind de aproximativ 10g., iar pentru acetatul bazic de cupru de 15 g. Atingerea ochilor cu saruri de cupru produce atacul mucozitatii pielii, tulburarea partilor cornoase ale pielii, orbire. Praful de cupru provoaca o inverzire a pielii, a parului si a dintilor.
Cantitatile mari de cupru au actiuni asupra sistemului nervos, ducand la tremuraturi si lipsa de coordonare in miscari. De asemenea sunt afectati ficatul si rinichii.
In intoxicatia cronica apar febra, greata, tuse, lizereu ginginal rosu inchis. Cuprul se localizeaza in ficat, pancreas, sistem nervos,muschi, oase.
Valorile admise in apa potabila sunt de 0,05 mg./dm³, iar in cazuri exceptionale de 0,1 mg./dm³.
Nichelul (Ni)
Nichelul este un metal destul de raspandit in scoarta pamantului, mai putin in stare nativa (nichelul provenit din meteoriti) si mai ales sub forma de combinatii chimice.
Dintre mineralele cu importanta deosebita pentru extragerea nichelului se mentioneaza: milleritul - NiS, cloantitul - NiAs, pentlanditul (FeNi)9S8, garnieritul - (NiMg)(OH)8 Si4 O10.
In functie de compozitia lor chimica, minereurile de nichel sunt grupate in doua categorii, oxidice si sulfuroase; ambele prezinta un caracter complex, pe langa nichel mai contin fier, cupru, plumb, cobalt etc. La extragerea nichelului din aceste minereuri se pot adapta procedee pirometalurgice sau hidrometalurgice.
Minereurile cu un continut mai mare de 1 - 3 % nichel se folosesc fara o imbogatire prealabila. Minereurile oxidice nu se supun operatiei de concentrare deoarece este dificil de realizat. La minereurile sulfuroase pentru cresterea continutului de nichel la maximum 15 % se aplica metoda de concentrare prin flotatie.
Surse de poluare cu nichel:
industria metalurgica - acoperiri metalice;
nichelare ;
electroliza unei solutii din sulfat de nichel, clorura de nichel si acid boric;
aliaje pentru constructia de masini, pentru electrotehnica, aliaje termorezistente, anticorozive si refractare.
industria chimica - catalizatori (pulbere neagra de nichel)
industria termoenergetica.
In timpul prelucrarii industriale, se poate produce poluarea, expunand organismele vii la intoxicatii. Intoxicatiile cu nichel privesc sistemul nervos, aparatul respirator, tubul digestiv si pielea. Simptomele acute constau in miscari necoordonate, paralizie, edem pulmonar etc.
Concentratia nichelului in apele uzate nu trebuie sa depaseasca la evacuare concentratia maxima admisa de 1 mg./dm³.
Manganul (Mn)
In scoarta terestra manganul este asociat frecvent cu fierul. Principalele minerale sunt: piroluzita (MnO2), rodocrosita (MnCO3), hausmanita (Mn3 O4), braunita (Mn2 O3).
Oxizii de mangan se pot reduce cu carbune in cuptoare inalte sau in cuptoare electrice. Manganul pur se poate obtine prin aluminotermie, electroliza unei solutii concentrate de MnSO4 sau prin dislocuire cu sodiu din MnF2 sau MnCl2.
Sursele de poluare cu mangan sunt :
siderurgia, fiind un element de aliere cu alte metale ca: fier, nichel, cupru, aluminiu;
fabricarea bateriilor uscate,
industria sticlei si ceramicii,
industria chimica, a vopselelor.
Apele provenite din aceste industrii sunt principalele surse de poluare cu mangan alaturi de prelucrarea si exploatarea minereurilor.
In organisme manganul este un oligoelement esential, functia lui fiind in legatura cu metabolismul oxigenului. Doza zilnica in cazul omului este de 5 - 10 mg. Doze mari de mangan ingerat pot cauza afectiuni locale (arderi ale tractului digestiv, voma, edem glotic, hemoragii digestive) si generale (tulburari hepatice, respiratorii si cardiovasculare).
In intoxicatiile cronice apar simptome de tip neurologic, se dezvolta lent dupa ani de expunere. Apar cefalee, artenii,somnolenta, modificari ale mersului "mers de cocos", tremur parkinsonian, disgrafie, disartrie, afectarea psihicului. In apa potabila concentratia de mangan nu trebuie sa depaseasca 0,1 mg/dm3 .
Cromul (Cr)
Este un metal destul de raspandit in scoarta pamantului, dar numai sub forma de combinatii chimice.
Cele mai importante minereuri utlizate la extragerea cromului sunt: cromitul - FeO Cr2 O3, crocoitul - PbCrO4, magnocromitul (Fe Mn)Cr3O4, picotit - (CrAl)2 O4.
Minereul de baza folosit la extragerea cromului este cromitul In metalurgia cromului se disting doua etape mai importante: fabricarea oxidului de crom si obtinerea cromului metalic.
In vederea fabricarii oxidului de crom se procedeaza mai intai la topirea cromitului in amestec cu carbonat de potasiu, injectand oxigen.
2FeCr2 O4 + 4K2 CO3 + 3,5 O2 = 4K2 CrO4 + Fe2 O3 + 4CO2
Dupa racire, topitura rezultata se dizolva in apa fierbinte, separandu-se de reziduul insolubil Fe2 O3. Solutia obtinuta se trateaza cu acid sulfuric, din care bicromatul de potasiu precipta sub forma de cristale solide. Prin reducerea acestuia in stare topita cu sulf rezulta oxidul de crom.
K2 Cr2 O7 + S = Cr2 O3 + K2 SO4
Producerea cromului metalic prin reducerea oxidului de crom se poate face prin aluminotermie sau silicotermie.
Fabricarea cromului pe cale aluminotermica consta in amestecarea oxidului de crom cu pulbere de aluminiu metalic intr-un creuzet captusit cu material refractar. In amestec se introduce florura de calciu pentru fluidificare
Cr2 O3 + 2Al = Al2 O3 + 2Cr
Cromul obtinut are o puritate de 97,9 - 99% impuritatile fiind aluminiu si fier.
Fabricarea cromului prin metoda silicotermica se face incalzind oxidul de crom in amestec cu pulbere de siliciu, var si florura de calciu intr-un cuptor electric cu arc.
2Cr2 O3 + 3Si + 3CaO = 4Cr + 3CaSiO3
Producerea cromului de puritate ridicata se face prin electroliza (99,9%).
Utilizarile cromului includ aliaje cu fier, nichel, cupru etc. cu buna rezistenta mecanica si la coroziune. Acesta este folosit la obtinerea caramizilor cromomagnetice, in acoperiri metalice, etc. Sarurile de crom se folosesc in tabacarie si vopsitorie si constituie principala sursa de poluare cu crom a apelor de suprafata, alaturi de extragerea si prelucrarea minereurilor.
Cromul este cunoscut ca oligoelement esential organismului uman, dar spre deosebire de cromul metalic, sarurile de crom sunt toxice pentru om si pentru alte vietuitoare. Ingerarea de compusi de crom produce arsuri in epigastru, varsaturi, diaree, urina cu sange, convulsii si coma, putand duce la moarte. Doza letala a unui cromat solubil este de 5 g., pentru bicromati 6 - 8 g., iar pentru acidul cromic 1 - 2 g. In intoxicatia cronica sunt caracteristice manifestatiile cutanate, iritatii nazale, faringiene, bronsice, conjunctivale, dermatice, alergice, eczematiforme.
In apa potabila Cr6+ nu trebuie sa depasesca concentratia de 0,05mg./dm³, iar Cr3+ nu trebuie sa depasesca concentratia de 0,5mg./dm³.
Cadmiul (Cd)
Cadmiul face parte din categoria metalelor putin raspandite in natura - numai sub forma combinatiilor chimice. El este prezent, de regula, in minereurile de zinc, insotind in mod frecvent blenda si smithsonitul. Continutul de cadmiu in minereurile de zinc variaza in limite largi de la 0,02 la 2,5%. Principalele minerale de cadmiu sunt: greenochitul - CdS, avand un contiunt de 77% cadmiu, otawitul - CdCO3 si monteponitul - CdO.
Mineralele de cadmiu din natura sunt prea sarace pentru a putea fi exploatate. Extractia metalurgica a cadmiului este legata de instalatiile pentru fabricarea zincului, a cuprului si a plumbului. Se obtine prin prajirea sulfurii in prezenta aerului si reducerea CdO rezultat, cu carbune. Se separa din zinc prin distilare fractionata in coloane de distilare unde se condenseaza mai intai plumbul, apoi zincul si in sfarsit cadmiul.
Cadmiul metalic se foloseste la prepararea aliajelor, la sudarea argintului si a aliajelor lui, in acumulatoare alcaline, la fabricarea cuzinetilor pentru industria automobilelor si la acoperirea prin cadmuire a altor metale. Aliajele cupru-cadmiu (0,9 - 1,2% Cd) se folosesc la constructia conductoarelor pentru tramvaie si troleibuze. Aliajul argint-cadmiu se foloseste in industria bijuteriilor. Sulfura de cadmiu este utilizata ca vopsea galbena in lacul de celuloza, in cauciuc si sticla. Sulfura de cadmiu si seleniu (rosu de cadmiu) este utilizata in ceramica si emailuri. Cadmiul se introduce in tuburile luminoase pentru a indeparta azotul. Oxidul de cadmiu este o substanta luminescenta in tuburi. Cadmiul metalic se foloseste in tehnica militara. Oxidul de cadmiu se utilizeaza ca semiconductori. O solutie de azotat de cadmiu se foloseste la stropirea lemnelor impotriva termitelor. Clorura de cadmiu si sulfura de cadmiu se utilizeaza in baile de nichelare pentru a mari stralucirea depunerilor. Sulfura de cadmiu se foloseste la prepararea unor articole cosmetice, la tratarea tuberculozei plamanilor. Aliajul Ag - In - Cd este utilizat la confectionarea barelor de control din tehnica nucleara.
Sursele de poluare cu cadmiu sunt deci:
industria miniera;
industri metalurgica;
industria chimica;
industria termoenergetica.
Intoxicatiile cu cadmiu produc uscaciune in gat, dureri de cap, arsuri ale pielii, arsuri in stomac, greata, vomari puternice, ameteala, lipsa de sensibilitate a mainilor si picioarelor, convulsii. Formarea inelului de cadmiu la baza dintilor, de culoare galbena este primul simptom al intoxicarilor cronice. Un efect al intoxicarii o constituie aparitia cancerului de prostata al disfunctiilor renale, hipertensiuni arteriale si arterosclerozei.
Se apreciaza ca doza letala este de aproximativ 1 gram. Moarte se produce prin colaps cardiovascular si paralizie respiratorie. In apa potabila, cadmiul nu trebuie sa depasesca concentratia de 0,01 mg/dm³.
Cobaltul (Co)
Cobaltul se afla putin raspandit in scoarta pamantului. El se prezinta sub forma de minerale dintre care cele mai importante sunt: cobaltina - (CoFe)AsS si smaltina As2 Co. Intotdeauna mineralele de cobalt se gasesc alaturi de mineralele de nichel si uneori alaturi de cele de cupru.
Tehnologia de extragere a cobaltului implica procedeele pirometalurgice sau procedeele hidrometalurgice, urmarindu-se obtinerea oxidului de cobalt: CoO sau Co3 O4. In final acesta se supune reducerii la 1200sC cu carbon in cuptor electric rezultand cobalt metalic. Prin rafinare electrolitica se poate ajunge la un cobalt de puritate 99,80%.
Metalurgia este cel mai important domeniu de aplicatie industriala a cobaltului si in primul rand la elaborarea otelurilor aliate. Acestea sunt utilizate in mod obisnuit la elaborarea otelurilor de scule, refractare si pentru electrotehnica, la confectionarea magnetilor, in constructia turbinelor cu gaz, a motoarelor cu reactie si a rachetelor.
Izotopul Co60 serveste ca sursa de radiatii in defectoscopie sau pentru tratarea unor tumori canceroase.
Sticla de cobalt, de culoare albastra, utilizata ca sticla de protectie impotriva radiatiilor luminoase de mare intensitate, se obtine prin dizolvarea oxidului de cobalt in sticla topita.
Surse de poluare cu cobalt:
industria metalurgica;
industria chimica;
industria temoenergetica.
Compusii chimici ai cobaltului (cloruri, sulfati etc.) influenteaza dezvoltarea organismelor animale si vegetale. Prezenta cobaltului in terenurile arabile favorizeaza acumularea clorofilei in frunze si a vitaminei B12 in bulbi si seminte. De aceea ingrasamintele minerale contin cantitati mici de saruri de cobalt.
Concentratia maxima admisa a cobaltului in apa este de 1 mg./dm³.
Zincul (Zn)
Zincul este un metal putin raspandit in natura si numai sub forma de combinatii. Mineralele zincului sunt sulfuroase si oxidice. De obicei, pe langa zinc, mai contin plumb, fier, cupru etc. Cele mai uzuale minerale sunt: blenda sau sfaleritul - ZnS (67,1%Zn), smithsonitul - ZnCO3, calamina - 2ZnO.SiO2.H2 O (67,5%ZnO), zincit - ZnO (80,3% Zn).
In minereurile sale zincul se gaseste in proportii relativ mici (6 - 9%) si de aceea se concentreaza prin flotatie.
Zincul se extrage din concentrat prin procedee pirometalurgice si hidrometalurgice. In ambele variante concentratul trebuie prajit la o temperatura de cca. 800sC in vederea eliminarii unei cantitati importante de sulf si a transformarii sulfurii de zinc in oxid de zinc:
ZnS + 3/2.O2 = ZnO + SO2
Cand prajirea se realizeaza la temperaturi mai scazute se formeaza sulfatul de zinc, nedorit in cazul procedeelor pirometalurgice:
ZnS + 2O2 = ZnSO4
Pe cale pirometalurgica, dupa prajire sunt necesare urmatoarele operatiuni: aglomerare, reducere si distilare, rafinare.
Reactia de reducere se realizeaza la peste 1000sC astfel:
ZnO + C = CO + Zn
Zincul se volatilizeaza si este captat din gazele evacuate prin condensare. Impuritatile din zinc sunt: plumb, fier, cadmiu, cupru, stibiu, arseniu. In vederea eliminarii acestora se aplica rafinarea termica, zincul separandu-se de restul elementelor datorita temperaturii de volatilizare (906sC) diferita de a celorlalte elemente, obtinandu-se o puritate de 99,99% zinc.
In varianta extragerii zincului pe cale hidrometalurgica, procesul de prajire trebuie sa se desfasoare la o temperatura mai mica de 800sC, urmarindu-se obtinerea sulfatului de zinc in proportie cat mai mare. Dupa prajire se face solubilizarea materialului cu o solutie de acid sulfuric diluat:
ZnO + H2 SO4 = ZnSO4 + H2
In solutie se dizolva si alte impuritati care trebuie indepartate. De aceea solutia de sulfat de zinc se dilueaza si se trateaza cu oxid de zinc, o parte din impuritati precipitand dupa reactiile:
Fe2 (SO4)3 + 3H2 O + 3ZnO = 2Fe(OH)3 + 3ZnSO4
Al2 (SO4)3 + 3H2 O + 3ZnO = 2Al(OH)3 + 3ZnSO4
Co(SO4)3 + 3H2 O + 3ZnO = 2Co(OH)3 + 3ZnSO4
Dupa filtrare, solutia de sulfat de zinc mai contine sulfat de cupru si cadmiu care precipita prin adaos de pulbere de zinc:
CuSO4 + Zn = ZnSO4 + Cu
CdSO4 + Zn = ZnSO4+Cd
In final solutia se supune electrolizei cu anod de plumb si catod de aluminiu. Zincul se depune la catod, iar la anod se dagaja oxigen. Zincul obtinut are o puritate de 99,97 - 99,99%.
Zincul se utilizeaza la acoperirea tablei, tevilor, sarmei, procedeu numit zincare. O importanta cantitate de zinc este folosita in metalurgie la extragerea plumbului, aurului, argintului, precum si la elaborarea unor aliaje, dintre care, indeosebi alama. Din aliaje ale zincului se obtin piese turnate sub presiune: capace de ceasornice, aparate de ras, piese pentru masini de scris etc.
Cantitati importante de zinc sunt folosite la fabricarea oxidului de zinc, cel mai uzual pigment anorganic alb. In afara de industria colorantilor oxidul de zinc este utilizat in industria cauciucului, ceramicii, in medicina etc.
Sarurile de zinc introduse in organism pe cale interna sunt toxice iar asupra pielii au o actiune astringenta si iritanta; aerosolii de zinc pot provoca asa numita febra de zinc.
Concentratia maxima admisa in apa potabila este de 5 mg/dm³.
Arsen (As)
Se gaseste in natura sub forma de arseniuri, sulfoarseniuri si sulfuri de arsen. Se prepara prin incalzirea FeAsS in absenta aerului sau prin reducerea As2 O3 cu carbune. Intreaga cantitate de arsen obtinuta in industrie rezulta ca produs secundar in metalurgia plumbului, cuprului si aurului. Cantitatea de arsen degajat in procesele metalurgice in care acesta nu este recuperat este mare.
Fabricarea arsenului consta in prajirea concentratului cu putina pirita sau galena care degajeaza dioxid de sulf. Acesta antreneaza praful. Arsenul se volatilizeaza ca As2 O3 concentrandu-se in gaze pana la peste 30 %. Gazele sunt amestecate cu oxizi de plumb, cupru, stibiu, staniu si zinc. Gazele trec prin camere din caramizi racite treptat (cu temperaturi intre 220sC si 100sC).
Anhidrida arsenoasa se condenseaza rezultand un produs brut cu 90 - 95 % As2 O3. Resublimarea anhidridei arsenoase la 295sC si recondensarea sa in camere la 180 - 120sC produce un compus de puritate 99 - 99,9 %. Anhidrida arsenoasa se reduce apoi la arsen.
Se utilizeaza la confectionarea aliajelor, a alicelor de plumb, marindu-le duritatea.
Arsenul se oxideaza in prezenta oxigenului la anhidrida arsenoasa, care se foloseste la fabricarea sticlei, verdelui de Paris, ca smalt in ceramica si ca mordant in tabacarie. Compusii arsenului se folosesc ca pigment in pictura, la focurile de artificii, tanarea si depilarea pieilor, industria stclei, pentru fabricarea semiconductorilor electrici, a pigmentilor, in industria hartiei etc.
Efectul arsenului asupra oamenilor, animalelor si plantelor depinde de concentratie si de compusul chimic in care se gaseste. In organisme patrunde prin procesul respiratiei sau prin ingestia alimentelor poluate, repartizandu-se in concentratii diferite in organe. In cantitati mici exercita o actiune tonica asupra organismului, dar in cantitati mari este nociv. Poluarea cu arsen se datoreaza poluarii industriale a aditivilor alimentari din hrana animalelor prin pesticide, aer, apa, sol.
Intoxicatia acuta cu arsen si compusi ai arsenului are urmatoarele simtome: iritarea sistemului gastro-intestinal, greata, voma, diaree care continua cu soc si moarte. Concentratia maxima admisa in apa potabila este de 0,05 mg/dm³.
Poluarea cu metale grele apare in special in industria miniera, industria metalurgica, chimica si termoenergetica. Circuitul antropogen industrial si agricol al metalelor grele este prezentat in figura de mai jos.
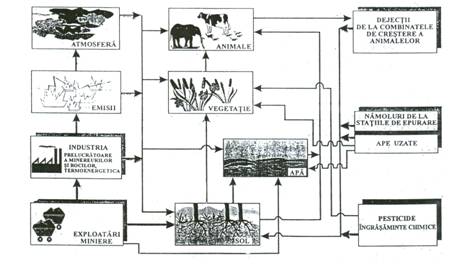
Fig. 4.1. Circuitul antropogen industrial si agricol al metalelor grele.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |