Aspecte termodinamice generale
Sub actiunea caldurii din agregatele siderurgice (furnale, cuptoare de feroaliaje, cuptoare pentru elaborare otel etc.) unele materiale sufera procese de descompunere (disociere) termica. Carbonatii se descompun in oxizi si dioxid de carbon, oxizii superiori se descompun in oxizi inferiori si oxigen, iar sulfurile se descompun eliberand sulf care la temperatura din agregatele siderurgice se afla in stare gazoasa.
Carbonatii sunt folositi in siderurgie in cea mai mare parte ca fondanti (calcarul, dolomita), ca materii prime pentru fabricarea materialelor refractare (magnezita), sau ca minereuri (siderita - sursa de fier, rodocrozita - sursa de mangan).
Oxizii reprezinta substanta de baza a tuturor minereurilor de fier precum si a altor minereuri folosite in siderurgie ca materii prime pentru elaborarea fontelor, feroaliajelor, otelurilor. Cele mai des utilizate minereuri sunt hematita, magnetita, piroluzita, cuartita, cromita etc.
Sulfurile se gasesc in materiile prime siderurgice mai ales ca impuritati (pirita, calcopirita), spre deosebire de domeniul metalurgiei neferoase, unde ele reprezinta substanta de baza a majoritatii minereurilor neferoase.
Descompunerea (disocierea) termica a carbonatilor, oxizilor si sulfurilor prezinta trasaturi comune din punct de vedere termodinamic si chiar cinetic, de aceea analiza ei va fi prezentata mai intai sub forma generala.
Fie AB - substanta initiala solida (carbonat, oxid,sulfura) supusa descompunerii termice, A - substanta solida, iar B - substanta gazoasa care rezulta din descompunerea termica. Atunci procesul de disociere termica poate fi redat astfel:
ABs![]() As + Bg ΔH > 0.
As + Bg ΔH > 0.
Uneori substantele AB si A pot fi in stare lichida, dar aceasta nu modifica radical caracteristica termodinamica a procesului de disociere.
Procesele de disociere sunt intotdeauna endoterme (ΔH > 0) pentru ca ele presupun ruperea legaturii chimice intre substantele A si B. Cu cat aceasta legatura este mai puternica, cu atat ΔH este mai mare.
Varianta sistemului
Varianta sistemului in cazul de fata depinde de numarul de faze din care este compus sistemul. Pot fi distinse urmatoarele cazuri:
a) Substantele ABs si As sunt in stare pura (faze separate) sau in solutie saturata. In acest caz, numarul componentilor independenti Ci = 2, iar numarul de faze in sistem f = 3, adica o faza gazoasa si doua faze solide. Deci varianta sistemului in acest caz este:
l = Ci + 2 - f =2 + 2 - 3 = 1.
Aceasta inseamna ca din cei trei factori care conditioneaza starea sistemului (T, Pt, PB) pentru determinarea compozitiei fazei gazoase este suficient sa se cunoasca doar unul singur (de exemplu temperatura), intrucat in acest caz presiunea partiala de echilibru a gazului B este functie univoca a temperaturii:
PB = f (T).
Aici PB poate fi denumita si tensiune de disociere a substantei ABs.
Pentru a intelege mai bine acest lucru se scrie si constanta de echilibru a reactiei de disociere termica:
Kp
= ![]() = f (T)
= f (T)
Intrucat substantele ABs si As sunt presupuse in stare pura, aAB = 1, respectiv aA = 1 (activitatile substantelor pure sau aflate in solutie saturata sunt egale cu unu) si prin urmare:
Kp = PB = f (T)
Adica PB = f (T) este functie univoca de temperatura asa cum s-a stabilit cu ajutorul legii fazelor.
b) Substantele ABs si As formeaza impreuna solutii solide nesaturate. In acest caz, numarul de componenti independenti este egal tot cu doi, dar numarul de faze scade la doi, substantele ABs si As nemaifiind faze separate.
Deci conform legii fazelor:
l
si sistemul devine din monovariant in bivariant, ceea ce inseamna ca PB, depinde nu numai de temperatura, ci si de compozitia solutiei solide, redata prin activitatea termodinamica a celor doi componenti ( aAB si aB ), sau daca solutia este ideala, prin fractia molara a componentilor ( XAB si XA ).
Intr-adevar, scriind din nou constanta de echilibru a procesului de disociere termica:
Kp
= ![]() = f (T)
= f (T)
in care, in acest caz, aAB ≠ aA ≠ 1 rezulta:
PB
= ![]()
adica PB = f (T, aAB, a A ).
In cazul solutiilor ideale, activitatile sunt egale cu fractiile molare:
PB
= Kp ![]() ,
,
adica: PB = f ( T, XAB, XA ).
Cand solubilitatea reciproca a substantelor AB si A este limitata, in locul activitatilor termodinamice, care in general sunt greu de determinat, se utilizeaza marimea numita grad de saturatie exprimat prin:
Si = ![]()
in care (% i) este concentratia procentuala a componentului I in solutia nesaturata, iar (%imax) este concentratia componentului la saturatie.
In aceste conditii, relatia constantei de echilibru devine:
Kp = ![]() PB = f ( T
)
PB = f ( T
)
Gradul de saturatie variaza intre 0 si 1.
c) Substanta AB sau substanta A formeaza solutie solida nesaturata cu o a treia substanta, C. In acest caz, numarul de componenti independenti creste la trei, iar numarul fazelor este egal tot cu trei (faza gazoasa B, o faza solida pura si solutia solida nesaturata). Deci:
l
ceea ce inseamna ca:
PB = f ( T, aAB (aC)).
sau cand solutia nesaturata formata este ideala: PB = f (T, XAB (XC)).
d) Atat substanta AB cat si substanta A formeaza o solutie nesaturata cu o a treia substanta, C. In acest caz, numarul de componenti independenti este tot 3, dar numarul fazelor scade la 2 (faza gazoasa B plus o solutie nesaturata formata din AB, A si C). Conform legii fazelor:
l
ceea ce inseamna ca:
PB = f (T, aAB, aA).
Influenta temperaturii
Procesele de disociere termica sunt procese endoterme, deci ΔH > 0 si conform izobarei lui Van´t Hoff:
![]() =
= ![]()
si deoarece
ΔH > 0, ![]() >0, deci curba de variatie Kp = f (T) are panta pozitiva, ceea ce
>0, deci curba de variatie Kp = f (T) are panta pozitiva, ceea ce
![]() inseamna ca, constanta
de echilibru a oricarei reactii de disociere termica creste
cu cresterea temperaturii.
Dar avand in vedere ca PB
= f (T) se poate conchide ca si tensiunea de disociere creste cu temperatura..
inseamna ca, constanta
de echilibru a oricarei reactii de disociere termica creste
cu cresterea temperaturii.
Dar avand in vedere ca PB
= f (T) se poate conchide ca si tensiunea de disociere creste cu temperatura..
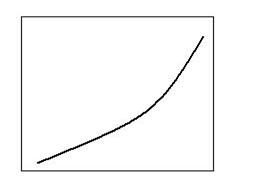
PB
![]() >0
>0
ΔH > 0
T
Fig. 2.1. Schema variatiei tensiunii de disociere cu temperatura.
In literatura de specialitate variatia tensiunii de disociere cu temperatura este redata prin relatii de tipul:
lg
PB = ![]() + B
+ B
in care: A = ![]() , iar B =
, iar B = ![]() .
.
Pe
de alta parte variatia entalpiei libere standard ΔG![]() este redata prin relatii de tipul:
este redata prin relatii de tipul:
ΔG![]() = a - bT
= a - bT
in care a = ΔH![]()
![]() , iar b = ΔS
, iar b = ΔS![]() .
.
Reactiile
de disociere termica sunt insotite de cresterea entropiei (apare
o faza gazoasa caracterizata prin grad mare de dezordine),
deci ![]() > 0 ( b >0 ).
Aceasta inseamna ca la cresterea temperaturii, ΔG
> 0 ( b >0 ).
Aceasta inseamna ca la cresterea temperaturii, ΔG![]() scade (ΔH
scade (ΔH![]() = a > 0), ca urmare a scaderii afinitatii
chimice a substantelor chimice ABs si As.
scaderea lui ΔG
= a > 0), ca urmare a scaderii afinitatii
chimice a substantelor chimice ABs si As.
scaderea lui ΔG![]() semnifica imbunatatirea conditiilor
termodinamice sub influenta pozitiva a cresterii temperaturii.
semnifica imbunatatirea conditiilor
termodinamice sub influenta pozitiva a cresterii temperaturii.
Criterii de apreciere a stabilitatii carbonatilor, oxizilor si sulfurilor.
Carbonatii, oxizii si sulfurilor au stabilitate variata la disocierea termica. Ea poate fi determinata experimental sau apreciata prin calcul termodinamic.
Criteriile de apreciere sunt urmatoarele:
Entalpia libera de
formare, ΔG![]() a compusului definit AB dupa reactia As+Bg=ABs.
Cu cat este mai mica algebric (mai negativa) cu atat compusul AB este
mai stabil.
a compusului definit AB dupa reactia As+Bg=ABs.
Cu cat este mai mica algebric (mai negativa) cu atat compusul AB este
mai stabil.
Tensiunea de disociere PB cu cat este mai mica, cu atat stabilitatea compusului este mai mare.
Entalpia de formare a
substantei AB, ΔH![]() Pentru toti carbonatii,
oxizii si sulfurile entalpia de formare este negativa (ΔH
Pentru toti carbonatii,
oxizii si sulfurile entalpia de formare este negativa (ΔH![]() < 0). Cu cat este mai negativa (mai mare in valoare
absoluta) cu atat stabilitatea compusului AB este mai mare. Acest criteriu
este mai putin concludent in raport cu primele doua, deoarece nu
tine seama de ΔS
< 0). Cu cat este mai negativa (mai mare in valoare
absoluta) cu atat stabilitatea compusului AB este mai mare. Acest criteriu
este mai putin concludent in raport cu primele doua, deoarece nu
tine seama de ΔS![]() , care uneori poate avea o semnificatie importanta.
, care uneori poate avea o semnificatie importanta.
In
tabelul de mai jos este prezentata o comparatie intre carbonatii
de calciu, magneziu si fier pe baza criteriilor de stabilitate.
Comparatia se face la o temperatura de 1000 K, deoarece ΔG![]() si P
si P![]() variaza intens cu temperatura. ΔH
variaza intens cu temperatura. ΔH![]() se poate lua din tabel pentru 298 K, deoarece ΔH0 nu variaza mult cu
temperatura.
se poate lua din tabel pentru 298 K, deoarece ΔH0 nu variaza mult cu
temperatura.
Stabilitatea comparativa a carbonatilor
|
Carbonatul |
ΔG |
P |
ΔH |
Stabilitatea |
|
CaCO3 |
|
|
Mare |
|
|
MgCO3 |
|
|
Mediu |
|
|
FeCO3 |
|
|
Mica |
Sensul fizic al tensiunii de disociere
S-a aratat ca tensiunea de disociere este presiunea practica de echilibru a gazului B deasupra substantelor AB si A, corespunzatore reactiei:
ABs = As +Bg
Ea se exprima in unitati de presiune (N/m2, atm) dar are sensul de presiune numai cand are valori suficient de mari. (Sensul fizic de presiune este efectul statistic al ciocnirii moleculelor de peretele recipientului).
Exemplu: Disocierea termica a CaCO3:
CaCO3 = CaO + CO2
La
1000 K dupa cum rezulta din tabelul de mai sus, P![]() = 0,12 atm. La volumul de 1l, acestei presiuni partiale
(tensiuni de disociere) ii corespunde un numar de molecule de CO2
de:
= 0,12 atm. La volumul de 1l, acestei presiuni partiale
(tensiuni de disociere) ii corespunde un numar de molecule de CO2
de:
![]()
unde:
N0 este numarul lui Avogadro (![]() molecule/g mol).
molecule/g mol).
La
298 K (25 °C), ![]() =
=![]() atm, iar numarul de molecule este de :
atm, iar numarul de molecule este de :
![]()
din aceste calcule rezulta ca la 1000 K, tensiunea de disociere are sens fizic de presiune, pe cand la 25 °C nu i se poate atribui acest sens (exista doar 0,17 molecule) ci numai sens probabilistic (0,17% din timp molecula de CO2 este libera, iar 83% din timp este legata in structura carbonatului de calciu).
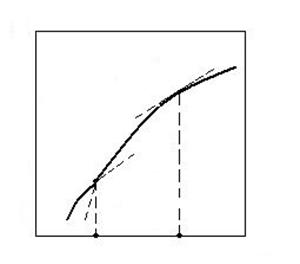
Temperatura
teoretica de disociere este temperatura la care
tensiunea de disociere PB
devine egala cu presiunea partiala a gazului B in faza
gazoasa, ambianta PB.
Pentru disocierea carbonatilor in aer temperatura de disociere este cand ![]() egaleaza
presiunea partiala
egaleaza
presiunea partiala ![]() a bioxidului de carbon
in faza gazoasa (in atmosfera
a bioxidului de carbon
in faza gazoasa (in atmosfera ![]() ). Temperatura teoretica de disociere termica se
determina prin calcul sau grafic.
). Temperatura teoretica de disociere termica se
determina prin calcul sau grafic.
Prin calcul se procedeaza astfel: se stie ca
![]()
si punandu-se
conditia PB = pB rezulta: ![]() .
.
Grafic, temperatura teoretica de disociere se determina cu ajutorul curbei care reda
PB = f(T).
Temperatura
practica de disociere termica este
temperatura la care tensiunea de disociere PB
egaleaza presiunea exterioara totala. Ea se determina ca
si cea teoretica, dar punand conditia de disociere sa
egaleze presiunea exterioara totala, deci PB = ![]()
In conditiile normale pt,ext =1 atm se determina astfel:
![]() ; daca
; daca ![]() , atunci lg PB = 0, deci:
, atunci lg PB = 0, deci: ![]()
![]()
Grafic se
duce orizontala la PB = 1
atm si se citeste pe abscisa ![]() . Este evident ca totdeauna
. Este evident ca totdeauna ![]() , deoarece
, deoarece ![]() .
.
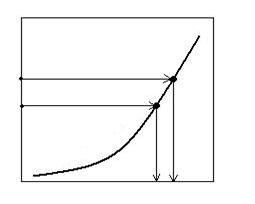
PB
atm
1,0
pB
T![]() T
T![]()
Fig. 2.2. Schema pentru determinarea temperaturii teoretice
si practice de disociere termica a carbonatilor,oxizilor si sulfurilor.
Influenta presiunii asupra disocierii termice
Reactiile de disociere termica au loc cu crestere de volum, deoarece apare in sistem un gaz (gazul B). Conform principiului lui Lechatelier, asemenea reactii sunt favorizate de scaderea presiunii in sistem.
Influenta compozitiei initiale a fazei gazoase
Ca si alte procese si cele de disociere termica se formeaza in general in afara echilibrului, dar tind catre stabilirea acestuia. Disocierea termica continua atat timp cat ΔG<0. La echilibru ΔG = 0.
Pentru a se putea prezice daca un proces de disociere termica poate sau nu sa se desfasoare in conditii date de temperatura, trebuie sa se cunoasca conditiile de echilibru (tensiunea de disociere) si conditiile initiale existente in sistem (presiunea partiala a gazului B in faza gazoasa). Calculul termodinamic se efectueaza pe baza ecuatiei izotermei reactiei a lui Van't Hoff:
![]()
Pentru simplificare va fi tratat cazul cand sistemul este monovariant
(l = 1) si KP = PB.
![]()
unde: - pB(i) = presiunea partiala initiala (exterioara) a gazului B;
- PB(e) = presiunea partiala de echilibru a gazului B (tensiunea de disociere) la temperatura data.
Pentru ca procesul de disociere sa poata incepe, este necesar ca ΔG < 0, iar pentru aceasta trebuie indeplinita conditia: pB(i) < PB(e), adica presiunea partiala exterioara a gazului B trebuie sa fie mai mica decat tensiunea de disociere la temperatura considerata.
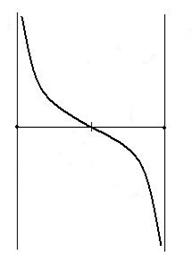
In figura 2.3 este ilustrata analiza de mai sus. Curba imparte campul graficului in doua domenii (I si II). Se observa ca numai in domeniul II exista conditii favorabile desfasurarii reactiei de disociere termica (ΔG < 0). In domeniul I exista conditii favorabile numai pentru reactiile de formare a carbonatilor, oxizilor si sulfurilor, (As + Bg = ABs)
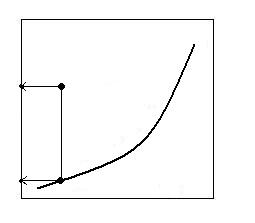 PB
PB
I
pB > PB
pB a
A+B=AB II
pB < PB
pB b AB=A+B
Fig. 2.3.
Influenta compozisiei initiale a fazei gazoase asupra
desfasurarii proceselor de disociere termice.
Concluzia practica este aceea ca pentru a intretine reactiile de disociere termica este necesar sa se evacueze permanent din sistem produsul gazos B, pentru ca inegalitatea pB < PB sa se mentina tot timpul si ca ΔG < 0. Acumularea gazului B in sistem conduce la incetinirea procesului si la limita chiar la oprirea lui.
Influenta transformarilor de faza
Cercetarile efectuate au scos in evidenta faptul ca legea de variatie a tensiunii de disociere cu temperatura este influentata de transformarile de faza ale substantelor AB si A. Sunt avute in vedere:
a) modificarea starii de agregare a substantelor AB si B;
b) transformarile polimorfe (exemplu Fe2O3 γ → Fe2O3 α).
Pentru a reda influenta topirii substantelor AB si A asupra variatiei tensiunii de disociere cu temperatura se poate apela la ecuatia izobarei lui Van't Hoff, tinand seama ca Kp = PB,
![]() ;
;
unde ΔH este variatia de entalpie de reactie a reactiei ABs = As + Bg, calculata cu relatia:
ΔH = (HA + HB) - HAB.
Cand
se produce topirea substantei AB, HAB
creste si ΔH scade,
ceea ce conduce la micsorarea ![]() ; adica a pantei curbei de variatie a tensiunii de
disociere cu temperatura. Dimpotriva cand are loc topirea substantei
A ca urmare a cresterii HA
are loc cresterea lui ΔH
si odata cu aceasta creste panta curbei
; adica a pantei curbei de variatie a tensiunii de
disociere cu temperatura. Dimpotriva cand are loc topirea substantei
A ca urmare a cresterii HA
are loc cresterea lui ΔH
si odata cu aceasta creste panta curbei ![]() asa cum se vede
in figura de mai jos.
asa cum se vede
in figura de mai jos.
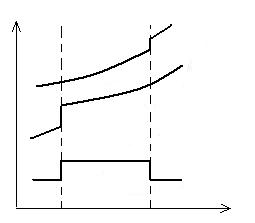
HA HAB
HAB
HB HA
ΔH
Ttop A Ttop AB T
Fig.2.4. Variatia entalpiei reactiei in functie de topire a substantelor A si AB.
lg PB
Ttop A Ttop AB T
Fig. 2.5. Influenta topirii substantelor a si AB asupra ritmului
de crestere a tensiunii de disociere cu temperatura
Influenta gradului de dispersie a fazei solide asupra tensiunii de disociere
Gradul de dispersie a materialelor solide granulate este important deoarece granulatia influenteaza comportarea materialelor prin actiunea energiei superficiale a carei valoare creste cu micsorarea granulatiei. Un caz tipic il reprezinta pulberile usor oxidabile (Al, Mg, CaSi, FeSi) care datorita gradului mare de dispersie reactia de oxidare in aer are viteza mare, existand pericolul de autoaprindere si de explozie.
In cazul carbonatilor, oxizilor si sulfurilor, energia superficiala a granulelor se reflecta asupra tensiunii de disociere.
Se considera reactia in sistemul monovariant ABs = As + Bg pentru care:
![]() .
.
Variatia entalpiei libere standard ΔG0 se calculeaza:
ΔG0 = (G![]() + G
+ G![]() ) - G
) - G![]()
La
substantele solide G0
are doua componente, una de volum si una de suprafata
notate cu G![]() si G
si G![]() . In aceste conditii relatia se va scrie astfel:
. In aceste conditii relatia se va scrie astfel:
ΔG0 = (G![]() + G
+ G![]() ) + G
) + G![]() - (G
- (G![]() + G
+ G![]() )
)
Rezulta, deci ca:
![]() .
.
Cand
gradul de dispersie al substantei AB (carbonat, oxid, sulfura)
creste (granulatia se micsoreaza), componenta de
suprafata a entalpiei libere (G![]() ) creste si deci creste si tensiunea de
disociere. Deci la aceeasi temperatura in cazul unui carbonat, oxid
sau sulfura cu granulatia mica se obtine o tensiune de
disociere mai mare (un grad de disociere mai mare) decat in cazul
aceluiasi material cu granulatie mai mare.
) creste si deci creste si tensiunea de
disociere. Deci la aceeasi temperatura in cazul unui carbonat, oxid
sau sulfura cu granulatia mica se obtine o tensiune de
disociere mai mare (un grad de disociere mai mare) decat in cazul
aceluiasi material cu granulatie mai mare.
Cand gradul de dispersie a substantei A creste, tensiunea de disociere scade.
Influenta formarii solutiilor asupra tensiunii de disociere
Cand substantele AB si A formeaza solutii solide (sau lichide) nesaturate, sistemul este bivariant (l = 2). Tensiunea de disociere depinde in acest caz de temperatura si de compozitia solutiei solide (sau lichide) redata prin activitatile componentilor, fractiile lor molare sau gradele de saturatie:
![]() ;
; ![]() .
.
Cand solutiile formate sunt ideale:
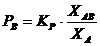 ;
; ![]() .
.
Se examineaza doua cazuri:
Cazul cand substantele AB
si A prezinta solubilitate reciproca nelimitata.
Admitand ca solutia este ideala se examineaza
situatiile extreme: cand XAB = 1 si XA = 0
(substanta AB pura), ![]() , lg PB =
, lg PB =
![]() ; cand XA = 1 si XAB = 0
(substanta A pura), PB
= 0 si lg PB = -
; cand XA = 1 si XAB = 0
(substanta A pura), PB
= 0 si lg PB = -![]() .
.
Rezulta
ca in limitele dintre XAB = 1 si XA = 1,
tensiunea de disociere variaza continuu intre +![]() si zero, iar lg PB intre +
si zero, iar lg PB intre +![]() si -
si -![]() .
.
ln PB ln PB I II III
+![]() l = 2 +
l = 2 +![]() l=2 l
=1 l=2
l=2 l
=1 l=2
0 AB A
XAB=1 XA=1 XA max XAB max
XA=0 XAB=0 XA
-![]() -
-![]()
Fig. 2.7. Variatia
tensiunii de disociere termica a carbonatilor, oxizilor si
sulfurilor in cazul solubilitatii reciproce nelimitate a
substantelor AB si A. Fig. 2.8. Variatia
tensiunii de disociere termica a carbonatilor, oxizilor si
sulfurilor in cazul solubilitatii reciproce limitate a
substantelor AB si A.
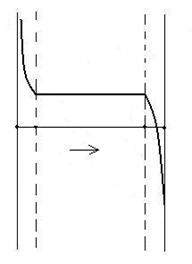
Cazul cand substantele AB si A prezinta solubilitate reciproca limitata (se satureaza la anumite concentratii). In acest caz domeniul prezinta trei intervale:
I XAB = 1 si XA max,
sistemul este bivariant (l = 2), iar tensiunea de disociere scade
de la +![]() la valoarea egala cu Kp. Daca solutia este saturata aAB si aA = 1 si
la valoarea egala cu Kp. Daca solutia este saturata aAB si aA = 1 si ![]() .
.
II Cuprins intre XA max si XAB max, sistemul este monovariant, iar tensiunea de disociere se mentine egala cu Kp.
III Cuprins intre XAB max si XA = 1 sistemul este bivariant (l = 2), iar tensiunea de disociere scade de la PB = Kp pana la zero cand XA = 1.
Din punct de vedere practic se pot trage urmatoarele concluzii:
- tensiunea de disociere are valorile mai mari in intervalul I (PB = Kp) in care exista solutii nesaturate de substanta A in AB. Deci dizolvarea substantei a in substanta AB cu formarea de solutii nesaturate favorizeaza disocierea termica a substantei AB si cu cat solutia este mai diluata, cu atat influenta favorabila este mai accentuata (PB este mai mare).
- dizolvarea substantei AB in A conduce la micsorarea tensiunii de disociere termica (PB< Kp
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |