
Reducerea cu carbon (reducere directa)
Carbonul reprezinta un reducator foarte important atat pentru faptul ca este un reducator cu putere mare de reducere, (fiind capabil sa reduca orice oxid in cazul in care se asigura conditii corespunzatoare de temperatura si presiune) cat si pentru faptul ca se gaseste in mari cantitati in natura.
Din punct de vedere principial reducerea cu carbon poate avea loc in conformitate cu doua tipuri de reactii:
I) MeO + C = Me + CO
II) 2MeO + C = 2Me + CO2.
Pentru procesele siderurgice prezinta importanta doar primul tip de reactie, explicatia constand in faptul ca la temperaturi inalte CO2 interactioneaza cu carbonul dupa reactia Bell-Boudouard:
CO2 + C = 2CO
Aceasta se adauga reactiei de reducere a oxidului metalic:
2MeO + C = 2Me + CO2
CO2 + C = 2CO
|
2MeO + C = 2Me + CO2. |
Ajungandu-se in final la primul tip de reactie.
Analiza termodinamica a reactiilor de reducere cu carbon se poate realiza avand la baza urmatoarele doua scheme:
Schema A
1)
2Me + O2 = 2MeO / -![]() ΔH0 > 0
ΔH0 > 0
2)
2C + O2 = 2CO / ![]() ΔH0
< 0
ΔH0
< 0
|
MeO + C = 2CO + 2Me ΔH |
Schema B
1) 2MeO + CO = Me + CO2 ΔH0 < 0
2) CO2 + C = 2CO ΔH0> 0
|
MeO + C = CO + Me ΔH |
Schema A permite utilizarea datelor termodinamice referitoare la formarea oxizilor MeO si CO precum si diagrama potentialelor de oxigen. Din diagrama potentialelor de oxigen se poate observa ca in timp ce toate dreptele de formare a oxizilor au pante pozitive (deoarece reactiile respective au loc cu micsorare de entropie, ΔS0 < 0), panta dreptei de formare a CO este negativa (deoarece reactia are loc cu crestere de entropie, ΔS0 > 0). Punctele de intersectie arata temperatura Te la care incepe reducerea cu carbon a diferitilor oxizi.
Se observa ca cu cat oxidul metalic este mai stabil (are dreapta de formare mai jos) cu atat temperatura de incepere a reducerii este mai mare.
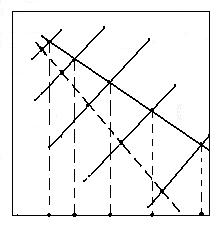
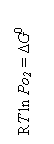 Me1O Me2O
Me1O Me2O
Fig. 3.6. Utilizarea diagramei potentialelor de oxigen pentru analiza
termodinamica a reducerii oxizilor cu carbon (schema A)
Me3O Me4O
p=1at
Me5O
p<1at
T1 T2 T3 T4 T5
Schema B permite utilizarea datelor termodinamice si a diagramelor privind reducerea cu CO si reactia Bell-Boudouard.
Principala
concluzie care se desprinde din prezentarea anterioara consta in
faptul ca reactiile de reducere cu carbon sunt in general endoterme,
deoarece reactiile MeO + CO = Me + CO2 sunt fie endoterme fie
exoterme, dar avand in vedere ca ΔH![]() este relativ mic in valoare absoluta, iar reactia
Bell-Boudouard este puternic endoterma suma celor doua reactii
este pozitiva (ΔH
este relativ mic in valoare absoluta, iar reactia
Bell-Boudouard este puternic endoterma suma celor doua reactii
este pozitiva (ΔH![]() > 0).
> 0).
Variatia sistemului si temperatura de incepere a reducerii cu carbon
Variatia sistemului pentru reactia: MeO + C = Me + CO este conform legii fazelor: l = Ci + 2 - f = 3 +2 - 4 = 1, prin urmare compozitia fazei gazoase de echilibru depinde de un singur parametru: temperatura sau presiunea.
In figura 3.7 sunt redate curbele de echilibru pentru cele doua reactii corespunzatoare schemei B.
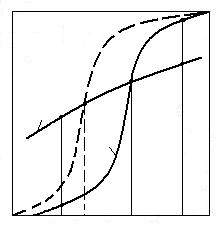 100 %
100 %
CO p<1at c
p=1at
Fig. 3.7. Echilibrul reactiei de reducere a unui oxid cu carbon (schema
B) 1 -
MeO + CO = Me + CO2; 2 - CO2 + C = 2CO.
b
a
1 a΄
d
2
100 % e
CO2 T<Te T'e Te T>Te T
Cazul T >Te. Se presupune ca initial a existat un echilibru corespunzator punctului b pentru reactia MeO + CO = Me + CO2.
Daca se introduce in sistem carbonul, echilibrul este perturbat si faza gazoasa tinde sa aiba o concordanta cu echilibrul reactiei Bell-Boudouard si punctul b se deplaseaza spre punctul c pe curba de echilibru a reactiei Bell-Boudouard.
Daca exista suficient carbon in sistem, in final faza gazoasa va avea compozitia indicata de punctul c.
Schematic procesul poate fi prezentat astfel:
MeO + CO → Me + CO2
![]()
![]() MeO + C = Me +
CO
MeO + C = Me +
CO
2CO← CO2 + C
Cazul T < Te. Folosind acelasi rationament, adica tinand seama ca compozitia fazei gazoase formata din CO si CO2 este dictata de reactia Bell-Boudouard, se ajunge la concluzia ca daca T < Te echilibrul reactiei se deplaseaza in jos spre punctul e de pe curba de echilibru Bell-Boudouard ca urmare a reactiei 2CO = CO2 + C. Rezulta deci nu numai ca reactia de reducere nu poate avea loc cu carbonul, dar poate avea loc chiar cu oxidarea cu CO2 a metalului anterior redus cu CO.
Schema in acest caz arata astfel:
MeO + CO → Me + CO2
![]()
![]() Me + CO2
= MeO + CO
Me + CO2
= MeO + CO
2CO← CO2 + C
Acest lucru nu se confirma in practica (in furnal unde exista MeO, CO, CO2 si C - probabil pentru ca reactia Bell-Boudouard inversa este franata cinetic de temperatura joasa). Totusi la T < Te reducerea cu carbon nu este posibila prin urmare reducerea MeO are loc numai pe cale indirecta cu CO dupa urmatoarea reactie: MeO + CO → Me + CO2.
Din cele expuse anterior rezulta ca reducerea cu carbon (directa) este posibila numai la temperaturi mai mari decat Te, care trebuie considerata ca temperatura de incepere a reactiei de reducere cu carbonul.
Evident Te depinde de natura oxidului MeO si de presiune (scaderea presiunii deplaseaza curba Bell-Boudouard spre stanga si odata cu ea si punctul a care indica temperatura Te.
a) In cazul oxizilor usor reductibili, curba Bell-Boudouard intersecteaza curba reactiei MeO + CO → Me + CO2 la temperaturi foarte scazute (Te are valori mici), iar la echilibru continutul de CO in faza gazoasa la aceste temperaturi este foarte scazut.
b) In cazul oxizilor cu reductibilitate medie, Te are valori moderate (7000C pentru FeO), iar la echilibru %CO2 ≈ %CO.
c) In cazul oxizilor greu reductibili, Te are valori mari (in general peste 1000 0C), iar la echilibru %CO > %CO2.
Determinarea temperaturii de reducere pe cale analitica
Din
schema A rezulta ca: ΔG![]() =
= ![]() [ ΔG
[ ΔG![]() - ΔG
- ΔG![]() ].
].
Valorile
pentru ΔG![]() , ΔG
, ΔG![]() se iau din tabele sub forma ΔG
se iau din tabele sub forma ΔG![]() = ΔH
= ΔH![]() - ΔH
- ΔH![]() ∙ T . Punand
conditia ca ΔG
∙ T . Punand
conditia ca ΔG![]() = 0 (la echilibru) se obtine la PCO = 1atm (conditia
standard) Te=
= 0 (la echilibru) se obtine la PCO = 1atm (conditia
standard) Te=![]() . Pentru schema B se procedeaza in mod identic.
. Pentru schema B se procedeaza in mod identic.
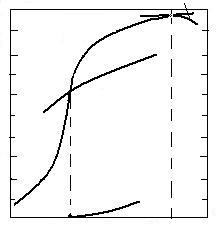 MnO
MnO
100 0
![]() 80 FeO 20
80 FeO 20
60 40
40 60
20 80
NiO
0 700 1420 100 T, sC
Fig. 3.8. Conditiile reducerii cu carbon a oxizilor in functie de
reductibilitatea lor.
Influenta temperaturii. Reactiile de reducere cu carbon fiind endoterme sunt favorizate
de cresterea temperaturii. Astfel, cu cresterea temperaturii
constanta de echilibru Kp
= P![]() , creste, ceea ce inseamna cresterea
presiunii partiale in faza gazoasa de echilibru.
, creste, ceea ce inseamna cresterea
presiunii partiale in faza gazoasa de echilibru.
Influenta presiunii. Reactiile de reducere cu carbon decurg cu crestere de volum,
prin urmare ele sunt favorizate de scaderea presiunii, ΔG0 al reactiei MeO + C → Me + CO scade, deoarece ΔG = ΔG0 + RT ln PCO (cand PCO = 1atm, ΔG = ΔG0= ΔG![]() - ΔG
- ΔG![]() , iar cand PCO
< 1atm, ΔG <
ΔG0).
, iar cand PCO
< 1atm, ΔG <
ΔG0).
Pentru schema A acest lucru se evidentiaza prin rotirea in sensul acelor de ceasornic a dreptei reactiei 2CO + O2 = 2CO.
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |