Termodinamica disocierii metanului
Metanul disociaza termic dupa reactia:
8) CH4 = C + 2 H2 ΔG![]() = 76 371 - 89,5 T (J/mol)
= 76 371 - 89,5 T (J/mol)
lg
Kp![]() = lg
= lg ![]() = -
= - ![]() + 4,68
+ 4,68
In absenta unui catalizator aceasta reactie incepe la 650-700 0C. In prezenta catalizatorilor, reactia incepe la temperaturi mai scazute ( de exemplu: in prezenta fierului proaspat redus, reactia incepe la 350 0C, iar in prezenta nichelului la 320 0C).
In general reactia de disociere a metanului nu este dorita, deoarece consuma caldura si in plus contribuie la depunerea carbonului fin pe peretii instalatiilor si conductelor de gaze.
In furnal insa, gazul metan introdus ca inlocuitor partial de cocs disociaza furnizand carbon si hidrogen care participa la reducerea oxizilor din minereuri. Dar pentru ca disocierea
este un proces endoterm, pentru compensarea caldurii este necesara imbogatirea aerului in
oxigen.
Reactiile de ardere a metanului
In functie de raportul intre metan si oxigen pot avea loc urmatoarele reactii:
2CH4 + O2 = 2CO + 4H2 ΔH![]() = - 70 795 (J/mol O2)
= - 70 795 (J/mol O2)
CH4 + O2 = CO2 +
2H2 ΔH![]() = - 317 995 (J/mol O2)
= - 317 995 (J/mol O2)
CH4 + 2O2 = CO2
+ 2H2O ΔH![]() = - 822 071 (J/mol O2)
= - 822 071 (J/mol O2)
Constantele de echilibru pentru aceste reactii sunt:
Kp![]() =
= 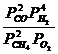 ;
;
Kp![]() =
= 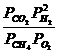 ;
;
Kp![]() =
= ![]()
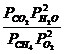 .
.![]()
Reactiile de ardere a metanului au loc in cuptoarele metalurgice, in convertizoarele pentru obtinerea gazelor reducatoare (dupa reactia 12) si in multe altele.
Toate reactiile sunt ireversibile, deci nu pot fi studiate direct (experimental).
Influenta temperaturii
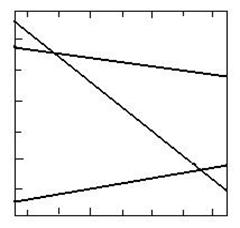
Toate sunt reactii puternic exoterme si deci cresterea temperaturii determina scaderea accentuata a constantei de echilibru, ritmul de scadere crescand de la reactia 12 la reactia 14, care este cea mai exoterma.
Din
diagrama care reda variatia entalpiei libere standard (ΔG0) cu temperatura pentru
reactiile de ardere a metanului se observa ca in cazul
reactiilor de ardere incompleta (12 si 13) ΔG![]() scade cu cresterea temperaturii, in timp ce pentru
reactia (14) de ardere completa a metanului ΔG
scade cu cresterea temperaturii, in timp ce pentru
reactia (14) de ardere completa a metanului ΔG![]() creste cu cresterea temperaturii (Kp
creste cu cresterea temperaturii (Kp![]() scade) ceea ce se reflecta nemijlocit asupra
variatiei compozitiei fazei gazoase cu temperatura. Asta
inseamna ca la cresterea temperaturii pentru reactia (14)
arderea metanului are loc mai putin complet decat la temperaturi joase.
scade) ceea ce se reflecta nemijlocit asupra
variatiei compozitiei fazei gazoase cu temperatura. Asta
inseamna ca la cresterea temperaturii pentru reactia (14)
arderea metanului are loc mai putin complet decat la temperaturi joase.
Arderea oricarui combustibil are loc insa , de regula, in afara de echilibru si in general vitezele reactiilor de ardere cresc cu cresterea temperaturii.
Influenta presiunii
Reactiile (12) si (13) avand loc cu crestere de volum sunt favorizate de scaderea presiunii in sistem, in timp ce reactia (14) nu este influentata de presiune, ea neavand loc cu variatie de volum.
 500 900 1300 1700 , °C
500 900 1300 1700 , °C
-70 000
ΔG0,cal
-110 000
(13)
-150 000 (12)
(14)
-190 000
800 1200 1600 1800 ,K
Fig. 1.9. Variatia cu temperatura a entalpiei libere standard a
reactiilor de ardere a metanului.
Varianta sistemului si compozitia fazei gazoase de echilibru
Aplicand legea fazelor rezulta:
l = 3+2-1 = 4.
Deci trebuie sa se cunoasca 4 din cei 8 parametrii pentru a se putea determina compozitia fazei gazoase de echilibru. De exemplu, temperatura , presiunea si doua din cele sase presiuni partiale.
Reactiile de conversie a metanului
Conversia metanului se foloseste in scopul obtinerii unor gaze reducatoare de diverse compozitii.
In afara de reactia (12) mai pot avea loc urmatoarele reactii:
15)
CH4 + CO2 = 2CO + 2H2 ΔH![]() = 246 787 J/mol CH4
= 246 787 J/mol CH4
16)
CH4 + H2O = CO + 3H2 ΔH![]() = 216 357 J/molCH4
= 216 357 J/molCH4
17)
CH4 + 2 H2O = CO2 + 4H2 ΔH![]() = 185 739 J/molCH4
= 185 739 J/molCH4
Gazele reducatoare obtinute se folosesc pentru reducerea minereurilor de fier in diferite instalatii:HyL, Midrex, Purofer etc. care cunosc in prezent o raspandire din ce in ce mai mare in lume, rezultand burete de fier prin reducere directa cu aceste gaze (procedee neconventionale).
Varianta sistemului
l
Deci
este necesara cunoasterea a patru din cei sase factori de care
depinde sistemul ( T, Pt, PCO, PH![]() , PCH
, PCH![]() ,PH
,PH![]() O, PCO
O, PCO![]() ) pentru a se putea determina
compozitia fazei gazoase de echilibru. De exemplu se cunosc temperatura, presiunea totala
si doua presiuni partiale si se determina celelalte
trei presiuni partiale.
) pentru a se putea determina
compozitia fazei gazoase de echilibru. De exemplu se cunosc temperatura, presiunea totala
si doua presiuni partiale si se determina celelalte
trei presiuni partiale.
Influenta temperaturii
Reactiile de conversie sunt reactii endoterme si deci sunt influentate pozitiv de cresterea temperaturii (Kp creste cu cresterea temperaturii in sistem).
Influenta temperaturii asupra termodinamicii reactiilor este redata prin relatiile:
ΔG![]() = 246 787 - 263,8 T (J/mol CH4)
= 246 787 - 263,8 T (J/mol CH4)
ΔG![]() = 216 357 - 253,7 T (J/mol CH4)
= 216 357 - 253,7 T (J/mol CH4)
ΔG![]() = 185 739 - 28,5 T (J/mol CH4)
= 185 739 - 28,5 T (J/mol CH4)
![]()
![]()
![]()
In
figura 1.10. este redata variatia ΔG![]() cu temperatura pentru reactiile de conversie a
metanului.
cu temperatura pentru reactiile de conversie a
metanului.
Influenta presiunii
Toate reactiile de conversie a metanului decurg cu crestere de volum, deci sunt favorizate de scaderea presiunii in sistem.
900 1300 1700 ,°C
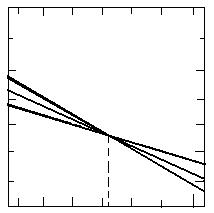 50 000 +209 275
50 000 +209 275
30 000
10 000 +41 855
ΔG0 ,cal (15) ΔG0 , J
-10 000 -41 855
-50 000 (17) -209 275
(16)
-90 000 -376 695
800 1450 2000 ,K
Fig. 1.10. Variatia lui ΔG0
cu temperatura pentru reactiile de conversie a metanului.
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |