Primul principiu al termodinamicii
Notiunea de principiu defineste o afirmatie care nu se poate demonstra matematic. Principiul reprezinta rezultatul studiilor experimentale asupra proceselor din natura. El este acceptat ca atare si nu se cunosc situatii care sa-l infirme.
Primul principiu al termodinamicii este o forma a legii generale a conservarii energiei, aplicata in cazul sistemelor termodinamice. El a fost formulat in 1842 de catre Julius Robert von Mayer. Enuntul general este urmatorul: intr-un sistem izolat, energia se conserva indiferent de transformarile care au loc in interior. Din punct de vedere cantitativ, principiul I statueaza conservarea energiei: ea nu poate fi creata, nici distrusa. Din punct de vedere calitativ, principiul I indica posibilitatea transformarii energiei dintr-o forma in alta, in cantitati determinate.
Energia interna
Energia interna este o marime de stare care reprezinta energia termica a unui corp intr-o stare termodinamica oarecare. Se noteaza cu U si se masoara in [J]. In calcule este util sa raportam energia interna la unitatea de masa:
![]() ,
,
Marimea u este energia interna specifica si se masoara in [J/Kg].
Energia interna se defineste conform teoriei cinetico-moleculare (Maxwell si Claussius) ca fiind :
![]()
unde: ![]() -suma energiei cinetice moleculare corespunzatoare
miscarilor de rotatie, translatie si vibratie ;
-suma energiei cinetice moleculare corespunzatoare
miscarilor de rotatie, translatie si vibratie ;
![]() -suma energiei
potentiale datorata fortelor de interactiune (atractie
/ respingere) dintre molecule ;
-suma energiei
potentiale datorata fortelor de interactiune (atractie
/ respingere) dintre molecule ;
![]() - suma energiei din interiorul particulelor (la nivel
submolecular).
- suma energiei din interiorul particulelor (la nivel
submolecular).
Trebuie subliniat ca din energia interna U nu face parte energia cinetica datorata miscarii sistemului in ansamblu si nici energia potentiala a sistemului aflat in camp de forte externe. Ambele tipuri de energie sunt externe.
Energia interna este o marime de stare, deci depinde de parametrii de stare ai sistemului. In calculele tehnice nu intereseaza valoarea absoluta a energiei interne, ci numai variatia ei atunci cand sistemul trece dintr-o stare in alta.
![]()
unde ![]() -energia interna a sistemului in stare finala;
-energia interna a sistemului in stare finala;
![]() -energia interna
a sistemului in stare initiala.
-energia interna
a sistemului in stare initiala.
Pentru un anumit sistem
termodinamic, componeneta ![]() a energiei
continute in interiorul particulelor este constanta in timpul
oricarui proces temodinamic. Proprietatile particulelor, privite
ca solide rigide, se considera neschimbate in timpul unui proces
termodinamic. Astfel, variatita energiei interne este:
a energiei
continute in interiorul particulelor este constanta in timpul
oricarui proces temodinamic. Proprietatile particulelor, privite
ca solide rigide, se considera neschimbate in timpul unui proces
termodinamic. Astfel, variatita energiei interne este:
![]()
Energia interna depinde de viteza de agitatie a moleculelor, de masa si numarul lor. Ea se manifesta, la nivel macroscopic, prin gradul de incalzire a gazului, care se masoara, la randul sau, prin temperatura. Deci, energia interna a unui gaz perfect depinde numai de temperatura, nu si de volum . Ea reprezinta suma energiei particulelor (moleculelor) insesi. Daca numarul de molecule este acelasi, indiferent de volumul ocupat, energia interna ramane aceeasi .
2 Lucrul mecanic
Lucrul mecanic reprezinta energia schimbata intre sistem si mediul exterior in cursul unei interactiuni mecanice.
Lucrul mecanic, L, se exprima prin produsul dintre componenta fortei, F, pe directia de deplasare si distanta x pe care se deplaseaza punctul de aplicatie al fortei.
Pentru o deplasare elementara, dx , lucrul mecanic elementar schimbat cu mediul va fi:
![]()
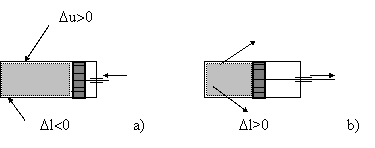
Fig.1 Variatia energiei interne si lucrul mecanic in cazul proceselor de:
a)compresiune; b)destindere
Datorita interactiunii mecanice intre sistem si mediu, energia interna a sistemului se modifica. Considerand ca sistem gazul cuprins in cilindrul din fig 1, variatia energiei interne DU este pozitiva sau negativa in functie de variatia lucrului mecanic.
Atat in cazul compresiunii, cat si in cel al destinderii, considerand procesul (miscarea pistonului ) suficient de lent, astfel incat presiunea sa fie constanta pe piston, lucrul mecanic elementar poate fi scris:
![]()
unde A- aria sectiunii transversale a pistonului;
p- presiunea pe piston , egala cu presiunea gazului.
Dar ![]() reprezinta
variatia elementara a volumului de gaz. Astfel:
reprezinta
variatia elementara a volumului de gaz. Astfel:
![]() [J]
[J]
Lucrul mecanic specific reprezina lucrul mecanic raportat la unitatea de masa de gaz. O cantitate elementara de lucru mecanic specific este data de relatia:
![]() [J/Kg]
[J/Kg]
In termodinamica, s-a stabilit conventional ca lucrul mecanic primit de catre sistem din exterior este negativ (L<0) - cazul compresiunii, iar lucrul mecanic cedat de sistem in exterior este pozitiv (L>0) - cazul destinderii.
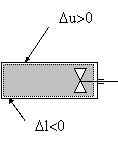 In
cazul compresiei, sau in cel al destinderii, procesul poate fi considerat
reversibl daca se neglijeaza frecarea intre piston si gaz. In
aceasta situatie, inversarea sensului de miscare a pistonului
conduce la revenirea sistemului in starea initiala.
In
cazul compresiei, sau in cel al destinderii, procesul poate fi considerat
reversibl daca se neglijeaza frecarea intre piston si gaz. In
aceasta situatie, inversarea sensului de miscare a pistonului
conduce la revenirea sistemului in starea initiala.
Fig.Lucrul mecanic efectuat de elice se transforma ireversibil in caldura
Sa urmarim sistemul din fig. Acest sistem (gazul din interiorul cilindrului) primeste energie sub forma de lucru mecanic din exterior, datorita interactiunii mecanice dintre gaz si paletele care se rotesc. Se observa ca presiunea pe paletele elicii este diferita de cea a gazului. Lucrul mecanic nu se poate exprima prin relatiile de mai sus. In acest caz, lucrul mecanic primit de sistem este de frecare si se transforma ireversibil in caldura.
Prin inversarea sensului procesului, adica prin inversarea sensului de rotire a paletelor, sistemul nu mai poate fi adus in starea initiala.
3 Lucrul mecanic in transformarile de stare reversibile
Se considera gaz inchis intr-un cilindru cu ajutorul unui piston mobil. El trece dintr-o stare termodinamica initiala 1, intr-o stare finala, La un moment dat, intr-o stare intermediara a acestei transformari, gazul are presiunea p si ocupa un volum V.
Pentru o deplasare infinitezimala a pistonului, pe distanta dx, in cursul careia se poate neglija variatia presiunii, volumul se mareste cu dV. Lucrul mecanic elementar efectuat de gaz prin deplasarea pistonului pe distanta dx se exprima astfel:
![]()
Se noteaza ![]() si nu dL
deoarece nu este vorba despre variatia infinit mica a marimii L.
Lucrul mecanic nu este o marime de stare care sa sufere variatii
la trecerea sistemului dintr-o stare in
alta, ci o marime de proces. Deci
si nu dL
deoarece nu este vorba despre variatia infinit mica a marimii L.
Lucrul mecanic nu este o marime de stare care sa sufere variatii
la trecerea sistemului dintr-o stare in
alta, ci o marime de proces. Deci ![]() reprezinta o
cantitate elementara de lucru mecanic si nu o diferentiala
totala exacta.
reprezinta o
cantitate elementara de lucru mecanic si nu o diferentiala
totala exacta.
Lucrul mecanic efectuat de gaz prin deplasarea sistemului pe distanta x la trecerea dintr-o stare initiala 1 intr-o stare finala 2 este:
![]() [J]
[J]
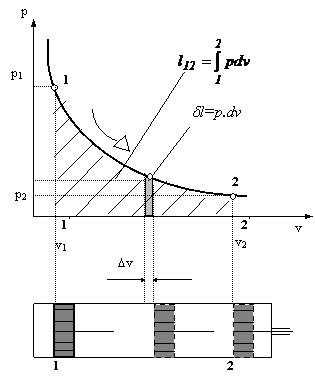
Fig.3 Diagrama lucrului mecanic intr-o transformare de stare reversibila
In figura 3 s-a reprezentat grafic variatia presiunii
gazului din cilindru in functie de volumul ocupat, intr-o diagrama
avand in ordonata presiunea, iar in abscisa volumul. Se poate observa
ca lucrul mecanic efectuat de 1 kg gaz, l12 , este
reprezentat de aria cuprinsa sub curba 1-2, adica aria
hasurata![]() .
.
Aceasta diagrama, care permite reprezentarea grafica a lucrului mecanic se numeste diagrama mecanica. Lucrul mecanic pecific va fi:
![]() [J/Kg]
[J/Kg]
4 Lucrul mecanic de dislocare (deplasare)
In cazul sistemelor deschise, pe langa interactiunea mecanica de tipul piston (piesa mobila) - gaz , mai apare o interactiune mecanica de tipul gaz - gaz. Astfel, daca in cilindrul unei masini cu piston intra gaz la presiune constanta, printr-o conducta care face legatura intre sistem si mediul ambiant (fig.4), pentru introducerea fiecarui kilogram de gaz in sistem, se consuma din exterior un lucru mecanic egal cu:
![]() [J]
[J]
Acest lucru mecanic cedat fiecarei transe de gaz de catre masa de gaz aflata in spatele sau (care actioneaza ca un piston), se numeste lucru mecanic de deplasare (de dislocare). In fig.4 , transele de gaz cu masa de 1 kg sunt reprezentate prin patrate mici care se succed pe conducta de admisie.
Lucrul mecanic de deplasare reprezinta masura energetica a interactiunii prin transfer de masa intre sistem si mediul exterior, la intrarea si respectiv iesirea fluidului din sistem.
In timpul admisiei, fluidul intra in sistem, deci sistemul primeste lucru mecanic din exterior. In timpul evacuarii, fluidul iese din sistem, deci sistemul cedeaza mediului lucru mecanic.
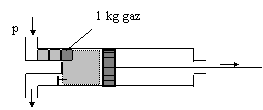
Fig. 4 Interactiunea gaz - gaz la un sistem termodinamic deschis;
![]() cantitatea
de gaz cu masa de 1 kg este reprezentata prin simbolul:
cantitatea
de gaz cu masa de 1 kg este reprezentata prin simbolul:
5.Lucrul mecanic tehnic
Din cauza lucrului mecanic de dislocare, lucrul mecanic schimbat de sistem cu mediul nu reprezinta lucrul mecanic utilizabil, in cazul unui motor termic, sau lucrul mecanic consumat, in cazul compresoarelor. Astfel, se introduce notiunea de lucru mecanic tehnic.
Se considera o masina termica
producatoare de lucru mecanic. Masa de agent termic care trece prin
masina in intervalul τde timp este m. Parametrii la
intrarea in masina sunt ![]() . Dupa admisie, agentul termic sufera o
transformare termodinamica in urma careia ajunge din starea 1, in
starea La evacuarea din
masina, agentul termic are parametrii
. Dupa admisie, agentul termic sufera o
transformare termodinamica in urma careia ajunge din starea 1, in
starea La evacuarea din
masina, agentul termic are parametrii![]() .
.
Lucrul mecanic total pe care il dezvolta agentul termic in masina (care include atat lucrul mecanic produs la trecerea de la starea 1 la 2, cat si lucrul mecanic de admisie si de evacuare a agentului termic) poarta numele de lucru mecanic tehnic sau lucru mecanic util exterior .
Lucrul mecanic de admisie (dislocare) este pozitiv ,![]() , iar cel de evacuare este negativ
, iar cel de evacuare este negativ ![]() .
.
Lucrul mecanic tehnic se exprima sub forma:
![]()
![]()
sau
![]()
![]() pentru m = 1 Kg
pentru m = 1 Kg
Lucrul mecanic tehnic se poate calcula grafic cu ajutorul ariilor delimitate in diagrama mecanica reprezetata in figura 5
![]() = aria 11'22'+ aria
11"22"- aria 22 = aria
= aria 11'22'+ aria
11"22"- aria 22 = aria ![]()
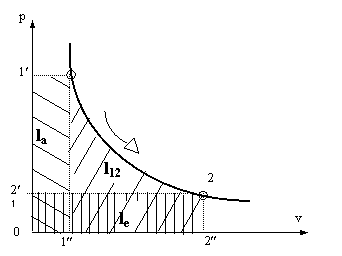
Fig.5.
Diagrama mecanica pentru deducerea grafica
a lucrului mecanic tehnic, ca suma de arii,unde:

Aria rezultata din insumarea de mai sus este
hasurata in fig.6; ea este proportionala cu lucrul mecanic
tehnic corespunzator procesului ![]() .
.
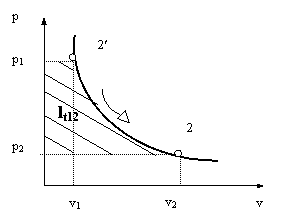
Fig.6 Lucrul mecanic tehnic rezultat grafic din diagrama reprezentata in fig.5
6 Caldura
Caldura este o forma de energie transferata.
Intre un sistem termodinamic si mediul exterior se poate realiza, independent de interactiunile de natura mecanica, un schimb de energie, pus in evidenta prin modificarea temperaturii sistemului. Schimbul energetic inceteaza daca temperatura mediului si a sistemului devin egale [7]. Energia transmisa in acest mod se numeste caldura.
Experimental s-a constatat ca energia schimbata pe aceasta cale este proportionala cu masa sistemului si cu variatia temperaturii sale.
Caldura schimbata de un sistem (corp) cu mediul exterior, intr-un proces termodinamic elementar, in cursul caruia temperatura sistemului sufera o variatie infinit mica, se exprima astfel :
![]() [J]
[J]
unde : m - masa corpului, [Kg];
dT - variatia elementara a temperaturii, [K];
c -
caldura specifica (caldura masica ), [![]() ].
].
Ecuatia (9) reprezinta ecuatia calorica. Conform acestei relatii, caldura specifica depinde de natura corpului si de starea sa termodinamica.
Caldura elementara, ![]() , nu reprezinta variatia infinit mica a unei
marimi de stare si, deci, expresia
, nu reprezinta variatia infinit mica a unei
marimi de stare si, deci, expresia ![]() nu este o
diferentiala totala, ci o cantitate infinit mica de
caldura.
nu este o
diferentiala totala, ci o cantitate infinit mica de
caldura.
Caldura ![]() primita sau
cedata de un sistem intr-un proces termodinamic 1-2, in cursul caruia
temperatura sistemului variaza de la
primita sau
cedata de un sistem intr-un proces termodinamic 1-2, in cursul caruia
temperatura sistemului variaza de la ![]() la
la ![]() va fi:
va fi:
![]() [J]
[J]
Schimbul de energie intre corpuri , sub forma de caldura, depinde de natura procesului termodinamic.
Pentru masa unitara, m = 1 kg, rezulta:
![]()
![]() [J/Kg]
[J/Kg]
Prin conventie, caldura primita de un corp, in cursul unui proces termodinamic, este considerata pozitiva (conduce la cresterea temperaturii sistemului, dT > 0), iar caldura cedata este considerata negativa.
6 Entalpia
Entalpia este o marime de stare, ce caractercterizeaza nivelul energetic al unui sistem termodinamic. Se noteaza cu H si se masoara in [J] sau, daca se raporteaza la unitatea de masa, entalpia specifica se noteaza cu h si se masoara in [J/kg].
Relatia de definitie :
![]()
Entalpia este, din punct de vedere analitic, suma dintre energia interna si lucrul mecanic de deplasare.
Relatia de legatura intre entalpie si entalpia specifica:
![]()
Entalpia, sau continutul total de caldura, este greu de definit practic, deoarece nu este direct masurabila. Se considera urmatoarea experienta imaginara: tinem gazul sub presiune constanta si reducem temperatura pana la zero absolut. Din acel moment, pastrand presiunea constanta, introducem o cantitate de caldura pana atingem o anumita temperatura T. Cantitatea totala de caldura a sistemului, astfel introdusa, este egala cu variatia entalpiei.
8 Exprimarea matematica a primului principiu al termodinamicii
a.Sisteme inchise
Sa
consideram un sistem termodinamic inchis, care primeste de la mediul
exterior caldura ![]() si efectueaza
(cedeaza) lucrul mecanic,
si efectueaza
(cedeaza) lucrul mecanic, ![]() . Tinand cont de conventiile de semne, in acest caz
avem:
. Tinand cont de conventiile de semne, in acest caz
avem: ![]() si
si ![]() .
.
Daca
energia interna initiala a sistemului este ![]() , datorita schimbului de energie cu mediul exterior,
sistemul va avea in final energia interna
, datorita schimbului de energie cu mediul exterior,
sistemul va avea in final energia interna ![]() .
.
Primul principiu al termodinamicii spune ca variatia energiei interne va fi :
![]() [J/Kg]
[J/Kg]
sau, intr-un proces termodinamic elementar suferit de o unitate de masa (m=1 kg):
![]()
Enunt : cantitatea de caldura, introdusa din exterior intr-un gaz oarecare, se regaseste in variatia energiei interne si in lucrul mecanic efectuat de acest gaz in exterior.
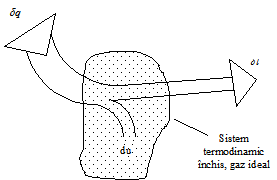
Fig.7 Ilustrarea primului principiu al termodinamicii aplicat unui sistem inchis
b.Sisteme deschise
Se considera o masina termica in care, de exemplu, agentul termic primeste caldura si produce lucru mecanic (fig.8). Sistemul este deschis deoarece prin masina trece in permanenta un fluid de lucru.
Conform
legii generale a conservarii energiei, agentul are energia ![]() la intrarea in sistem
si
la intrarea in sistem
si ![]() la iesire. Suma
energiilor schimbate cu mediul exterior (
la iesire. Suma
energiilor schimbate cu mediul exterior (![]() ), se poate scrie pentru masa m de agent:
), se poate scrie pentru masa m de agent:
![]()
unde![]()
Energia totala a agentului intr-un punct oarecare este compusa din energia cinetica, energia potentiala de pozitie si energia interna. Aceasta este semnificatia termenilor din relatia:
![]() [J]
[J]
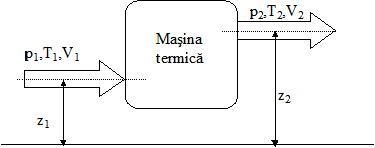
Fig.8 Masina termica privita ca un sistem deschis. Parametrii termici ai sectiunii de intrare sunt notati cu indice 1, iar cei ai sectiunii de iesire, cu indice 2
Inlocuind in ecuatia de bilant energetic:
(18) ![]()
rezulta expresia matematica a primului principiu pentru sisteme deschise :
(19a) ![]()
Pentru o masa unitara de agent termic relatia devine:
(19b) ![]()
sau, tinand cont de relatia de definitie a entalpiei, (13):
(19c) ![]()
9 Formulari ale primului principiu al termodinamicii
Primul principiu al termodinamicii, care exprima legea generala a conservarii si transformarii energiei in procesele termice, cunoaste mai multe formulari, printre care [4]:
a) Caldura poate fi produsa din lucru mecanic si se poate transforma in lucru mecanic, totdeauna in baza aceluiasi raport de echivalenta. In sistemul tehnic, echivalenta dintre caldura si lucru mecanic :
![]()
b) Energia unui sistem termodinamic izolat se mentine constanta.
c) Nu se poate realiza o masina termica cu functionare continua, care sa produca lucru mecanic fara sa consume o cantitate echivalenta de caldura (perpetuum mobile de ordinul/speta I) .
10 Caldura specifica
Considerand o masa unitara de agent termic, care sufera o transformare elementara la volum constant (intr-un recipient nedeformabil), din expresia matematica a primului principiu pentru sisteme inchise se obtine :
![]()
unde : ![]()
Rezulta :
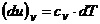 si
si ![]() , [J/kg·K]
, [J/kg·K]
Similar :
![]() si
si 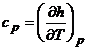 , [J/kg·K]
, [J/kg·K]
Caldura
specifica la volum constant, ![]() , este egala cu variatia energiei interne a
unitatii de masa pentru o variatie a temperaturii
egala cu unitatea, intr-o transformare la volum constant .
, este egala cu variatia energiei interne a
unitatii de masa pentru o variatie a temperaturii
egala cu unitatea, intr-o transformare la volum constant .
Caldura
specifica la presiune constanta, ![]() , este egala cu variatia entalpiei
unitatii de masa, intr-o transformare la presiune constanta
pentru o crestere a temperaturii egala cu unitatea.
, este egala cu variatia entalpiei
unitatii de masa, intr-o transformare la presiune constanta
pentru o crestere a temperaturii egala cu unitatea.
Pornind de la relatia (15) se poate scrie:
![]()
in care introducem : ![]() , rezulta:
, rezulta:
![]()
Din ecuatia de stare rezulta:
![]() , deci :
, deci :
![]()
Pentru o transformare sub presiune constanta, avem :
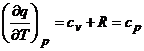 (Relatia lui Robert Mayer
(Relatia lui Robert Mayer
Raportul dintre caldura specifica la presiune constanta si cea la volum constant, raport notat cu k, se numeste exponent adiabatic .
![]()
Din relatiile de mai sus rezulta:
![]() ;
; ![]()
Pentru gazele biatomice , cum ar fi aerul , se poate considera :
![]() ;
; ![]() ;
; ![]()
Proprietati si constante specifice unor gaze mai des utilizate sunt prezentate in tabelul 3 din anexa1.
Intrebari test
1.Energia interna este:
![]() a) marime de stare care se manifesta prin gradul de
incalzire a sistemului;..
a) marime de stare care se manifesta prin gradul de
incalzire a sistemului;..
b) marime de proces care se manifesta prin gradul de incalzire a sistemului; a) b) c)
c) marime de stare care depinde de volumul gazului perfect.
Lucrul mecanic total pe care il dezvolta agentul termic in masina se numeste:
![]() a) lucru mecanic de
evacuare;
a) lucru mecanic de
evacuare;
b) lucru mecanic de dislocare; a) b) c)
c)lucru mecanic de deplasare.
3. Entalpia este o marime de stare care exprima:
![]() a)nivelul energetic al
unui sistem termodinamic;.
a)nivelul energetic al
unui sistem termodinamic;.
b)continutul total de caldura al unui sistem termodinamic; a) b) c)
c)fluxul de caldura evacuat de un corp.
4.Principiul I al termodinamicii, aplicat unui sistem inchis, spune: cantitatea de caldura introdusa din exterior intr-un gaz oarecare se regaseste in :
![]() a)variatia entalpiei
si in lucrul mecanic efectuat de gaz in exterior;
a)variatia entalpiei
si in lucrul mecanic efectuat de gaz in exterior;
b)variatia entropiei si in lucrul mecanic efectuat de acest gaz in exterior a) b) c)
c)variatia energiei interne si in lucrul mecanic efectuat de acest gaz in exterior.
5.Energia totala a unui agent termic intr-un punct oarecare al unui sistem termodinamic deschis este alcatuita din:
![]() a)energia interna,
energia potentiala de presiune, energia
cinetica;.
a)energia interna,
energia potentiala de presiune, energia
cinetica;.
b) energia cinetica, energia interna, energia potentiala de pozitie; a) b) c)
c)energia cinetica si energia potentiala.
6.Lucrul
mecanic elementar , ![]() , efectuat din exterior asupra unui gaz aflat in interiorul
unui cilindru cu piston este:
, efectuat din exterior asupra unui gaz aflat in interiorul
unui cilindru cu piston este:
![]() a)
a) ![]() ;
;
b) ![]() ; a) b) c)
; a) b) c)
c) ![]() .
.
7.Principiul I al termodinamicii constituie o forma a:
a)
![]() legii conservarii
masei;......................
legii conservarii
masei;......................
b) legii gravitatiei; a) b) c)
c) legii conservarii energiei.
8.Expresia matematica a primului principiu al termodinamicii,
pentru sisteme inchise este:
a)
![]()
![]() ...........................
...........................
b)
![]() a) b) c)
a) b) c)
c)
![]()
Problema 1
Sa se calculeze
variatia energiei interne a unui kilogram de aer uscat, care se
raceste, daca entalpia sa scade cu valoarea ![]() . Pentru aerul uscat, se cunosc: caldura specifica
la volum constant,
. Pentru aerul uscat, se cunosc: caldura specifica
la volum constant, ![]() si
caldura specifica la presiune constanta,
si
caldura specifica la presiune constanta, ![]()
Relatia matematica a principiului I al
termodinamicii, scrisa in cazul unei transformari la volum constant (![]() ) ia forma
) ia forma ![]() , deoarece
lucrul mecanic este nul
, deoarece
lucrul mecanic este nul![]() Rezulta:
Rezulta:
![]()
Relatia de definitie a entalpiei, scrisa sub forma diferentiala este:
![]()
Facand raportul intre cele doua relatii de mai sus, rezulta:
![]()
Deci, ![]() , unde k este coeficientul adiabatic al aerului.
, unde k este coeficientul adiabatic al aerului.
Integrand relatia obtinuta, intre cele doua stari ale aerului, se obtine:
![]()
![]()
Se observa ca energia interna este mai mica in starea finala, 2, decat in starea initiala, 1.

In figura 3 este
reprezentat un ansamblu de doua butelii cu aer comprimat, legate intre ele
printr-o conducta prevazuta cu robinet. Ansamblul se
considera izolat adiabat. Starea aerului din butelia A este data de
parametrii ![]()
![]()
![]() , iar starea aerului din butelia B este data de
parametrii
, iar starea aerului din butelia B este data de
parametrii ![]()
![]()
![]() . Se deschide robinetul conductei de legatura.
Sa se calculeze temperatura si presiunea aerului din cele doua
butelii dupa atingerea echilibrului termic. Se considera aceeasi
caldura specifica sub presiune constanta, cp,
atat pentru butelia A, cat si pentru butelia B. Volumul conductei de
legatura se neglijeaza.
. Se deschide robinetul conductei de legatura.
Sa se calculeze temperatura si presiunea aerului din cele doua
butelii dupa atingerea echilibrului termic. Se considera aceeasi
caldura specifica sub presiune constanta, cp,
atat pentru butelia A, cat si pentru butelia B. Volumul conductei de
legatura se neglijeaza.
a) b)
Fig.3a) ansamblul cu robinetul inchis; b)ansamblul cu robinetul deschis, dupa atingerea echilibrului
.Ce caldura a absorbit
unitatea de masa de amestec gazos, daca temperatura sa a crescut cu ![]() , fara ca presiunea sa se modifice? Se
cunoaste caldura specifica la presiune constanta
, fara ca presiunea sa se modifice? Se
cunoaste caldura specifica la presiune constanta ![]() . Care este entalpia amestecului gazos in stare finala,
daca temperatura este
. Care este entalpia amestecului gazos in stare finala,
daca temperatura este ![]() ?
?
RASPUNSURI SI REZOLVARI
1.a; -; 3.a,b; 4.c; 5.b; 6.b,c; 7.c; 8.c.
Rezolvare
Ansamblul celor doua butelii formeaza un sistem
- inchis, deci masa gazului, in ansamblu, ramane aceeasi dupa deschiderea robinetului,
-izolat, deci energia lui se conserva.
Ca urmare, cantitatea de caldura cedata de gazul cu temperatura mai ridicata, B, va fi egala cu cantitatea de caldura primita de gazul cu temperatura mai scazuta, A. Caldura cedata este negativa:
![]()
![]()
unde am notat cu T temperatura finala, de echilibru pentru gazul din sistem.
Masa gazului din fiecare butelie se calculeaza cu ecuatia de stare:
![]()
![]()
Temperatura la echilibru rezulta:
![]()
Valoarea presiunii se determina aplicand ecuatia de stare pentru ansamblul celor doua butelii cu robinetul deschis:
![]()
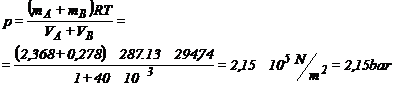
. Rezolvare
Din ecuatia calorica de stare, scrisa pentru unitatea de masa a amestecului gazos, rezulta caldura absorbita la presiune constanta:
![]()
Dar, ![]() , rezulta:
, rezulta:
![]()
Entalpia amestecului gazos de masa unitara, in starea finala 2, este data de relatia:
![]() .
.
Observatie
In general, entalpia, fiind o functie de stare, intereseaza ca variatie intre doua stari si nu ca valoare absoluta, asa cum s-a cerut in aceasta problema.
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |