analiza calitativa: identificarea unor ioni;
analiza cantitativa: duritatea temporara si totala.
Apa este un factor indispensabil organismului uman. Inca din cele mai vechi timpuri asezarile umane au fost de-a lungul raurilor sau pe malul marilor.Necesarul zilnic de apa al omului este aproximativ de 1.5-2 litri consumata ca atare ,dar pentru curatenia corporala omul foloseste zilnic aproximativ 40litri de apa.Organizatia Mondiala a Sanatatii considera ca optim pentru acoperirea acestor nevoi ,o cantitate de 100 litri in 24 ore.
Apa folosita de om trebuie sa intruneasca anumite proprietati organoleptice fizice si chimice.Aceste proprietati pot fi determinate cu ajutorul analizei fizico-chimice a apei.In acest sens , unele determinari se fac la locul de recoltare ,astfel:
determinarile organoleptice (gust,miros ),determinarea temperaturii, fixarea oxigenului dizolvat si a hidrogenuluisulfurat ,determinarea clorului rezidual,a bioxidului de carbon liber si agresiv,determinarea de Ph.
determinarea turbiditatii, a suspensiilor,determinarea reziduului,determinarea fosfatilor a oxidabilitatii a formelor de azot,determinarea fierului, a durabilitatii temporare ,a manganului.
Determinarea alcalinitatii si aciditatii,determinarea duritatii totale a calciului si magneziului,determinarea fluorului.
Proprietatile organoleptice ale apei sunt reprezentate de acele caracteristici care impresioneaza organele noastre de simt.,adica gustul si mirosul apei.
Gustul apei este dat de continutul in substante chimice si in preimul rand de sarurile minerale si de gazele dizolvate (oxigenul si bioxidul de carbon).Excesul sau carenta unora dintre aceste componente poate imprima apei un gust neplacut(fad ,salciu,amar,dulceag).
Mirosul apei este legat de asemenea de prezenta in exces a unor elemente naturale sau provenite prin purificarea apei,ca si din unele transformari la care sunt supuse in apa anumite substante chimice mai ales poluante.
Atat gustul cat si mirosul apei, desi au ca principala caracteristica un mare grad de subiectivitate ,totusi au din punct de vedere sanitar,o valoare deosebita.In primul rand influienta lor asupra utilizarii apei este hotaratoare ,poate duce la excluderea folosirii apei respective.Gustul si mirosul apei pot servi si ca indicatori de poluare a apei.
Apa potabila nu trebuie sa aiba miros caracteristic si trebuie sa aiba un gust placut.In caz contrar apa poate prezenta subtante poluante care sunt daunatoare sanatatii.Prezenta substantelor poluante in apa poat fi evidentiate prin culoare apei.Chiar si temperatura apei poate fi un indicator indirect de poluare ,mai ales pentru apele subterane ,unde se stie ca temperatura este constanta.Varitia acestei temperaturi insa ,paralel cu variatia temperaturii aerului ,indica existenta unei comunicari cu exteriorul si deci posibilitatea de patrundere in sursa de apa a poluantilor din afara.
Astazi exista o preocupare continua la nivel national si mondial de inbunatatire continua a calitatii apei potabile.In unele tari din vestul Europei se urmaresc 45 de indicatori referitor la calitatea apei ,iar normele Comisiei Economice Europene (C.E.C.)aprobate in 1980,recomanda urmarirea continua a 62 de caracteristici ale apei potabile.
Planul mondial de supraveghere a calitatii apelor face parte din "Sistemul mondial de supraveghere a mediului inconjurator (G.E.M.S.)"initiat prin Prgramul Natiunilor Unite, prevede urmarirea calitatii apelor prin trei categorii de parametri:
a)parametri de baza-temperatura
-pH
-conductibilitate
-oxigen dizolvat
-colibacili
b)parametri indicatori ai poluarii persistente:
-cadmiu
-mercur
-compusi organo-halogenati
-compusi organo -metalici
-uleiuri minerale
c)parametri obtionali:
-carbon organic total
-consum biochimic de oxigen
-metale grele
-arsenic
-bor
-sodiu
-cianuri
-uleiuri
-streptococi
In toate tarile dezvoltate controlul poluarii apelor constituie o preocupare permanenta,deoarece calitatea apei contribuie la sanatatea natiunilor.
In tara noastra ca in toate tarile lumii ,exista legi speciale in lupta impotriva poluarii apelor. .La Stokholm in anul 1972 a fost prima conferinta mondiala pentru protectia mediului inconjurator iar ONU a lansat "Programul Natiunilor Unite pentru Mediul Inconjurator",prin care s-au initiat o serie de actiuni pentru ameliorarea situatiei existente si promovarea calitatii apei inclusiv a celei din mari si oceane.
Contradictia dintre tarile bogate si cele sarace se reflecta in acest element vital alvietii si dezvoltarii care este apa ,aducand decalajul si asa enorm intre bogati si saraci.Dupa statistici recente in tarile sarace 3 din 5 persoane au acces la apa potabila ,75%dintre locuitori nedispunand de instalatii sanitare cu minim de igiena. Astfel s-a constatat ca datorita consumului de apa nepotabila ,in tarile sarace mor anual circa 15 milioane de copii in varsta de pana la 5 ani.De aceea O.N.U. conchide ca principala preocupare a societatii in prezent si in viitor va trebui sa fie reprezentata de evitarea sau limitarea poluarii apei ca prima actiune de mentinere a actualelor surse naturale ale omenirii.
Apele naturale si cele industriale pot fi considerate adevarate solutii datorita substantelor pe care le contin dizolvate.
Apele de precipitatii, traversind atmosfera mai mult sau mai putin poluata, dizolva mici cantitati de gaze (O2, N2, NH3, CO2, oxizi de azot, H2S ,SO3).
Apele de suprafata ti cele freatice dizolva unele componente ale rocilor cu care vin in contact si pot contine saruri de Ca, Mg, Na, K, saruri de Al, Fe, Si in stare coloidala, particule de argila si nisip in suspensie, precum si substante organice.
Continutul de saruri din apa provoaca neomogenitati in numeroase procese industriale unde aceasta se foloseste (depuneri de piatra in instalatiile centralelor termice, defecte lan vopsirea si albirea tesaturilor, coroziune etc.).
In constructii, apa folosita pentru prepararea mortarelor si betoanelor de ciment trebuie sa indeplineasca anumiti indici calitativi si cantitativi privind continutul total de saruri, pH-ul, prezenta substantelor organice etc., in caz contrar putind apare fenomene de coroziune a acestor materiale (tabel anexa 4.1 conform STAS 790-1984).
4.1. Analiza calitativa a apei.
Prezenta unor ioni in apa de analizat se poate stabili prin analize chimice calitative (identificari) folosind un reactiv specific. Acesta reactioneaza cu un anumit ion din apa cu aparitia unui precipitat, a unei coloratii intense, degajarea unor gaze, miros, fenomene usor de observat.
Deoarece substantele dizolvate in apa se afla de regula disociate in ioni, reactivul specific, care impreuna cu ionul de identificat, sa formeze un precipitat sau un complex colorat.
4.1.1. Identificarea cationilor Ca2+, Fe3+, NH4+, Pb2+.
Ionii Ca2+, prezenti adesea in apele naturale, au ca reactiv specific acidul oxalic sau orice sare solubila si disociabila a acestuia, impreuna cu care formeaza un precipitat alb cristalin de oxalat de calciu:
![]()

Ionii Fe3+ se identifica cu solutie sulfocianura de potasiu KSCN cu care se formeaza cationul complex [Fe(SCN)]2+ colorat in rosu intens:
![]()
Fe3+ + SCN- [Fe(SCN)]2+ [2]
Ionii NH4 se identifica cu reactivul Nessler (o solutie alcalina de iodura dubla de Hg si K) cu care formeaza un precipitat amorf, rosu-brun de iodura de mercur si amoniu:
NH4 + KOH NH3 + K+ + H2O
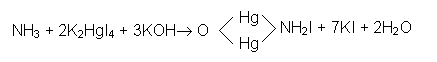 [3]
[3]
Ionii Pb2+ se identifica cu solutie de cromat sau bicromat de sodiu sau potasiu care precipita sarurile de plumb sub forma cromatului de Pb de culoare galbena:
Pb2+ + CrO42- PbCrO4 [4]
2 Pb2+ + HOH + Cr2O72- PbCrO4 + 2H+ [5]
4.1.2. Identificarea anionilor Cl-, SO42, NO2-.
Ionii Cl- provin prin disocierea clorurilor dizolvate in apa si acidului clorhidric. Reactivul specific este azotatul de argint AgNO3. Ionul specific Ag+ precipita Cl- sub forma de clorura de argint AgCl un precipitat alb branzos, insolubil in solutii diluate ce contin Cl- dar solubil in exces de ioni de Cl-.
Cl- + Ag+ AgCl [6]
AgNO3 este reactivul specific pentru ionii de halogeni Cl-, Br-, I-, cu exceptia F, caci AgF este solubila.
Ionii SO42- provin prin disocierea sulfatilor dizolvati in apa si a acidului sulfuric prezent in apele reziduale. Reactivul specific este BaCl2, ionul specific este Ba2+, cu care formeaza un precipitat alb cristalin de sulfat de bariu.
SO42- + Ba2+ BaSO4 [7]
In exces de ioni de H2SO4 identificarea cu ionul Ba2+ nu are loc caci precipitatul format se dizolva sub forma sulfatului acid de bariu Ba(H SO4)2.
Ionii de azotit NO2 provin prin disocierea azotitilor in apa. Identificarea lor se bazeaza pe oxidarea KI la iod liber (I2) de catre ionii NO2- in mediu acid, reactie insotita de colorarea apei de analizat in brun.
Apa de analizat de aciduleaza cu cateva picaturi de HCl si apoi se trateaza cu cateva picaturi de reactiv specific (KI). In cazul existentei anionului NO2-, solutia se coloreaza in brun datorita iodului eliberat di reactie:
2NO2 + 2KI + 4HCl I2 + 2NO + 4Cl- + 2K+ + 2H2O [8]
Prezenta iodului este si mai bine evidentiata daca dupa reactie se adauga cateva picaturi de tetraclorura de carbon (CCl4) care dizolva prin agitare iodul format, colorindu-se in violet.
4.1.3. Identificarea substantelor organice.
Prezenta substantelor organice in apa se pune in evidenta printr-o metoda indirecta, bazata pe actiunea lor reducatoare asupra permanganatului de potasiu in mediu acid:
2KMnO4 + 3H2SO4 K2 SO4 + 2MnSO4 + 3H2O + 5O [9]
Oxigenul atomic rezultat va oxida puternic substanta organica.
Presupunind ca aceasta ar fi acidul oxalic, se va descompune astfel:
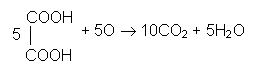
[10]
Daca apa de analizat contine substante organice vor avea loc reactiile mentionate in urma carora ionul MnO4- (permanganic) violet se va transforma in Mn2+ incolor, deci solutia se decoloreaza.
Daca apa de analizat nu contine substante organice, solutia nu-si schimba culoarea violet a ionului permanganic.
Pentru cantitati mici de substante organice este necesar sa se incalzeasca proba de apa de analizat.
4.1.3.1. Aparatura si materiale
Eprubete;
Apa de analizat;
Sticle picuratoare cu reactivi specifici;
Hartie indicatoare de pH.
4.1.3.2. Efectuarea determinarii
In eprubete se introduc 2-3 ml apa de analizat si cateva picaturi din solutia reactivului specific. In cazul existentei ionului cautat, se va produce o reactie usor de recunoscut.
4.1.3.3. Inregistrarea rezultatelor
Datele analizei calitative a apei se trec in tabelul 4.1.
Tabelul 4.1.
|
Ionul cautat |
Reactivul specific |
Reactia de identificare |
Prezenta ionnului |
4.1.4. Determinarea pH-ului apei
Ph-ul apelor variaza putin fata de ph-ul neutru datorita prezentei CO2 ,bicarbonatilor si carbonatilor.apele dure au ph-ul mai ridicat comparativ cu apele moi.ph-ul apelor rezidualepoate fi acid sau alcalin si constituie o cauza a perturbarii echilibrului biologic al bazinului receptor, impiedicand desfasurarea normala a procesului de autopurificare. Pentru determinarea ph-ului apei se folosesc metode colorimetrice sielectrorimetice.
Apa poate avea un pH acid din cauza acizilor minerali sau organici prezenti ca atare in apa sau din cauza hidrolizei acide a sarurilor provenite din acizi tari si baze slabe.
PH-ul alcalin al unor ape se explica prin prezenta hidroxizilor alcalini si alcalino-pamantosi sau a sarurilor cu hidroliza alcalina, provenite din acizi slabi si baze tari.
Determinarea experimentala se poate face cu hartie indicatoare (lucrarea 3) sau cu pH-metrul.
4.2. Analiza cantitativa a apei.
Duritatea apei este data de prezenta tuturor cationilor din apa in afara de cationii metalelor alcaline. Deoarece ionii de calciu si magneziu se gasesc in apa in cantitate mult mai mare fata de ceilalti cationi, determinarea duritatii va consta din determinarea concentratiei acestor ioni. Apele dure sunt neplacute la gust; la fierberea apei sarurile in exces se depun pe vase, cazane, conducte si/sau impiedica o buna fierbere a legumelor; cu sapunul dau saruri insolubile fiind neeconomice. Apele moi sunt incriminate de producerea unor afectiuni cardio-vasculare.
Duritatea apei este de doua feluri: duritate temporara sau carbonata, data de bicarbonatii de calciu si magneziu prezenti in apa si duritatea permanenta sau necarbonata data de celelalte saruri de calciu si magneziu (azotati, sulfati, cloruri, fosfati etc).
Suma celor doua duritati formeaza duritatea totala . Duritatea excesiva a apei are implicatii de ordin economic.
Conventional , duritatea se exprima in grade de duritate care pot fi grade germane (1 grad = 10 mg CaO) sau grade franceze (1 grad = 10 mg CaCO3). La noi in tara,exprimarea duritatii se face in grade germane.

Distilator apa - depuneri de sarui
Continutul de saruri de Ca2+ si de Mg2+ din apa formeaza duritatea totala a acesteia. Duritatea totala DT se compune din duritatea temporara (Dt) si duritatea permanenta (Dp):
DT = Dt + Dp [11]
Duritatea temporara sau alcalinitatea apei este data de carbonatii acizi de calciu si de magneziu din apa, saruri nestabile termic care se descompun prin fierberea apei in carbonati greu solubili. Acestia formeaza depunerile de crusta pe peretii instalatiilor din centralele termice.
Ca(HCO3)2 CaCO3 + CO2 + H2O [12]
Mg(HCO3)2 MgCO3 + CO2 + H2O [13]
Duritatea permanenta este data de sarurile de calciu si de magneziu, stabile termic, sulfati (CaSO4, MgSO4) si cloruri (CaCl2, MgCl2).
Duritatea apei se exprima in grade de duritate (Od):
Gradul de duritate francez reprezinta un continut de saruri de calciu si de magneziu echivalent cu 10 mg CaCO3 la 1000 ml apa;
Gradul de duritate german reprezinta continutul de saruri de calciu si de magneziu echivalent cu 10 mg CaO la 1000 ml apa.
In tara noastra se foloseste exprimarea in grade germane si din acest punct de vedere apele se clasifica astfel:
pana la 9Od - ape cu duritate mica;
(9.25) Od - ape cu duritate mijlocie;
mai mare de 25 Od - ape foarte dure;
Duritatea apei se mai poate exprima si in miliechivalenti (milivali) CaO la 1000 ml apa (1 mval CaO = 28 mg CaO).
4.2.1. Determinarea duritatii temporare.
Duritatea temporara a apei se determina titrind un volum de apa, exact masurat, cu solutie de HCl 0,1n in prezenta de metil orange drept indicator.
4.2.1.1. Aparatura si materiale.
Flacoane Erlenmeyer de 250 ml;
Biureta;
Pipeta cu bula de 100 ml;
Stativ si clema pentru biureta;
Metil orange;
Solutie de HCl 0,1n;
Probe de apa de analizat.
4.2.1.2. Efectuarea determinarii.
In biureta se introduce solutie de HCl 0,1n pana la diviziunea 0. Intr-un flacon Erlenmeyer se masoara cu pipeta cu bula 100 ml apa de analizat si se adauga 2-3 picaturi de indicator metil orange. Se titreaza continutul flaconului cu solutie de HCl 0,1n din biureta pana la virajul indicatorului de la galben la portocaliu. Se citeste cu precizie volumul de solutie de Hcl 0,1n folosit la titrare. Se titeaza 2-3 probe de apa.
4.2.1.3. Inregistrarea rezultatelor.
La titrare au loc urmatoarele reactii chimice:
Ca(HCO3)2 + 2HCl CaCl2 + 2CO2 + 2H2O [14]
Mn(HCO3)2 + 2HCl MnCl2 + 2CO2 + 2H2O [15]
Pentru exprimarea duritatii temporare in grade germane se stabileste raportul de combinare a HCl cu CaO pe baza urmatoarei reactii chimice:
2HCl + CaO CaCl2 + H2O [16]
Deci raportul de combinare este: 1 mol HCl (36,5 g) se combina cu a moli CaO (28 g).
Notind cu a numarul de ml de solutie HCl 0,1n folosit la titrarea unei probe de apa si tinind seama de raportul de combinare de mai sus, rezulta:
1 ml solutie HCl 0,1n (36,5 g) ... 2.8 mg CaO
a ml solutie HCl.......... x mg CaO
x = a 2,8 mg CaO
Deci proba de 100 ml apa de analizat are un continut de saruri de calciu si de magneziu echivalent cu a 2,8 mg CaO. In 1000 ml apa continutul acestor saruri va fi echivalent cu 10 a 2,8 mg CaO.
Tinind cont de definitia gradului de duritate german, se poate face urmatorul calcul:
10 mg CaO / 1000 ml apa .......1Od
10 a 2,8 mg CaO / 1000 ml apa .... 1Od
de unde: y = 10 a 2,8 / 10 = a 2,8 Od
Deci duritatea temporara va fi:
Dt = y = a 2,8Od
Rezultatele titrarii celor 2-3 probe de apa de analizat se trec in tabelul 5.2.
4.2.2. Determinarea duritatii totale a apei.
Duritatea totala a apei se determina prin titrare complexometrica, metoda ce se bazeaza pe proprietatea ionilor Ca2+ si Mg2+ din apa de a forma combinatii complexe cu anumite substante. Combinatiile complexe contin un ion sau atom central in jurul caruia sunt legati prin legaturi coordinative mai multi atomi sau molecule simple.
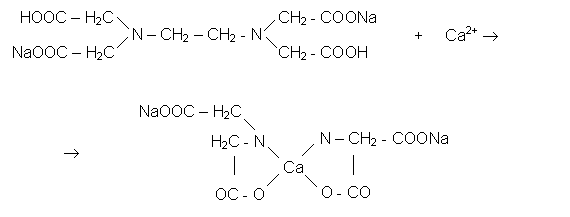 Titrarea complexometrica se
efectueaza cu solutia sarii disodice a acidului etilen
diaminotetraacetic, sare denumita si complexon III. Ca indicator, la
aceasta titrare se foloseste negru eriocrom T. Are loc
urmatoarea reactie:
Titrarea complexometrica se
efectueaza cu solutia sarii disodice a acidului etilen
diaminotetraacetic, sare denumita si complexon III. Ca indicator, la
aceasta titrare se foloseste negru eriocrom T. Are loc
urmatoarea reactie:
4.2.2.1. Aparatura si materiale.
Flacon Erlenmeyer de 250 ml;
Biureta;
Pipeta de 25 si 2 ml;
Stativ si clema pentru biureta;
Solutie de complexon III 0,01n;
Solutie tampon (preparata din NH4Cl si NH3 25% in anumite proportii);
Indicator negru eriocrom T.
4.2.2.2. Efectuarea determinarii.
Din proba de apa care a fost titrata foarte exact cu solutie HCl 0,1n pentru determinarea duritatii temporare, se iau cu pipeta 50 ml si se introduc intr-un flacon Erlenmeyer. Continutul flaconului se fierbe 3-4 minute pentru a elimina CO2 existent in apa. Dupa racirea flaconului in aer si apoi intr-un curent de apa, se introduce un varf de spatula (cca. (0,2-0,3) g) si se adauga 2 ml solutie tampon, pentru realizarea pH-ului 8-10.
Se titreaza imediat continutul flaconului Erlenmeyer cu solutie de complexon III 0,01n din biureta, pana ce culoarea trece de la rosu la albastru. Se citeste exact volumul de solutie utilizat la titrare.
4.2.2.3. Inregistrarea rezultatelor.
Calculul duritatii totale se face cu relatia:
DT
= 2 n 0,561Od ![]()
in care:
n - numarul de ml solutie complexon III folosit la titrarea probei de apa;
0,561 - cantitatea in mg CaO care corespunde la 1 ml solutie complexon.
Rezultatele titrarii a 2-3 probe de apa se trec in tabelul 5.2.
Duritatea permanenta.
Se calculeaza ca diferenta intre duritatea totala si cea temporara:
Dp
= DT - Dt ![]()
Tabelul 4.2.
|
Nr. probei |
Duritate temporara Dt (Od) |
Duritate totala DT (Od) |
Duritate permanenta Dp (Od) |
Categoria apei |
||||
|
Volum proba (ml) |
a ml sol HCl 0,1n |
a 2,8 |
Volum proba (ml) |
x ml solutie complexon |
n 0,561 |
|||
Anexa 4.1.
STAS 790-84: Conditii pentru apa folosita la prepararea mortarelor si betoanelor de ciment.
Sa fie limpede, sa nu contina suspensii organice sau anorganice;
Sa nu aiba gust si miros pronuntat;
Sa corespunda caracteristicilor din tabel:
|
Caracteristica |
Conditii de admisibilitate |
|
Concentratia ionilor de H+, pH | |
|
Continut total de saruri mg / dm3 max. | |
|
Sulfati (SO42-) mg / dm3 max. | |
|
Cloruri (Cl-) mg / dm3 max. | |
|
Carbonati (CO32-) si hidrocarbonati (CO3H-) mg / dm3 max. | |
|
Magneziu Mg2+ mg / dm3 max. | |
|
Alcalii sub forma de Na2O mg / dm3 max. | |
|
Substante organice mg / dm3 max. | |
|
Pierderi la calcinare a substantelor insolubile mg / dm3 max. |
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |