Produsul ionic al apei. Deoarece apa disociaza electrolitic foarte slab, concentratia moleculelor de apa ramasa nedisociata este practic egala cu concentratia initiala, deci aH2O = const. incat ecuatia devine:
![]()
Din aceasta relatie rezulta ca produsul activitatii ionilor H+ si OH-, pentru o temperatura data este o marime constanta (notata cu Kw ) si se numeste produs ionic al apei sau constanta autoprotolitica. La temperatura de 22oC, Kw = 10-14. Este cunoscut ca a = fc, (unde f=factor de activitate, iar c=concentratie molara). In apa pura, factorul de activitate f al ionilor H+ si OH- este egal cu 1, incat activitatile ionilor devin egale cu concentratiile lor molare:
![]() De aceea, constanta
termodinamica de echilibru coincide cu constanta de concentratie:
De aceea, constanta
termodinamica de echilibru coincide cu constanta de concentratie:
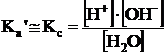 `
`
iar constanta autoprotolitica coincide cu produsul concentratiilor ionilor de hidrogen si hidroxil:
Kw = [H+]·[OH-]
Valoarea numerica a produsului ionic al apei se calculeaza astfel: masa unui litru de apa este 1000 g; un mol de apa = 18 g. Deci, la un litru de apa se afla 1000/18 = 55,56 moli, care reprezinta concentratia molara a apei [H2O] = 55,56 moli/L.
Inlocuind valoarea Ka se obtine:
Kw = [H+]·[OH-]=[H2O]·1,8·10-16=10-14
Pentru ca [H+]
= [OH-] se poate scrie: [H+]·[OH-] = [H+]2
= 10-14 de unde![]() rezulta:
rezulta:
![]()
In solutie acida, exista in permanenta alaturi de H+ si ioni OH- si invers, in solutie bazica, alaturi de ioni OH- exista si ioni H+ atat cat produsul concentratiilor lor la 22oC sa fie egal cu 10-14 ioni g/L.
Astfel, intr-o solutie acida [H+] > 10-7, iar [OH-] < 10-7, intr-o solutie bazica [H+] < 10-7 si [OH-] > 10-7, iar intr-o solutie neutra [H+] = [OH-] = 10-7.
Deoarece acizii si bazele tari sunt total disociate, concentratia in ioni H+ si OH- se poate cunoaste direct din concentratia solutiei de acid sau baza. Astfel, o solutie 1n de acid tare are [H+] = 1; o solutie 0,1n are [H+] = 0,1 etc.
Notiunea de pH. Exprimarea mai comoda si practica a concentratiei in ioni de H+ sau OH- s-a facut logaritmic (S. Sörensen 1909). De exemplu, la o solutie cu [H+] = 10-7, prin inlocuirea puterii (-7) cu pH (exponent, puterea lui 10) se obtine:
[H+] = 10-pH
Prin logaritmare rezulta:
lg[H+] = -pH·lg10 = -pH sau pH = -lg[H+]
Deci, pH-ul este logaritmul zecimal cu semn negativ al concentratiei ionilor de hidrogen. Astfel, solutiile acide au pH < 7, cele bazice pH > 7, cele neutre pH = 7 (punctul 0). Similar, concentratia [OH-] se exprima prin pOH.
Deoarece pH + pOH = 14 o solutie acida cu pH = 3 are pOH = 11 etc.
In figura se prezinta scara pH-ului pentru solutii acide si bazice de concentratii diferite in H+ si OH- exprimate in ioni g/L.
puternic acid ([OH-] = (10-14, 10-13, 10-12, 10-11); [H+] = (1, 10-1, 10-2, 10-3, 10-4); pOH = (14, 13, 12, 11); pH = (0, 1, 2, 3))
slab acid ([OH-] = (10-10, 10-9, 10-8); [H+] = (10-4, 10-5, 10-6); pOH = (10, 9, 8); pH = (4, 5, 6))
neutru ([OH-] = 10-7; [H+] = 10-7; pOH = (7); pH = (7))
slab basic ([OH-] = (10-6, 10-5, 10-4); [H+] = (10-8, 10-9, 10-10); pOH = (6, 5, 4); pH = (8, 9, 10))
puternic basic ([OH-] = (10-3, 10-2, 10-1, 1); [H+] = (10-11, 10-12, 10-13, 10-14); pOH = (3, 2, 1, 0); pH = (11, 12, 13, 14))
Disociatia electrolitica a apei este un fenomen endoterm in care gradul de disociere creste considerabil cu temperatura, conform principiului lui Le Chatelier-Braun.
Determinarea pH-ului se face fie pe cale colorimetrica cu ajutorul indicatorilor, fie pe cale electrometrica cu ajutorul pH-metrelor.
Cunoasterea pH-ului isi gaseste mari aplicatii in cele mai variate procese industriale precum si la procesele metabolice care se petrec in organismele vii.
O importanta deosebita are in agricultura cunoasterea pH-ului solurilor la cultivarea lor si la folosirea rationala a ingrasamintelor, fiind cunoscut ca exista unele plante de cultura care se dezvolta mai bine numai pe soluri slab acide (cartoful, secara etc.), iar altele pe soluri slab bazice (orzul, graul, sfecla de zahar etc). In prelucrarea si conservarea nutretului pentru vite, valoarea optima a pH-ului este hotaratoare pentru evitarea descompunerii substantelor proteice si favorizarea fermentatiei lactice.
Controlul permanent al pH-ului vinurilor permite de asemenea dirijarea fermentatiei malo-lactice care da buchetul vinului si evitarea fermentatiei acetice etc.
|
Politica de confidentialitate |
| Copyright ©
2024 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |