Reducerea in sisteme complexe
In practica siderurgica sunt foarte dese cazurile in care oxizii supusi reducerii nu sunt in stare pura ci sub forma de compusi chimici, solutii acide sau lichide.
Reducerea din compusi chimici
In procesele siderurgice principalii compusi chimici intalniti sunt: (FeO)2SiO2, (MnO)2 SiO2, FeO∙ Cr2O3, MgO∙ Fe2O3, (FeO)3∙ P2O5 etc..
Pentru simplificare se considera ca reducerea are loc in doua etape:
I) (MeO)2SiO2↔ 2MeO + SiO2 disociere ΔG1
II) 2MeO + 2R ↔ 2Me +2RO reducere ΔG2
|
III) (MeO)2SiO2 + 2R ↔ 2Me + SiO2 + 2RO ΔG3 |
Conform legii lui Hess: ΔG3 = ΔG1 + ΔG , dar ΔG3 = ΔH3 - ΔS3∙ T , iar ΔH1 > 0 pentru disociere, deci ΔH3 > ΔH2, iar ΔG3 > ΔG2 ceea ce inseamna ca reducerea din compusi chimici are loc in conditii mai dificile decat din oxizi impuri.
Reducerea oxizilor aflati in solutii nesaturate
In
acest caz ![]() scade (respectiv potentialul de oxigen al oxidului MeO),
pentru care aMeO< 1.
Acest lucru se verifica asupra diagramelor de reducere.
scade (respectiv potentialul de oxigen al oxidului MeO),
pentru care aMeO< 1.
Acest lucru se verifica asupra diagramelor de reducere.
MeO
+ CO = Me + CO2 ![]()
In cazul in care aMe = 1, iar aMeO < 1, sistemul este bivariant (l = 2) deci:
![]() .
.
De asemenea in cazul in care MeO este pur, aMeO = 1, iar 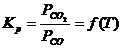 .
.
Egaland relatiile se obtine:
![]()
![]() →
→ ![]() ,
,
dar
pentru ca aMeO < 1 → ![]() respectiv
respectiv ![]() .
.
Rezulta ca un oxid MeO aflat in solutie nesaturata se comporta ca un oxid mai greu reductibil decat in stare libera.
Pe diagrama de echilibru acest lucru se reflecta prin deplasarea in sus a curbelor de echilibru ale reactiilor:
MeO + CO = Me + CO2
Acest lucru se reflecta si la reducerea cu carbon, prin cresterea temperaturii de inceput de reactie, Te (T`e>Te).
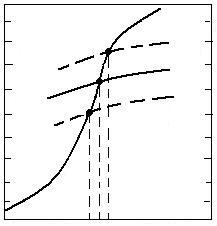 100 0
100 0
80 aMeO<1 20
![]()
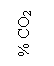 aMeO=1 aMe=1
aMeO=1 aMe=1
60 aMe<1 40
40 60
20 80
0 100
T![]() Te T
Te T![]()
Fig. 3.9. Conditiile de reducere a oxizilor din solutii nesaturate (aMeO < 1) si cand metalul redus trece in
solutie metalica nesaturata (aMe <1).
Reducerea cand metalul redus se dizolva formand solutie nesaturata
Aceasta situatie se intalneste frecvent in siderurgie, la prelucrarea fontei si feroaliajelor, cand diferite elemente reduse (Mn, Si, Cr, V, Ti, P etc) se dizolva in fier formand fonta sau feroaliajele.
MeO + CO = [Me] + CO2
![]() , in acest caz aMeO
= 1, aMe< 1,
, in acest caz aMeO
= 1, aMe< 1,
deci ![]() , dar pentru MeO si Me in stare pura
, dar pentru MeO si Me in stare pura
aMeO
= aMe=1, deci 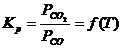 , egalandu-se relatiile rezulta:
, egalandu-se relatiile rezulta:
![]()
![]() sau
sau ![]() ,
,
dar aMe<
1, deci ![]() respectiv
respectiv ![]() .
.
Concluzie: Daca metalul redus trece in solutie nesaturata, reductibilitatea oxidului MeO creste.
Pe diagrama de reducere aceasta se reflecta prin deplasarea in jos a curbelor de echilibru a reactiilor de reducere cu CO.
Temperatura inceperii reactiei de reducere cu carbon se micsoreaza (T`e< Te) si aceasta cu atat mai mult cu cat solutia formata se dilueaza in raport cu metalul redus.
Reducerea in cazul in care metalul redus formeaza un compus chimic
Sub aspect termodinamic acest caz prezinta o complexitate sporita, fiind necesar sa se aiba in vedere numeroase aspecte, o importanta deosebita o are efectul termic al reactiei de formare a compusului chimic, astfel se disting situatiile:
reactia de formare a compusului este exoterma (ΔH < 0) atunci este favorizata reactia de reducere;
reactia de formare a compusului este endoterma (ΔH > 0), pentru formarea compusului chimic, efectul este negativ.
Exemplu
1)
MeO + C = Me + CO ΔH1
![]() 0
0
![]() 2) Me + C = MeC ΔH2
2) Me + C = MeC ΔH2 ![]() 0
0
3) MeO + 2C = MeC + CO ΔH3 = ΔH1 + ΔH2
Daca ΔH1 → 0 si ΔH2 < 0, atunci ΔH3 < ΔH1 si reactia 3 este mai putin endoterma decat reactia 1. Avand in vedere ca ΔG3 = ΔH3 - ΔS3∙T, inseamna ca ΔG3 < ΔG1, adica conditiile de desfasurare a reactiei de reducere cu carbon se imbunatatesc (temperatura de inceput de reactie cu carbonul scade).
Dimpotriva daca ΔH2 > 0, atunci ΔH3 > ΔH1, iar ΔG3 > ΔG1, ceea ce inseamna ca reducerea cu carbon devine mai dificila si temperatura de inceput de reactie creste.
Reducerea cu carbon cu formarea de carburi ale metalului redus decurge dupa reactia generala, prezentata mai jos:
MexOy + (y + n)C [xMe nC] + y CO ; ΔH > 0.
Reactia este intotdeauna endoterma, valoarea lui ΔH depinzand de entalpiile de formare a carburilor si de entalpiile de reducere directa a oxizilor cu obtinerea metalului.
Prezenta carburilor face ca feroaliajul rezultat sa fie carburat, cu exceptia feroaliajelor cu siliciu, motiv pentru care reducerea cu carbon nu poate fi utilizata pentru producerea feroaliajele cu continut scazut de carbon sau a celor fara carbon.
Reactiile de reducere cu carbon avand loc la temperaturi ridicate, rezulta ca procesul se va desfasura cu viteza mai mare si gradul de reducere va fi cu atat mai ridicat cu cat temperatura de lucru va fi mai mare.
Temperatura de lucru nu poate fi insa prea ridicata, deoarece creste consumul de energie, iar la unele elemente cresc pierderile prin vaporizare si durabilitatea captuselii refractare a cuptoarelor se micsoreaza.
De aceea este recomandata temperatura de lucru la care echilibrul intre gradul de reducere, pierderile prin vaporizare, consumul de energie si durabilitatea agregatului conduc la un produs rentabil.
Din figura 3.10 se poate stabili temperatura de inceput de reactie pentru reducerea cu carbon cu formarea compusilor chimici pentru principalii oxizi utilizati in industria feroaliajelor.

ZrO2 DG [J]
50 + 209 275
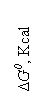 ZrO2
ZrO2
20 TiO2 Zr
10 SiO2 + 41 865
0 ZrC 0
- 10 SiO2 - 41 855
Cr2O3 Ti
Nb2O5
- 30 TrO2 Si
Nb2O5 - 125 565
V2O5
- 50 - 167 420
V2O5 Nb; Cr
WO3 SiC; Cr7C3
- 60 NbC; TiC; V
MoO3
MoO3
- 80 VC
W
WC
- 100 Mo
1700 1800 1900 2000 2100 Mo2C
Temperatura, K
Fig.
3.10. Variatia cu temperatura a entalpiei
libere a reactiilor de reducere cu carbon a oxizilor
Figura 3.10 si tabelul urmator arata ca reducerea cu formare de carbura se produce la temperaturi mai joase decat reactia cu producerea metalului, deci reducerea cu carbon, conduce, in majoritatea cazurilor, la obtinerea feroaliajelor cu carbon ridicat (4.8 %C), cu utilizare limitata.
In tabelul urmator sunt prezentate principalele caracteristici termodinamice ale reactiilor de reducere cu carbon pentru oxizii minereurilor utilizate in siderurgie.
Caracteristicile reactiilor de reducere cu carbon
|
Reactia |
log Kp |
DG in J/cal |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2CaO + 2C = 2Ca + 2CO |
|
|
|
CaO + 3C = CaC2 + CO |
|
- |
|
CoC + C = Co + CO |
|
|
|
2Cr2O3 + 2C = 4CrO + 2CO |
|
|
|
|
|
|
|
|
|
|
|
2CrO + 2C = 2Cr + 2CO |
|
|
|
2CrO+ |
|
|
|
2FeO + 2C = 2Fe + 2CO |
|
|
|
2FeO + |
|
|
|
|
|
|
|
2Mn3O4+2C = 6MnO + 2CO |
|
|
|
2MnO + 2C = 2Mn + 2CO |
|
|
|
2MnO+ |
|
|
|
MoO2 + 2C = Mo + 2CO |
|
|
|
MoO2 +
|
|
|
|
|
|
|
|
2CO |
|
|
|
Nb2O5
+ 2C = |
|
|
|
|
|
|
|
2NiO + 2C = 2Ni +2CO |
|
|
|
|
|
|
|
|
|
|
|
2SiO2 + 2C = 2SiO + 2CO |
|
|
|
SiO2 + 2C = Si + 2CO |
|
|
|
SiO2 + 3C = SiC + 2CO |
|
|
|
2SiO + 2C = 2Si + 2CO |
|
|
|
2SiO + 4C = 2SiC + 2CO |
|
|
|
TiO2 + 2C = Ti + 2CO |
|
|
|
TiO2 + 3C = TiC + 2CO |
|
|
|
2TiO + 2C = 2Ti + 2CO |
|
|
|
2TiO + 4C = 2TiC + 2CO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
WO2 + 2C = W + 2CO |
|
|
|
WO2 + |
|
|
|
|
|
|
|
|
|
|
|
ZrO2 + 2C = Zr + 2CO |
|
|
|
ZrO2 + 3C = Zr + 3CO |
|
|
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Reducerea in sisteme complexe |
| Termeni si conditii |
| Contact |
| Creeaza si tu |