
Tema de proiectare
Se va proiecta o instalatie de fabricatie a azotatului de sodiu prin
neutralizarea carbonatului de sodiu cu acid azotic,
Instalatia va avea o capacitatea de 100 Kg NaNO3/ sarja si va functioa in regim discontinuu.
Tehnologia de fabricatie a ingrasamantului simplu pe baza de azot NaNO3
Cap. 1. Consideratii teoretice asupra azotaului de sodiu ca ingrasamant
Imporanta azotului (N) in agricultura
Azotul intra in compozitia tuturor substantelor de care se leaga, in ultima instanta de orice activitate vitala.
Azotul, este de prima importanta pentru plante, fiind unul din cele mai importante elemente pentru nutritia acestora. O aprovizionare satisfacatoare cu azot favorizeaza o crestere normala, cat si o accelerare a dezvoltarii si matuizarii plantelor, animalelor.
Excesul de azot in raport cu fosforul si potasiul are in cele mai multe cazuri efecte daunatoare, cum ar fi:
Prelungirea vegetatiei
Scaderea rezistentei la ger
Provocarea caderii semintelor(timpuriu)
Inrautatirea calitatii produselor agricole
Carenta azotului este cu totul daunatoare, deoarece duce la orirea cresterii tesuturilorsi fruntzelor, semintelor si fructelor.
Cantitatea de azot variaza cu natura plantei si cu faza de vegetatie a acesteia.
Azotul patrunde prin radacini sub forma ionilor de NH4+, NO3-, NO2-, cat si azotul legat organic sub forma de acizi amidici si amine.
Legumele ocupa o pozitie aparte, pentru ca spre deosebire de celelalte plante, pot sa+si fixeze azotul direct din aer, cu ajutorul bacteriilor simbiotice.
Rolul azotatului de sodiu, NaNO3, ca ingrasamant.
Azotatul de sodiu se utilizeaza:
In cantinati mici ca ingrasamant, iar in afara de acesta, in cantitati ceva mai mari este utilizat in industria alimentara, industria sticlei, in industria metalurgica, etc.
Din punct de veder fiziologic, este un ingrasamant basic si de aceea se utilizeaza pentru soluri acide, pentru neutralizarea solurilor respective.
Are eficienta marita la cultivarea sfeclei de zahar si a sfeclei furajere.
Caracterizare fizico-chimica a azotatului de sodiu NaNO3
Formula NaNO3
Masa atomica 85
Continutul de azot 16,47%
Cristale trigonale
Culoare incolore, transparente
Solubil in apa (solubilitatea creste o data cu cresterea temperaturii)
Densitatea la 200C p20=2265kg/m3
Caldura specifica intre2-550C=0,261 Kcal/kg![]() 0C
0C
Intre320-4300C=0,413
Kcal/kg![]() 0C
0C
Temperatura de topire t=309,50C
Temperature de descompunere t=3800C
Reactia de descompunere:
2NaNO3![]() 2NaNO2+O2
2NaNO2+O2
In stare pura putin higroscopic
1.4. Metode generale de obtinere a azotatului de sodiu, Na NO3
Exemple:
I. Ceam mai simpla metoda este cea bazata pe neutralizarea acidului azotic (HNO3) cu carbonat sau hidroxid de sodiu .
(Na2CO3,
NaOH)![]() Na NO3 obtinut foarte scump
Na NO3 obtinut foarte scump
2HNO3+Na2CO3![]() 2NaNO3+CO2+H2O
2NaNO3+CO2+H2O
HNO3+NaOH![]() NaNO3+H2O
NaNO3+H2O
II. Alta metoda posibila sete obtinerea NaNO3 prin reactia de dublu schimb, conform ecuatiilor:
Ca(NO3)2+Na2CO3![]() CaCO3+2NaNO3
CaCO3+2NaNO3
Ca(NO3)2+Na2SO4![]() CaSO4+2NaNO3
CaSO4+2NaNO3
NH4NO3+NaCl![]() NaNO3+NH4Cl
NaNO3+NH4Cl
2NH4NO3+Na2CO3![]() 2NaNO3+(NH4)2CO3
2NaNO3+(NH4)2CO3
III. Metoda utilizata sa scara industriala, cel mai frecvent este absorbtia oxizilor de azot din gazelle nitroase reziduale in alte solutii alcaline.
Cap.2. ASPECTE TEHNOLOGICE
2.1. Fabricarea azotatului de sodiu, NaNO3 prin neutralizarea acidului azotic cu carbonat sau hidroxid de sodiu.
Chinismul:
2HNO3+Na2CO3![]() 2NaNO3+CO2+H2O
2NaNO3+CO2+H2O
(NaOH)
HNO3+NaOH![]() NaNO3+H2O
NaNO3+H2O
Este o metoda costisitoare, dar sic ea mai simpla
Azotatul de sodiu obtinut prin aceasta metoda este insa mai scump decat cel obtinut prin alte metode.
2.2. Fabricarea azotatului de sodium prin utilizarea metodei de dublu schimd, cum ar fi:
Ca(NO3)2+Na2CO3![]() CaCO3+2NaNO3
CaCO3+2NaNO3
Ca(NO3)2+Na2SO4![]() CaSO4+2NaNO3
CaSO4+2NaNO3
NH4NO3+NaCl![]() NaNO3+NH4Cl
NaNO3+NH4Cl
sau
2NH4NO3+Na2CO3![]() 2NaNO3+(NH4)2CO3
2NaNO3+(NH4)2CO3
Fiecare din metodele bazate pe aceste reactii isi are caracterul sau specific.
Astfel, la utilizarea metodei de dublu schimb dintre azotatul de calciu si sulfatul de sodium, este necesar un exces de azotat de calciu; acesta ramanand in azotatul de sodium produs si creste proprietatile higroscopice ale acestuia. De asemenea, prezenta sulfatului de calciu determina cresterea vascozitatii masei de reactie si pentru imbunatatirea proprietatilor de prelucrare a acesteia este necesara recircularea unei cantitati de solutie. La scara industriala, in Norvegia, se aplica metoda de obtinere a azotatului de sodium prin schimb de cationic, utilizand solutii de azotat de calciu si schimbatori de ioni minerali sau organici, naturali sau sintetici. Schimbatorii de ioni se regenereaza cu solutii de clorura de sodium.
2.3. Metoda utilizata la scara industriala cel mai frecvent este absorbtia oxizilor de azot din gazele nitroase reziduale in solutii alcaline.
In acest mod, creste eficienta instalatiilor de acid azotic prin utilizarea totala a materiei prime si se evita poluarea mediului inconjurator. Prin metoda adsorbtiei alcaline se poate obtine si azotit de sodiu, concomitent cu obtinerea azotatului de sodiu.
Materii prime:
Na2CO3
Gaze nitroase=[NO+NO2+G]
Chinismul: - se realizeaza in 2 etape:
I Adsorbtia alcalina
Na2CO3+N2O3![]() 2NaNO2+CO2
2NaNO2+CO2
Na2CO3+2NO2![]() NaNO2+CO2+NaNO3
NaNO2+CO2+NaNO3
II Insertia:
NaNO2+HNO3![]() NaNO3+NO+H2O
NaNO3+NO+H2O
Ecuatii caracteristice:
I Adsorbtia:
[Na2CO3+H2O]l+[NO+NO2+G]g![]() [ NaNO3+ NaNO2+ Na2CO3+H2O]l+[CO2+GN+H2O]g
[ NaNO3+ NaNO2+ Na2CO3+H2O]l+[CO2+GN+H2O]g
Structura procesului:
Este proces
de tip ![]() a.m.
a.m.![]() r. chimica
r. chimica
![]()
![]()
![]()
![]() T[NO+ NO2]g
T[NO+ NO2]g![]() Abs[NO+ NO2]
Abs[NO+ NO2]![]() T[NO+ NO2]g
T[NO+ NO2]g![]() a.m. r. chimica descomp CO2
a.m. r. chimica descomp CO2
![]()
![]() T Na2CO3
T Na2CO3
II Inversie:
![]() [
NaNO3+ NaNO2+ Na2CO3+H2O]l+[
HNO3+ H2O]l [ NaNO3+ H2O]l+[NO+G]g
[
NaNO3+ NaNO2+ Na2CO3+H2O]l+[
HNO3+ H2O]l [ NaNO3+ H2O]l+[NO+G]g
![]() Structura
procesului este de tip: amestecare moleculara r. chimica
Structura
procesului este de tip: amestecare moleculara r. chimica
![]()
![]() ---
T[HNO3]l
---
T[HNO3]l
![]()
![]()
![]() a.m. r. chimca Des. NO
a.m. r. chimca Des. NO
![]() ---
T[NaNO2]l
---
T[NaNO2]l
Fluxul Tehnologic:
Sol. Na2NO3

Gaze nit
gaze
nitroase reziduale
![]()
Exces
Sol HNO3 (NaNO2+NaNO3)aq
Gaze nitroase reziduale
NH3 (NaNO3/ HNO3 exces)aq
In prelucrarea solutiei intra o serie de procese:
-concentrare-cristalizare-flitrare-uscare
Instalatia tehnologica:
Ustensile si aparate constructive:
1,4,7,9-rezervoare
2,3-coloane de absorbtie
5-incalzitor
6-filtru presa
8-reactor de inversie
10-evaporator/concentrator
11-cristalizor
12-centrifuga
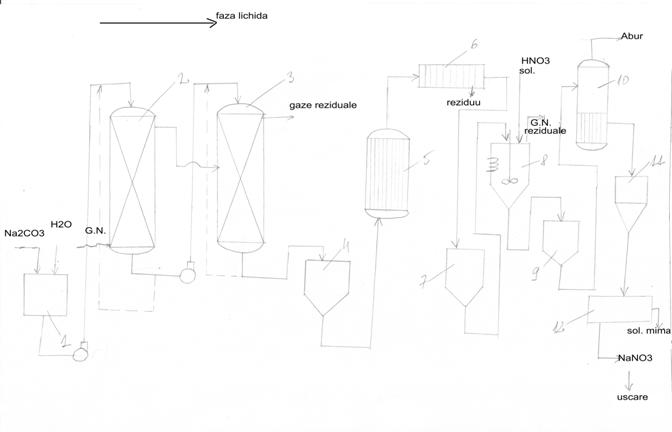 Solutia
Na2CO3 preparatadin rezervorul 1 se alimentaza pe la
partea superioara a absorberelor in contracurent cu gazele nitroase(GN).
Solutia
Na2CO3 preparatadin rezervorul 1 se alimentaza pe la
partea superioara a absorberelor in contracurent cu gazele nitroase(GN).
Faza lichida rezultata din absorbere se recircula pana se atinge gradul de absorbtie dorit.
Faza lichida ce contine NaNO2 (azotit si azotat de sodiu), Na2NO3 este stocat in rezervorul 4, de unde se preancalzeste in 5 si se filtreaza in 6.
Faza lichida (filtratul) din 6 este stocat in rezervorul 7 de unde este dozat la partea superioara a reactorului de inversie 8.
Inversia se produce prin adios de HNO3 la temperature 70-800C. Solutia rezultata din 8 contine in principal NaNO3 si se stocheaza in rezervorul 9.
Din acest rezervor solutia se trimite la o serie de operatii in vederea izolarii produsului(NaNO3):
-concentrare 10- cristalizare 11- prin racier si centrifugare 12.
Cap. 3 Partea experimentala
Sinteza azotatului de sodium la scara de laborator.
Se va sintetiza o cantitate de aprox. 15g NaNO3 , folosind ca materii prime carbonatul de sodiu, Na2CO3 si solutie de acid azotic HNO3 concentrat.
In procesul de sinteza se vor utiliza si mici cantitati de solutie de amoniac concentrata (NH3).
Procesul chimic presupune dizolvarea Na2CO3 in exces de HNO3, urmat de neutralizarea excesului de acud cu amoniac pana la miros persistent de NH3. azotatul de sodiu se va ziola prin cristalizare si uscare.
Excesul de HNO3 folosit la sinteza va fi aprox. 10% fata de cantitatea stoechiometric necesara.
Materiile prime folosite in sinteza de laborator se considera de puritate pa.
NaNO3: M= 12.38g substanta anhidra
S(0C) g/100g solvent=73
S(800C) g/100g solvent=148
S(1000C) g/100g solvent=180
Na2CO3: M=10.6g
S(200C) g/100g solvent=21.5
S(1000C) g/100g solvent=45.5
HNO3: M=0.26g
![]() C=65% p=1.39Kg/m3
C=65% p=1.39Kg/m3
![]() Vol.
HNO3 conc. C=25% p=0.906 Kg/m3
Vol.
HNO3 conc. C=25% p=0.906 Kg/m3
a) Chinismul procesului:
I. Absorbtia
Na2CO3+N2O3![]() NaNO2+CO2
NaNO2+CO2![]()
Na2CO3+2NO2![]() NaNO3+ NaNO2+CO2
NaNO3+ NaNO2+CO2![]()
II. Inversia
NaNO2+2NO2![]() NaNO2+ NO+H2O
NaNO2+ NO+H2O
b) Materii prime:
Na2CO3
Gaze nitroase reziduale
Reactanti: Na2CO3, HNO3, NH3, H2O.
|
Reactant |
MM |
Cantitati(g) |
(mol) |
Obs. |
|
Na2CO3 |
106 |
10.6 |
0.1 | |
|
HNO3(65%) |
63 |
12.6 |
0.26 |
Ceea ce apare in tabel are exces de 10% |
|
NH3 |
17 |
0.26 |
0.015 |
![]()
![]() Calcule:
MNaNO3=85 υ=0.17
moli luam ~ 0.2 moli
Calcule:
MNaNO3=85 υ=0.17
moli luam ~ 0.2 moli
![]() NaNO3 17g NaNO3
NaNO3 17g NaNO3
Msol(25%)=1.04g sol NH3
p= 0.906
m=![]()
Calculul de solubilitate la t0 camerei:
S(200C)=21.5
S=![]()
X=50ml H2O - sunt necesare la dizolvarea Na2CO3
Ustensile de laborator:
Mod de lucru:
La obtinerea a 17g NaNO3 , intr-un pahar Berzelius se dizolva 10,6g Na2CO3 in 50ml apa distilata. Peste solutia rezultata se adauga in picaturi 15 ml HNO3 65%. Se agita constant cu o bagheta de sticla pana se termina efervescenta. Excesul de HNO3 se neutralizeaza cu min. 7ml NH3 conc 25%(miros persistent de amoniac). Solutia obtinuta se pune pe o plita electrica la evaporare sub agitare continua (cu magnet agitataor, portelan poros sau bagheta) pana la o concentrare evidenta a solutiei, dupa care se efectueaza o filtrare la presiune atmosferica, iar apoi racire sub jet de apa si pe urma racire pe baie de ghiata tot timpul sub agitare pana la aproximativ 150C. Apoi se face o filtrare la vid, iar produsul obtinut se lasa la uscat in exicator sau la temperatura camerei.
Analiza produsului finit
Se fac notatiile: m-Masa NaNO3
V-volumul de KmnO4 0.1N
%NO3=f(m;V)
85g NaNO3.......62gNO3-
100g NaNO3.....X g NO3-
X=72.94%
2 NaNO3+2(NH4)2Fe(SO4)2+4H2SO4![]() Fe(SO4)3+2(NH4)2+Na2SO4+2NO2+2H2O
Fe(SO4)3+2(NH4)2+Na2SO4+2NO2+2H2O
-este o reactie redox:
![]() 2Fe2+ -2e- 2Fe3+|1
2Fe2+ -2e- 2Fe3+|1
![]() N5+ +1e- N4+|2
N5+ +1e- N4+|2
![]() 10(NH4)2Fe(SO4)2+8H2SO4+2KMnO4 K2SO4+5Fe(SO4)3+2MnSO4+10(NH4)2+8H2O
10(NH4)2Fe(SO4)2+8H2SO4+2KMnO4 K2SO4+5Fe(SO4)3+2MnSO4+10(NH4)2+8H2O
![]() Mn7+ +5e- Mn2+|2
Mn7+ +5e- Mn2+|2
![]() 2Fe2+-2e- 2Fe3+|5
2Fe2+-2e- 2Fe3+|5
Calcularea Eg
Eg=![]()
![]() NaNO3:
N5+ +1e- N4+
NaNO3:
N5+ +1e- N4+
Eg![]()
(NH4)2Fe(SO4)3:
Eg=![]()
KMnO4: Eg=![]()
X 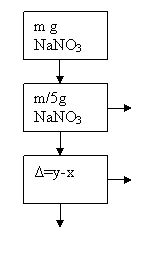 NaNO3
NaNO3
![]() +25ml
sare Mohr 0,1N y E Mohr
+25ml
sare Mohr 0,1N y E Mohr
EMohr exces(Z)
Titrare KMnO4 0.1N(V-ml)
Titrarea cu KMnO4 se face pentru a consuma excesul de sare Mohr
0,1 Eg.....1000ml
Z ..... Vml
Z=10-4![]()
![]() V
V![]() E KMnO4=9
E KMnO4=9![]() 10-5
10-5
25 ml Mohr 0.1N![]()
![]()
0.1.....1000ml
Y .....25 ml
Y=25![]() 10-4EMohr
10-4EMohr
m/5g......x
85g.....1Eg
x=![]()
![]()
![]()
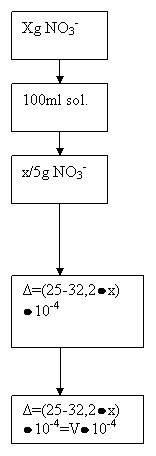
mg Proba
dil.
Proba 20 ml
342![]() 10-4
10-4
+25ml sol.Mohr 0,1N
25![]() 10-4EMohr Total
10-4EMohr Total
- echivalent Mohr exces
+ V[ml]=0.9ml
V![]() 10-4EKmnO4
10-4EKmnO4
X=![]() care se gasesc in mg proba
care se gasesc in mg proba
1g......0,74g
100.......x
%NO3=![]()
Concluzie cu privire la % NO3-
S-a format prea mult acid, in acest caz pentru un % mai real se recomanda o recristalizare.
Calculul % NO3 ideal se presupune o proba 100%
NaNO3![]() %NO3=72.94
%NO3=72.94
Elaborarea modelului matematic de bilant
10,6g Na2CO3 (0,1 mol)
15 ml HNO3 65% p=1,39g/cm3
10 ml sol NH3 25% P=0.906g/cm3
50m H2O
Luam in calcul un randament η=60%
|
Substanta |
Materii Intrate |
Materii Iesite |
||||||
|
Sinteza |
Industrial |
Sinteza |
Industrial |
|||||
|
[g] |
[moli] |
[kg] |
[kmoli] |
[g] |
[moli] |
[kg] |
[kmoli] |
|
|
Na2NO3 |
10.6 |
0.1 |
103.92 |
0.98 |
4.2 |
0.03 |
41.17 |
0.38 |
|
Exces HNO3 |
13.6 |
0.26 |
133.3 |
2.11 |
6.3 |
0.1 |
61.76 |
0.98 |
|
H2O(acid) |
7.3 |
0.4 |
71.56 |
3.97 |
7.3 |
0.4 |
71.56 |
3.97 |
|
H2O(solv.) |
50 |
2.77 |
490.19 |
27.23 |
50 |
2.77 |
490.19 |
27.23 |
|
H2O(react) |
- |
- |
- |
- |
1.1 |
0.06 |
10.78 |
0.59 |
|
NaNO3 |
- |
- |
- |
- |
10.2 |
0.12 |
100 |
1.17 |
|
CO2 |
- |
- |
- |
- |
2.6 |
0.05 |
25.49 |
0.57 |
|
TOTAL |
81.5 |
3.53 |
800.97 |
34.29 |
81.5 |
3.53 |
800.95 |
34.28 |
p= ![]()
p=![]()
Cs=![]() md=13.55g HNO3
md=13.55g HNO3
Η=60%![]() Cp=
Cp=![]()
6,4g 60% 2![]() 0,06
0,06
Na2CO3+2HNO3![]() 2NaNO3+CO2+H2O
2NaNO3+CO2+H2O
106 x y
![]()
0.12moli HNO3 consumati Δ=0.1moli HNO3=6,3g HNO3
13,6g HNO3![]() 0,22 moli HNO3
0,22 moli HNO3
0.12![]() 85=10.2gNaNO3
85=10.2gNaNO3
Mecanismul macrocinetic
Materii prime: carbonatul de sodiu-solutie
acidul azotic-solutie
Ecuatiile Caracteristice:
-mai intai ecuatia reactiei chimice:
![]() Na2CO3+HNO3 NaNO3+CO2
Na2CO3+HNO3 NaNO3+CO2![]() +H2O
+H2O
![]()
![]()
![]()
Aq. Aq. Aq. (g)
![]() [Na2CO3+H2O]l+[HNO3+H2O]l [NaNO3+HNO3+Na2CO3+H2O]l+[CO2+H2O]g
[Na2CO3+H2O]l+[HNO3+H2O]l [NaNO3+HNO3+Na2CO3+H2O]l+[CO2+H2O]g
avem in exces HNO3 si trebuie neutralizat cu amoniac 25% solutie:
![]() NH3(aq)+HNO3(aq) NH4NO3(aq)
NH3(aq)+HNO3(aq) NH4NO3(aq)
![]() [NaNO3+HNO3+Na2CO3+H2O]l+[NH3+H2O]l [NaNO3+NH4NO3+Na2CO3+H2O]l+
[NaNO3+HNO3+Na2CO3+H2O]l+[NH3+H2O]l [NaNO3+NH4NO3+Na2CO3+H2O]l+
[NH3+H2O]g
Structura procesului:
avem un proces tip: amestecare moleculara ![]() reactie chimica (am.
reactie chimica (am.![]() r.ch.)
r.ch.)
![]()
![]() f.c.g. TCO2(g)
f.c.g. TCO2(g)
![]()
![]()
![]()
TNa2CO3(l)![]() -
THNO3(l)
-
THNO3(l)![]()
![]() a.m.
a.m.![]() r.ch.
r.ch. ![]() a.m.
a.m.![]() r.ch.2
r.ch.2
THNO3(l) ![]() -
TNH3(l)
-
TNH3(l) ![]()
3.5. Fluxul tehnologic:
Na2CO3 anh
![]()
![]()
apa
sol HNO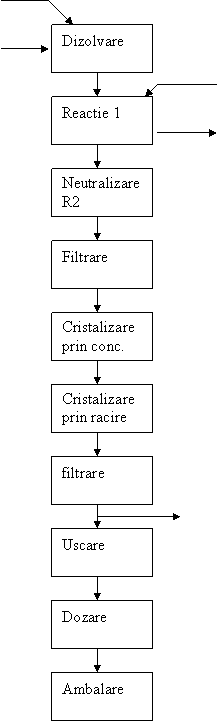 3
exces 65%
3
exces 65%
CO2
se elimina
vap.de apa
NaNO3 umed
Instalatia tehnologica:
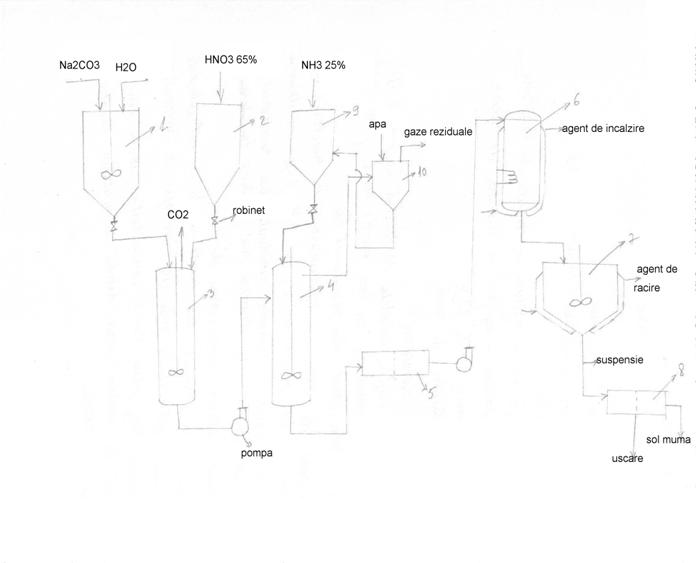
Componentele instalatiei:
1- vas de dizolvare
2- rezervor HNO3 65%
3- reactor cu agitare
4- reactor cu agitare(neutralizare)
5,8- filtre
6- evaporator+agitator+manta de incalzire
7- cristalizator+agitator+manta de racire
9- rezervor NH3 25%
10- spalator de gaze
Descrierea instalatiei:
Mai intai Na2CO3 anhidru se dizolva in vasul 1, apoi in reactorul 3 are loc reactia nr1, iar HNO3 65% este dozat din rezervorul 2
Excesul de HNO3 se neutralizeaza in reactorul 4 unde are loc reactia nr2, iar NH3 25% se dozeaza din rezervorul 9. Gazele reziduale din reactorul 3 se elimina in aer deoarece nu prezinta toxicitate marita, fiind vorba de CO2.
Gazele ce se elimina din reactorul 4 sunt colectate intr-un spalator de gaze 10, iar apoi se recircula solutia NH3 pana la o concentratie dorita sau pana la neutralizarea totala a acidului azotic aflat in exces.
Solutia de NaNO3 rezultata dupa neutralizare este supusa unei concentrari prin evaporare in 6 la 115-1200C, apoi este supusa racirii la 40-500C in cristalizatorul 7, pt. cristalizarea azotatului de sodiu. Prin centrifugare se elimina 5% din umiditatea suspensiei de azotat de sodiu.
Uscarea se realizeaza cu condens cald si aer, praful
antrenat fiind separat prin filtrarea aerului.
Bibliografie
![]() Calistru - "Tehnologia sarurilor minerale"
Calistru - "Tehnologia sarurilor minerale"
-pag 210-228 si pagina 16 pentru importanta N
![]() Handbook - pag 147-148
Handbook - pag 147-148
Autor: Monica Venter
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |