Introducere
Rectocolita ulcero-hemoragica este o boala inflamatorie nespecifica, cu caracter ulcerativ-purulent, localizata de preferinta in regiunea rectosigmoidiana, dar care poate sa cuprinda colonul in intregime. Aceasta afectiune este cunoscuta si sub alte denumiri: rectocolita ulcerohemoragica, rectocolita ulcerativa grava. Varsta la care apare cel mai frecvent se situeaza intre 24 - 45 de ani, dar poate sa survina si inainte de 20 sau peste 50 de ani.
Etiopatogenia rectocolitei ulcerative este inca necunoscuta. S-au facut numeroase studii, dar incercarile de a-i gasi o etiologie bacteriana, alergica, imunitara sau enzimatica au ramas neconfirmate. Desi nu exista certitudine, se admite ca unii factori ca cel genetic, infectios, enzimatic, psihosomatic si imunologic, pot interveni in instalarea si dezvoltarea bolii.
Exista trei ipoteze etiopatogenice majore in ceea ce priveste factorii antigenici initiatori ai raspunsului inflamator intestinal. O multime de microorganisme au fost studiate in relatie cu aceasta ipoteza, singurele date relevante fiind legate de Mycobacterium paratuberculosis, paramixovirusuri (virusul rujeolic) si Listeria monocytogenes. O a doua ipoteza etiopatogenica postuleaza un raspuns imunologic anormal, viguros si prelungit, indreptat impotriva unor antigene ubicuitare luminale. A treia ipoteza etiopatogenica sustine ca initiatorul antigenic este reprezentat de antigene proprii situate la nivelul epiteliului intestinal, aceasta fiind ipoteza autoimuna.
O serie de mecanisme defensive
mucozale contrabalanseaza atacul imunologic inflamator complex la nivelul
mucoasei intestinale: integritatea epiteliala asigurata de peptidele
"trifoide" si diferiti factori de crestere (TGF), productia
IgA, eliberarea de cytokine anti-inflamatorii (IL-4, IL-1, IL-1RA), peptide
intestinale (
S-au efectuat numeroase studii care au analizat aceste citokine pe specimene de mucoasa obtinute prin biopsie de la pacientii cu boala Crohn si colita ulcerativa prin testul ELISA si hibridizare in situ. Chiar daca se considera ca productia crescuta de citokine proinflamatorii in RCUH este cruciala pentru initierea si perpetuarea inflamatiei cronice intestinale, elementele care reglementeaza aceasta dereglare a productiei de citokine au ramas neclare.Transductia semnalelor citokinelor determina in mare masura impactul final al acestora pe genele lor tinta. Aceste noi descoperiri au deschis cai noi si promitatoare pentru un tratament mai specific al inflamatiei intestinale cronice. TNF blocantele sunt agenti biologici care vizeaza in mod specific aceste citokine cheie in procesul inflamator si au devenit un sprijin in terapia bolilor inflamatorii intestinale.
Infliximab este un anticorp monoclonal himeric compus dintr-o regiune IgG1 umana constanta si o regiune variabila. Infliximab a fost asociat cu o reducere de internari si interventii chirurgicale. Certolizumab Pegol este un fragment pegilat, monoclonal umanizat anti-TNF. Ambele Adalimumab si Certolizumab pegol sunt administrate prin injectare subcutanata.
I. Partea generala
Rectocolita ulcerohemoragica
Definitie
Termenul de boala inflamatorie intestinala este o denumire generica a doua entitati care au ca si caracteristica inflamatia peretelui intestinal, net distincte de celelalte boli entero-colonice, cu etiologie neprecizata si evolutie cronica. Este vorba de rectocolita ulcero-hemoragica (RCUH) si de boala Crohn (BC).
Rectocolita ulcerohemoragica reprezinta o afectiune inflamatorie cronica idiopatica interesand exclusiv colonul, limitata la mucoasa, grevata de numeroase complicatii intestinale/ extraintestinale.
Diagnosticul pozitiv al celor doua afectiuni se pune pe anamneza, examen obiectiv, analize de laborator, explorari imagistice si mai ales pe endoscopie si examen anatomopatologic. In aproximativ 10% din cazuri diagnosticul diferential intre cele doua afectiuni nu poate fi facut, cazurile fiind definite ca si colite nedeterminate.
Suspiciunea de boala inflamatorie intestinala se ridica la pacientii cu dureri abdominale, diaree, scadere ponderala, inapetenta, formatiuni palpabile abdominal si sindrom inflamator biologic. Atunci cand diareea este insotita de rectoragii, diagnosticul se orienteaza spre rectocolita ulcero-hemoragica.
In formele severe de colita ulcerativa, inflamatia intestinala se extinde la submucoasa, in timp ce in boala Crohn (de asemenea o afectiune inflamatorie de etiologie necunoscuta) inflamatia este transmurala, putandu-se extinde in tesuturile peri-intestinale si ganglionii limfatici sateliti. Inflamatia intestinala debuteaza la nivelul rectului, extinzandu-se centripet catre valva ileo-cecala; este continua (nu exista arii de mucoasa indemna intre leziuni). Spre deosebire de colita ulcerativa, in boala Crohn tractul gastrointestinal este interesat segmentar, discontinuu si aparent aleatoriu.
O forma de tratament curativ in formele severe sau rezistente la terapie este reprezentata de indepartarea organului afectat prin rectocolectomie totala cu colostomie definitiva sau proctocolectomie totala restaurativa cu rezervor ileal.
Epidemiologie
Bolile inflamatorii intestinale sunt
afectiuni ubicuitare. Incidenta si prevalenta acestora recunosc
o ampla varietate geografica: arii geografice cu frecventa
mare (nord - vestul Europei, America de Nord) si arii geografice cu
frecventa mica (sud - estul Europei, Orientul Mijlociu, America
Latina, Africa), gradientul intre aceste arii ajungand pana la de 10 ori.
Incidenta anuala a colitei ulcerative in America si Europa de
Nord este cuprinsa intre
Studiul tendintelor temporale arata ca incidenta colitei ulcerative s-a stabilizat, inregistrandu-se o usoara crestere in ariile cu frecventa mica. Se constata, de asemenea, o crestere a incidentei proctitei ulcero-hemoragice. In ansamblu, studiile epidemiologice asupra tendintelor temporale arata o crestere defazata a incidentei bolilor inflamatorii intestinale in emisfera nordica incepand din 1950, urmata de un platou: cresterea incidentei colitei ulcerative o precede cu aproximativ o decada pe aceea a bolii Crohn.
Un studiu epidemiologic al bolilor inflamatorii intestinale in cadrul persoanelor adulte ce apeleaza la serviciile de asistenta medicala de gastroenterologie a fost efectuat in Romania in anul 2003. Boala Crohn prezinta un varf de incidenta pentru grupa de varsta 20 - 39 ani (54.8% din pacientii nou diagnosticati), in timp ce pentru colita ulcerativa populatia intre 20 si 59 ani pare a fi uniform afectata grupand 74.8% din cazurile noi de boala. Complicatiile intestinale au fost identificate mai frecvent la pacientii cu boala Crohn decat la cei cu colita ulcerativa.
Studiul confirma faptul cǎ Romania este o tara cu o incidenta mica a afectiunilor inflamatorii intestinale idiopatice, fapt ce concorda cu datele citate in literatura pentru sudul Europei. Raportul RCUH:BC =1.91:1, precum si repartitia pe grupe de varsta, concorda, de asemenea, cu datele furnizate de studiile multicentrice la nivel European. Prin incidenta crescuta a complicatiilor si necesitatea interventiilor chirurgicale, boala Crohn pare a evolua mai grav decat colita ulcerativa. Se impune demararea unui Program National de urmarire prospectiva a afectiunilor pentru a identifica tendintele evolutiei naturale a celor doua entitati clinice si impactul lor asupra supravietuirii pacientilor.
Ambele sexe sunt egal afectate, desi in ariile cu frecventa mare se remarca o incidenta cu 30% mai mare la sexul feminin.
Evolutia incidentei in raport cu varsta este bimodala, cu un prim varf intre 15 si 25 de ani si un al doilea, mai mic, intre 55 si 65 de ani. La copil bolile inflamatorii sunt rare, insa la cei sub 15 ani incidenta colitei ulcerative este mai mare decat incidenta bolii Crohn.
Colita ulcerativa si boala Crohn sunt de 2-5 ori mai frecvente la albi decat la populatia afro-americana si de 3-8 ori mai frecvente la evrei, evreii Ashkenazi (est-europeni si americani) fiind mai frecvent afectati decat evreii Sepharzi (cu origine orientala).
Agregarea familiala - istoricul familial pozitiv constituie factorul de risc cel mai bine documentat pentru bolile inflamatorii intestinale; aproximativ 6-37% dintre pacientii cu boli inflamatorii intestinale prezinta un istoric familial pozitiv. Incidenta bolilor inflamatorii intestinale la rudele de gradul I ale pacientilor cu colita ulcerativa sau boala Crohn este de 30-100 de ori mai mare decat in populatia generala. Sunt afectate preponderent rudele de gradul I ale pacientilor afectati. Riscul de a dezvolta aceeasi afectiune este semnificativ mai mare, desi agregarea familiala mixta este intalnita in aproximativ 25% dintre cazuri. Aceste date sunt ipoteza conform careia colita ulcerativa si boala Crohn sunt afectiuni inrudite.
Fumatul este un factor de risc important pentru numeroase boli, este direct raspunzator pentru unele modificari importante ale functiilor unor organe si sisteme ale organismului uman, inclusiv sistemul digestiv. S-a demonstrat faptul ca fumatul are efecte daunatoare asupra fiecarui segment al sistemului digestiv, contribuind la unele dereglari comune, de genul arsurilor gastrice si esofagiene sau a ulcerelor tubului digestiv. De asemenea,fumatul mareste riscul de aparitie al bolilor inflamatorii intestinale cronice.
Bolile inflamatorii intestinale tind sa afecteze grupurile sociale cu statut socioeconomic inalt, persoanele educate. Sedentarismul este un factor de risc care conduce la aparitia mai multor afectiuni. Cu toate ca din punct de vedere medical este indicat sa fie evitate obiceiurile sedendare (statul excesiv la calculator, televizor etc), la ora actuala tot mai multe locuri de munca sunt caracaterizate prin lipsa activitatii fizice.
Bolile inflamatorii intestinale sunt de asemenea favorizate de stres, alimentatie mai putin naturala, saraca in cruditati, evitarea alaptarii la san.
Etiopatogenie
Etiologia colitei ulcerative nu este elucidata inca, aceasta afectiune asociindu-se cu modificari complexe ce intereseaza factori imunologici, genetici si de mediu.
Colita ulcerativa nu este o afectiune clasica genetic transmisibila. Exista o serie de gene implicate in reglarea raspunsului imun susceptibile pentru bolile inflamatorii intestinale: genele complexului major de histocompatibilitate HLA clasa a II-a situate pe cromozomul 6 (colita ulcerativa se asociaza cu haplotipul HLA-DR2 ), genele pentru lantul greu al imunoglobulinelor localizate pe cromozomul 14 si pentru lantul usor al imunoglobulinelor localizate pe cromozomul 2, genele reglatoare ale expresiei complementului localizate pe cromozomii 6, 19, genele ce codifica receptorul antigenic al celulelor T localizate pe cromozomii 7, 14, genele ce codifica imunodeterminanti ca factorul de necroza tumorala TNF, raportul dintre antagonistul receptorului interleukinei 1 si interleukina 1, molecule de adeziune intercelulara.
Au fost identificati o serie de markeri genetici cu valoare predictiva pentru severitatea si extensia inflamatiei colonice in colita ulcerativa: HLA DRB1 si alela 2 a antagonistului pentru receptorul IL1.
Detectarea susceptibilitatii genetice in bolile inflamatorii intestinale este realizata cu ajutorul markerilor subclinici. In predictia susceptibilitatii pentru colita ulcerativa s-a dovedit eficienta punerea in evidenta a anticorpilor antineutrofilici citoplasmatici (ANCA) iar pentru boala Crohn s-a pus in evidenta cresterea permeabilitatii epiteliului intestinal.
Exista doua moduri de distributie intracitoplasmatica a anticorpilor din serul pacientilor cu boala Crohn si colita ulcerativa: pANCA se dispune perinuclear, iar cANCA difuz intracitoplasmatic. Prezenta ANCA in ser nu se coreleaza cu severitatea sau extensia bolii, ANCA fiind un marker subclinic al susceptibilitatii pentru colita ulcerativa, lucru demonstrat prin prezenta in ser la pacientii cu colita ulcerativa si la rudele neafectate. Clinica similara cu colita ulcerativa au si pacientii cu boala Crohn a colonului stang, ANCA pozitivi, completand ideea ca ANCA reprezinta un submarker clinic al inflamatiei colonice.
Bolile inflamatorii intestinale se caracterizeaza din punct de vedere patogenetic prin activarea raspunsului imunologic inflamator la nivelul mucoasei intestinale. Antigenele specifice declanseaza o succesiune de evenimente ce au ca rezultat final inflamatia mucoasei intestinale. Raspunsul inflamator este localizat cu precadere la nivelul tractului intestinal. De aceea factorii antigenici initiatori (trigger) ai inflamatiei intestinale trebuie cautati in lumenul intestinal. Factorii antigenici pot fi antigene de origine microbiana si antigene din dieta. Natura exacta a antigenelor initiatoare nu se cunoaste, iar caracterul cronic recurent al inflamatiei intestinale sugereaza o stimulare antigenica persistenta.
Exista trei ipoteze etiopatogenice majore in ceea ce priveste factorii antigenici initiatori (trigger) ai raspunsului inflamator intestinal.
.Antigenele initiatoare ale inflamatiei intestinale sunt microorganisme patogene specifice neidentificate inca datorita tehnicilor de cultura imperfecte. Prin urmare raspunsul inflamator intestinal este un raspuns imunologic adecvat, dar ineficient si persistent, la un patogen specific.
O multime de microorganisme au fost studiate in relatie cu aceasta ipoteza, singurele date relevante fiind legate de Mycobacterium paratuberculosis, paramixovirusuri (virusul rujeolic) si Listeria monocytogenes. M. paratuberculosis este agentul etiologic al bolii Johne la vite, o enterocolita granulomatoasa similara clinic si histologic bolii Crohn. Acesta a fost izolata din fragmente chirurgicale provenite de la pacientii cu boala Crohn. Introducerea tehnologiei de polimerizare in lant pentru markerul IS900, element genomic specific M. paratuberculosis, a permis identificarea acestuia in aproximativ 76% din fragmentele tisulare provenind de la pacientii cu boala Crohn. De asemenea, antigene specifice virusului rujeolic si L. monocytogenes au fost identificate in leziunile de vasculita granulomatoasa, respectiv in macrofagele adiacente ulcerelor mucozale, in lamina propria si granuloamele de tip sarcoid din boala Crohn.
O a doua ipoteza etiopatogenica postuleaza un raspuns imunologic anormal, viguros si prelungit, indreptat impotriva unor antigene ubicuitare luminale: agenti microbieni nepatogeni sau antigene dietetice comune. La nivelul ileonului distal si colonului, exista in mod normal o cantitate mare de bacterii viabile (109-1012/ml), predominand bacteriile anaerobe, componente bacteriene pro-inflamatorii (lipopolizaharide, polimeri de polizaharide-peptidoglicani, oligopeptide formilate) si antigene dietetice capabile sa activeze sistemul imun intestinal si sa determine leziunea tisulara. La subiectii sanatosi, epiteliul intestinal reprezinta o bariera imunologica intre enormul potential antigenic luminal si celulele imune din lamina propria. Pacientii cu boli inflamatorii intestinale prezinta o susceptibilitate genetica de a dezvolta un raspuns imunologic intens la antigene comensale, microbiene sau dietetice, din lumenul intestinal.
Raspunsul imun este persistent, fiind indreptat impotriva unor constituenti luminali ubicuitari. Acesta este determinat de o serie de anomalii ale imunoreglarii cu substrat genetic. Activitatea sistemului imun este reglata prin existenta unei balante intre moleculele pro- si anti-inflamatorii si interventia celulelor/factorilor imunoreglatori. Cresterea expresiei mediatorilor proinflamatori sau scaderea factorilor imunosupresori si anti-inflamatori determina un raspuns inflamator cronic. O serie de exemple ale imunoreglarii deficitare au fost documentate in inflamatia intestinala. Printre acestea se numara activarea preferentiala a subsetului CD4 (helper/inducer)/CD8 (supresor), cresterea raportului IL-1/IL-1RA.
A treia ipoteza etiopatogenica sustine ca initiatorul antigenic este reprezentat de antigene proprii situate la nivelul epiteliului intestinal, aceasta fiind ipoteza autoimuna.
Pacientul dezvolta un raspuns imunologic adecvat ce este indreptat impotriva unor antigene luminale specifice, microbiene sau din dieta. Exista o asemanare intre antigenele luminale si unele proteine epiteliale ce va indrepta sistemul imun impotriva mucoasei intestinale. Prin urmare, raspunsul imun este directionat specific impotriva celulei epiteliale intestinale care va fi distrusa prin unul dintre mecanismele imunologice efectorii specifice: citotoxicitate directa dependenta de anticorpi sau citotoxicitate mediata celular.(vezi figura 1). Ipoteza autoimuna este sustinuta de prezenta anticorpilor anticolon, imunoglobuline G ce recunosc o proteina cu greutate moleculara 40-kd (P40), in serul pacientilor cu colita ulcerativa. Autoantigenul P40 reprezinta o tropomiozina identificata atat in colon cat si la nivelul tesuturilor extracolonice afectate in RCUH. Detectia specifica a anticorpilor anticolon in RCUH sustine ipoteza autoimuna, insa rolul patogenetic al acestora nu a fost demonstrat.
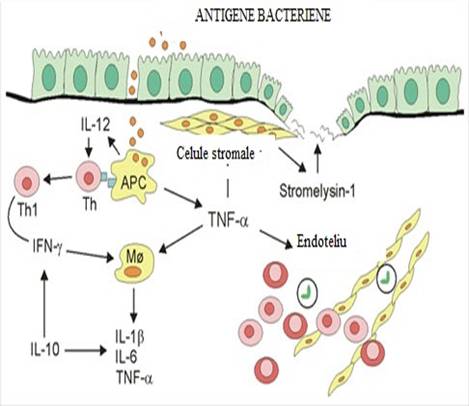
Figura 1: Raspunsul imun in bolile inflamatorii intestinale nespecifice.
Bolile inflamatorii intestinale care includ boala Crohn si rectocolita ulcero-hemoragica, reprezinta un grup de tulburari cronice caracterizate prin inflamatia tractului gastro-intestinal, care de obicei recidiveaza. S-a remarcat o crestere a numarului de monocite si macrofage in mucoasa intestinala inflamata a pacientilor cu aceast tip de afectiune.
Inflamatia intestinala este controlata de o interactiune complexa a mecanismului imunitar innascut si dobandit. Protectia organismului impotriva agentilor infectiosi implica mai multe mecanisme, unele nespecifice (generale, comune pentru mai multe microorganisme) si altele specifice (efectul protector este directionat strict numai catre un singur agent patogen).
Apararea nespecifica este innascuta si include:
- barierele mecanice (integritatea
epidermei si a mucoaselor);
- barierele fizico-chimice (aciditatea sucului gastric);
- substante antibacteriene (imunoglobulinele si lizozimul, prezente in secretiile externe);
- tranzitul intestinal, fluxul secretiilor bronsice si al urinii (contribuie continuu la eliminarea agentilor infectiosi);
- ingestia si distrugerea bacteriilor si particulelor, care au depasit barierele cutaneomucoase de catre granulocite.
Apararea specifica se dezvolta in timpul vietii individului, ca urmare a unui proces secvential deosebit de complex, cunoscut sub numele de raspuns imun.
Raspunsul imun are 2 caracteristici majore: specificitatea si memoria imuna. Specificitatea raspunsului imun este datorata existentei pe suprafata limfocitelor a receptorilor pentru antigen, extrem de sensibili in a sesiza diferentele intre agentii infectiosi. Receptorii pentru antigen ai unui limfocit dat, recunosc un singur antigen sau un numar limitat de structuri similare. Interreactia receptorilor pentru antigen cu structura lui antigenica specifica determina un semnal, capabil sa initieze activarea celulara. Expunerea repetata la acelasi antigen determina un raspuns imun specific, mai rapid, mai intens si mai adecvat. La prima expunere la un antigen, in organism exista un numar redus de limfocite care recunosc si declanseaza raspunsul imun, asigurand eliminarea agresiunii. In urma primului raspuns imun, in organism persista o populatie limfoida specifica mai numeroasa, capabila sa ofere o protectie superioara.
Inflamatia
intestinala caracteristica bolilor inflamatorii intestinale
idiopatice reprezinta rezultatul final al evenimentelor initiate de
antigen. Epiteliul intestinal participa la initierea raspunsului
imun mucosal prin doua mecanisme majore: eliberarea de citokine, chemokine
si alte substante pro-inflamatorii si prin functia de
prezentare a antigenului. Primele celule angajate in secventa
imunologica sunt celulele non-imune cu functie de prelucrare si
prezentare antigenica (antigen-presenting cells-
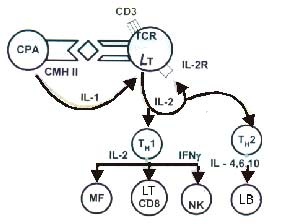
Figura
2 - Interactiunea dintre celula prezentatoare de antigen(
La individul normal,
participarea enterocitelor ca
In timp ce boala Crohn a fost identificata in mod clar ca o inflamatie TH1, patogeneza omologului sau rectocolita ulcero-hemoragica(RCUH) ramane enigmatica. Celulele T ale laminei propria (LPT) de la pacientii cu RCUH produc cantitati semnificativ mai mari de IL-13 (si IL-5) decat celulele de control si putin IFN , in timp ce celulele comparabile de la pacientii cu BC produc cantitati mari de IFN si cantitati mici de IL-13. Stimularea celulelor T din lamina propria pentru RCUH poarta un marker NK (CD161) cu anti-CD2/anti-CD28 sau cu celule B, care exprima CD1d, acestea din urma induc productia substantiala de IL-13. Ambele linii de celule umane nkT, precum si CD161 (+) celule T in RCUH sunt citotoxice pentru celule epiteliale HT-29 si citotoxicitatea este completata de IL-13. Aceste studii arata ca RCUH este asociata cu un raspuns Th2 atipic, mediata de celulele nkT nonclasice producatoare de IL-13 si care au potential citotoxic pentru celulele epiteliale.
Dezechilibrul dintre Th1/Th2 poate juca un rol important in
inflamatia sustinuta din RCUH. S-a
investigat expresia IL-12 (P40) si IFN si starea de activare si de semnalizare a
Celulele
In cadrul reactiei inflamatorii intervin citokine proinflamatorii: IL-1, IL-6, TNFα, IL-8, IFNγ (vezi tabelul 1) sau citokine antiinflamatorii: IL-4, IL-10 (vezi tabelul 2). Citokinele joaca un rol-cheie in bolile inflamatorii digestive, determina diferentierea celulelor T (Th1, Th2), si s-au descris recent celule Th17.
|
Citokine proinflamatorii |
GM (kDa) |
Sursa celulara |
Celule tinta |
Efecte principale |
|
IL 1 α, ß |
Macrofage, Celule somatice |
Celule hematopoietice, Celulele sistemului imun |
Inflamatie reactie febrila, activare limfocite T,B, mediator reactanti faza acuta |
|
|
IL 6 |
Macrofage, limfocite T, celule endoteliale |
Limfocite T, B |
Stimuleaza productia de Ig si plachete |
|
|
IL 8 |
Monocite, neutrofile |
Neutrofile, limfocite T |
Migrarea neutrofilelor |
|
|
IFN γ |
Limfocite Th, macrofage, celule NK |
Limfocite B, T |
Rol in inflamatie, imunomodulator, antiproliferativ, antiviral, inductie MHC clasa I/ II |
|
|
TNF α |
Macrofage, celule somatice, limfocite B, T |
Ubicuitar |
Inflamatie, stimularea imunitatii |
Tabel 1. Citokinele proinflamatorii si rolul lor.
|
Citokine antiinflamatorii |
GM (kDa) |
Sursa celulara |
Celule tinta |
Efecte principale |
|
IL 4 |
Limfocite Th, mastocite |
Limfocite B, T, fibroblasti, monocite |
Factor de crestere hematopoietic si imun, costimulator proliferare limfocite B |
|
|
IL 10 |
Limfocite Th, B, macrofage, keratinocite |
Limfocite B, T, monocite, macrofage |
Rol in proliferarea limfocitelor B si generare anticorpi, inhiba sinteza citokinelor Th dependente |
Tabel 2. Citokinele antiinflamatorii si rolul lor.
Citokinele au ca sursa celulara macrofagele si limfocitele T activate in prezenta bacteriilor, dar si celulele endoteliale, fibroblastii si neutrofilele. Se stabileste o anumita ierarhie intre citokinele participante la raspunsul inflamator: IL-1 si TNFα sunt principalii reprezentanti cu efecte inflamatorii locale si sistemice; stimuleaza productia de IL-6, IL-8.
Interleukina 1 (IL-1) si TNFα mediaza migrarea si activarea locala a celulelor fagocitare si eliberarea mediatorilor lipidici de tipul PGE2, tromboxanului si factorului
activator plachetar (PAF). IL-1 induce si sinteza de IL-8, care este un factor chemotactic extrem de activ pentru neutrofile si monocite, stimuland totodata si eliberarea enzimelor din neutrofile. IL 1 este implicata in raspunsul imun Th1, se exprima mai mult in mucoasa patologica a pacientilor cu RCUH decat in BC, si este semnificativ crescuta fata de mucoasa normala.
Interleukina 4 (IL-4) este o citokina antiinflamatorie prin actiunea ei pe monocite; reduce adezivitatea acestora stimulata prin IL-3 si GM-CSF, scade productia de radicali liberi de oxigen si inhiba secretia de IL-1, IL-8 si TNFα. IL 4 caracterizeaza raspunsul Th2, expresia ei este crescuta in mucoasa normala a pacientilor cu boli inflamatorii intestinale, comparativ cu mucoasa inflamata, acesta fiind probabil un mecanism de protectie.
IL-6 este
o citokina proinflamatorie care s-a dovedit a juca un rol important in
patogeneza bolilor inflamatorii intestinale. Este
implicata in activarea expresiei genelor prin intermediul caii
TGF- , o citokina multifunctionala, este un reglator puternic
negativ al inflamatiei mucoasei in intestin. S-a efectuat un studiu al
carui scop a fost de a determina posibile legaturi intre IL-6
si TGF- . Receptorii TGF- de tip II
sunt predominanti in membrana basolaterala si stimularea
acestora activeaza calea Smad. S-a
demonstrat ca TGF- de tip I induce fosforilarea Smad2
cu Smad-4 si translocarea sa ulterior la nucleu. De asemenea TGF- tip I este
asociat cu o reglare negativa a IL-6 indusa de tirozin- fosforilarea
Transductia semnalelor citokinelor determina in mare
masura impactul final al acestora pe genele lor tinta.
Ambele NF-kappaB si
Interleukina 8 (IL-8) este o citokina importanta pentru recrutarea si activarea neutrofilelor polimorfonucleare (PMN), celule care sunt abundente in leziunile intestinale de RCUH si boala Crohn. Pentru a testa daca exista o diferenta in exprimarea IL-8 intre boala Crohn si colita ulcerativa si pentru a determina sediul principal al sau de sinteza s-a efectuat un studiu care a analizat IL8 pe specimene de mucoasa obtinute prin biopsie de la pacientii cu boala Crohn si colita ulcerativa prin testul ELISA si hibridizare in situ. In urma acestui studiu s-a aratat ca prezenta IL8 in mucoasa s-a corelat semnificativ cu inflamarea macroscopica in boala Crohn (r = 0.47, p <0,001) si in colita ulcerativa (r = 0.60, p <0,001). IL8 ARNm a fost detectat prin hibridizare in situ, in 31 din 55 specimene de biopsie (56%) din pacientii cu boala Crohn, in 38 din 67 specimene ale pacientilor cu colita ulcerativa (57%), in 5 din 8 controale inflamatorii (63%) si in 5 din 38 de controale normale (13%). IL8 ARNm a fost detectat numai in celulele inflamatorii ale interstitiului, dar nu in celulele epiteliale ale mucoasei. IL-8 este produsa in principal in lamina propria a colonului in bolile inflamatorii intestinale si se coreleaza cu inflamatia mucoasei.
Susceptibilitatea genetica este cunoscuta in a juca un rol important in predispozitia la bolile inflamatorii intestinale. IL2/IL21 procesuala activa pe 4q27 este cunoscuta a fi un locus comun, locus de susceptibilitate generala pentru boli inflamatorii (comun cu boala celiaca, diabet de tip 1, artrita reumatoida, lupusul eritematos sistemic si psoriazis).
Interleukina 17f , cu rol in exprimarea celulelor Th17, este un membru nou
al familiei IL-17 de citokine. Avand in vedere asocierea
IL23R cu bolile inflamatorii intestinale s-a studiat rolul IL-17f in RCUH,
inclusiv expresia genelor sale intestinale si efectul polimorfismului
p.His161Arg IL17F asupra susceptibilitatii de boala Crohn si
RCUH. In plus, s-a analizat
polimorfismul p.His161Arg IL17F si variantele NOD2/
IL-10 inhiba productia de citokine proinflamatorii, cum ar fi IL-1, factorul de necroza tumorala alfa (TNF- ), interferon-gamma (IFN ) si IL-6 printr-o actiune inhibitorie asupra celulelor TH1 si macrofagelor si este gandita pentru a fi un tip de citokina supresoare. S-au efectuat studii in care s-au determinat concentratiile serice ale IL-10 la pacientii cu colita ulcerativa (RCUH) si boala Crohn (BC). S-a masurat IL-10 prin testul ELISA folosind anticorpi PharMingen. Nivelurile serice de IL-10 au fost semnificativ crescute la pacientii cu RCUH si BC active comparativ cu martorii sanatosi, in timp ce pacientii cu boala inactiva nu au prezentat nici o crestere semnificativa. Comparand concentratiile serice ale IL-10 cu nivelurile serice ale altor citokine proinflamatorii a existat o corelatie semnificativa a nivelului seric al IL-2R (r = 0.417, p <0,05) si IL-6 (r = 0.387, p <0,05) la pacientii cu BC. Concentratiile plasmatice de citokine la pacientii cu RCUH nu au prezentat nici o corelatie semnificativa cu concentratia in ser de IL-10. IL-10 este crescuta in serul pacientilor cu RCUH si BC active, sugerand ca IL-10 actioneaza ca un amortizor in mod natural in procesul inflamator acut de boli inflamatorii intestinale.
In boala Crohn reactia inflamatorie de la la nivelul tesutului este mediata de celulele TH1, in timp ce in colita ulcerativa predomina un raspuns umoral. Interleukina-12, un puternic inductor al celulelor TH1, este prezenta in biopsiile de mucoasa din boala Crohn, dar nu si in mucoasa din colita ulcerativa. Studiile preliminare indica, de asemenea, faptul ca administrarea unui anticorp monoclonal care blocheaza subunitatea IL-12/p40 poate fi utila pentru a induce si mentine remisia clinica la pacientii cu boala Crohn.S-a studiat si posibilul beneficiul clinic al anticorpilor anti-IL-12/p40 in boala Crohn, ca urmare a neutralizarii activitatii IL-23. Aceasta revizuire ofera informatii curente privind exprimarea si rolul functional al IL-12 si caii de semnalizare asociate IL-12, atat la pacientii cu boala Crohn, dar si pentru modele experimentale de colita ulcerativa, subliniind astfel diferente majore intre IL-12 si IL-23 si rolul lor in inflamatia intestinala(vezi figura 3).
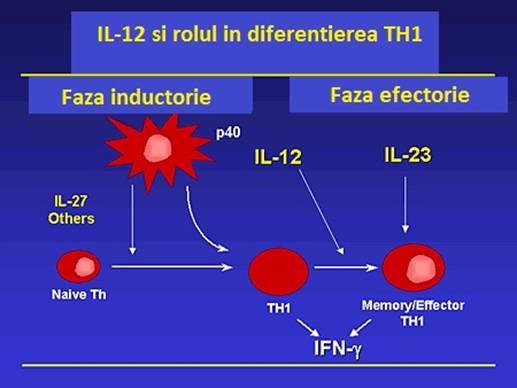
Figura 3 : IL 12 si rolul ei in diferentierea celulelor Th.
IL-15 este produsa de macrofage ca raspuns la stimuli diversi de mediu si agenti infectiosi, este importanta pentru cresterea si diferentierea limfocitelor T si B, celulele NK, macrofage, monocite si activeaza un numar important de molecule intracelulare de semnalizare, inclusiv kinaze si activatori ai transcriptiei. IL-15 si sistemul IL-15R (receptorul IL-15) pot juca un rol important in activarea si diferentierea celulelor B din lamina propria la pacientii cu boli inflamatorii intestinale, mai ales la cei cu RCUH.
TNF reprezinta pivotul cheie in inflamatia intestinala, acesta avand un amplu spectru de efecte pro-inflamatorii. Contribuie la activarea macrofagelor prin mecanism autocrin, iar legarea TNF de suprafata celulara, reprezinta semnalul co-stimulator ce amplifica raspunsul imun mediat de limfocitele T. De asemenea TNF induce expresia moleculelor de adeziune celulara la nivelul endoteliului vascular, permitand influxul de noi celule inflamatorii la nivel mucosal. TNF are si efect procoagulant la nivelul endoteliului vascular si stimuleaza eliberarea locala de oxid nitric, factor activator plachetar si prostaciclina. Efectul de activare al granulocitelor al TNF- se exercita prin:
- inducerea expresiei integrinelor pe suprafata granulocitelor, facilitand prin aceasta atasarea granulocitelor de epiteliu si diapedeza acestora la nivelul mucoasei intestinale;
- activarea acestora in vederea raspunsului prin generarea de radicali superoxid la nivelul granulelor celulare;
- activarea degranularii granulocitelor.
In sfarsit, TNF stimuleaza productia de metaloproteinaze care participa direct la leziunea tisulara locala.
Recrutarea celulelor inflamatorii din circulatia sistemica la nivelul mucoasei intestinale reprezinta o etapa critica pentru amplificarea raspunsului inflamator. Ea se produce printr-un proces coordonat ce implica expresia integrinelor si selectinelor de pe suprafata leucocitelor, moleculelor de adeziune intercelulara (ICAM)-1 si moleculelor de adeziune vascular-celulara (VCAM)-1 exprimate pe suprafata endoteliului vascular. Selectinele de pe suprafata leucocitelor (limfocite, monocite si granulocite) din circulatia sistemica permit atasarea initiala a acestor celule la endoteliul vascular. Ulterior, legarea integrinelor leucocitare de ICAM-1 sau VCAM-1 exprimate pe suprafata celulei endoteliale consolideaza aceasta atasare si permite activarea si diapedeza leucocitara intramucozal. Migrarea ulterioara a leucocitelor in interiorul mucoasei si submucoasei intestinale are loc in virtutea unui gradient al chemokinelor si chemoatractantilor locali, prezenti la nivelul inflamatiei intestinale.
Odata recrutate in inflamatia intestinala, aceste celule elaboreaza si elibereaza numeroase substante pro-inflamatorii nespecifice. Principalii mediatori pro-inflamatori nespecifici implicati in leziunea tisulara sunt reprezentati de tromboxani, prostaglandine, leucotriene, radicali liberi de oxygen (RLO) si oxid nitric. Eliberarea locala de neuropeptide poate modula, de asemenea, raspunsul inflamator intestinal. Atacul persistent al celulelor inflamatorii si mediatorilor solubili ai inflamatiei asupra mucoasei intestinale genereaza leziunea epiteliala, vasodilatatie cu hiperemie, cresterea permeabilitatii intestinale urmata de edem mucosal.
O serie de mecanisme
defensive mucozale contrabalanseaza atacul imunologic inflamator complex
la nivelul mucoasei intestinale: integritatea epiteliala asigurata de
peptidele "trifoide" si diferiti factori de crestere (TGF),
productia IgA, prezenta criptidinelor si perforinelor (proteine
din familia defensinelor cu proprietatea de a crea pori in membrana
externa a microorganismelor, lizandu-le), eliberarea de cytokine
anti-inflamatorii (IL-4, IL-1, IL-1RA), peptide intestinale (
Severitatea raspunsului inflamator depinde de gene care codifica proteine, care reglementeaza productia de citokine. Printre ele, NF Kappa B reglementeaza expresia genelor pro- si anti-inflamatorii. Exista diferite teorii privind mecanismul de actiune al glucocorticosteroizilor la NF Kappa B. Cunoasterea mai exacta a NF Kappa B a permis noi abordari terapeutice pentru bolile inflamatorii si anume transferul primar la celulele epiteliale intestinale de catre un vector - proteina de inhibare a NF Kappa B (adenovirus B mutant kappa I ) si utilizarea locala a oligonucleotidelor antisens P65.
S-au efectuat studii in care s-a investigat distributia genei NOD2/CARD 15 la pacientii cu boli inflamatorii intestinale folosind reactia de polimerizare in lant pentru o secventa specifica sau reactia de polimerizare in lant cu restrictie a unui fragment de polimorfism. Nu s-a observat o crestere a expresiei genei CARD 15 la pacientii cu boala Crohn si la cei cu rectocolita ulcero-hemoragica, dar nici la martori. Se presupune ca gena CARD 15 sa fie implicata in transmiterea ereditara, expresia ei fiind mai crescuta la cei cu rectocolita decat la cei cu boala Crohn prezenta la rudele afectate. In afara de gena CARD15/NOD2, se acumuleaza dovezi despre moleculele implicate in raspunsul imun innascut, cum ar fi receptorii Toll-like 2 (TLR2) care atesta implicarea acestora in patogeneza bolilor inflamatorii intestinale (vezi figura 4).
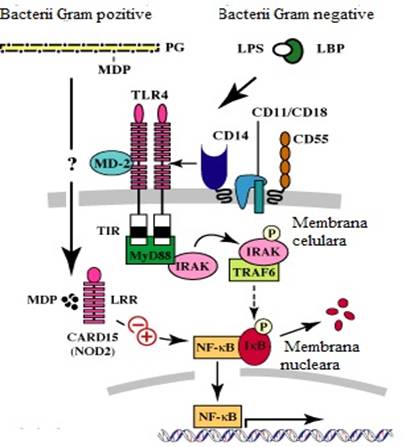
Figura 4: Interrelatia intre gena CARD 15 si receptorul Toll-like (TLR2) si factorul nuclear KB.
Factorul
nuclear (NF) kappa B este un factor de transcriptie care controleaza
transcrierea unui soi de gene celulare de reglementare a raspunsului
inflamator. Multe citokine proinflamatorii
sunt reglate de NF-kappa B si exprimarea lor a fost implicata in
patogeneza bolii inflamatorii intestinale. Chiar daca se
considera ca productia crescuta de citokine proinflamatorii
in RCUH este cruciala pentru initierea si perpetuarea
inflamatiei cronice intestinale, elemente care reglementeaza
aceasta dereglare a productiei de citokine au ramas neclare. O serie de studii recente demonstreaza activarea
NF-kappa B in mucoasa inflamata. Aceste noi desoperiri in activarea si
inhibarea NF-kappa B au deschis cai noi si promitatoare
pentru un tratament mai specific al inflamatiei intestinale cronice.
Scopul acestui studiu a fost de a investiga
daca oligonucleotidele antisens NF-P65 kappaB pot afecta expresia NF-P65
kappaB si celulele mononucleare din lamina propria (LPMC) de la
pacienti cu RCUH. Mononuclearele au fost izolate prin biopsia de
mucoasa intestinala la pacientii cu RCUH, au fost cultivate cu
sau fara NF-P65 kappaB oligonucleotide antisens, oligonucleotide
missense si dexametazona. Expresia NF-P65 kappaB a fost determinata prin analiza
Western blot. Expresia ARNm a fost
studiata prin RT-
Stresul inflamator asociat cu RCUH
si BC afecteaza expresia receptorilor P2Y ARNm pe linia celulara
Caco-2 din adenocarcinomul de colon, celulele necanceroase IEC-6 si tesuturile
din colonul pacientilor ce sufera de boli inflamatorii intestinale. S-a identificat un posibil site de initiere
a transcrierii genei P2Y (2) R si s-a demonstrat acetilarea Lys(14)
pe histone H3 si Lys (8) pe histone
H4, prin urmare sugerand ca asocierea cromatinei cu promotorul P2Y (2)
este accesibila pentru factorii de transcriptie. S-a
aratat de asemenea ca factorul de transcriptie NF-P65 kappaB
regleaza transcrierea P2Y (2) R in conditii bazale si
proinflamatorii. Un raspuns NF-kappaB a fost identificat pe -181 la -172 BP in
regiunea promotor a P2Y (2). Prin urmare, activarea P2Y (2) R de ATP
si UTP stimuleaza expresia ciclooxigenaza-2 si secretia
de
Expresia kinazei Prolina/Alanina
Au fost masurate niveluri de mRNA c-myc in probe de ARN extras din biopsii colonoscopice de la pacienti cu boli inflamatorii intestinale. Biopsiile au fost imediat inghetate in azot lichid limitand timpul de ischemie la mai putin de 15 secunde si putand fi depozitat pana la 96 de ore inainte de separarea de ARN. Aceasta tehnica a aratat ca exista o crestere a raportului dintre starea de echilibru a expresiei proto-oncogenei c-myc in tesutul inflamat la pacientii cu RCUH si BC, comparativ cu o regiune neinflamata de colon. Nu a fost observata nici o diferenta in expresia c-myc in biopsiile de cel putin 30 cm distanta la pacientii de control cu sau fara anomalii macroscopice histologice. Expresia crescuta a c-myc in boala inflamatorie intestinala pare a fi in concordanta cu activarea acestei proto-oncogene de control modificate in timpul ciclului celular care rezulta in urma procesului inflamator.
Recent un polimorfism promotor
-105G> care codeaza selenoproteina S (SELS) a fost dovedit a
creste expresia de citokine proinflamatorii. Prin urmare s-a analizat
expresia SELS si exprimarea fenotipica a polimorfismului -105G> la pacientii cu boli inflamatorii
intestinale. Expresia ARNm a SELS fost masurata prin
reactia polimerizare in lant (
S-au observant anomalii vasculare datorita expresiei factorilor pro-angiogenici in bolile inflamatorii intestinale.
Rolul
trombospondinei-1 (
Dectina-1 este un model de recunoastere a receptorilor (PRR),
exprimata pe celulele mieloide, care recunoaste in mod special β-1,
3 glucan, un polizaharid si o componenta majora a peretelui
celular fungic. La activare, dectina-1 determina semnalizarea, similar cu
NOD2, pe o molecula adaptor
Speciile reactive de oxigen contribuie la prejudiciul adus tesutului in boala inflamatorie
intestinala. Tripeptid glutationul (
Fosfatidilcolina (PC) este un lipid major al stratului de mucus gastro-intestinal. Recent s-a aratat ca mucusul in carzul pacientilor care sufera de colita ulcerativa are niveluri scazute ale PC-ului. Studiile clinice arata ca adaugarea terapeutica a PC la nivelul colonului folosind preparate cu eliberare lenta este benefica. Rolul pozitiv al PC-ul in aceasta boala este inca neclar; cu toate acestea, s-a demonstrat ca PC-ul are o proprietate intrinseca anti-inflamatorie. Nivelele de exprimare a IL-8, ICAM-1, IP-10, MCP-1, TNF si MMP-1 s-au redus in mod semnificativ dupa pre-tratamentul cu PC pentru cel putin doua ore. Efectul a fost comparabil cu inhibarea de catre NF-kB inhibitor al SN 50 si nu a fost din cauza unei scaderi a receptorilor de TNF . PC-ul a fost, de asemenea, eficienta atunci cand este aplicata pe partea apicala, polarizand culturile de celule CaCO-2 in cazul in care au fost stimulate din partea basolaterala. PC-ul induce o inhibare prelungita de TNF indusa de semnale pro-inflamatori. Aceasta inhibitie poate fi cauzata de o schimbare a receptorilor TNF
Morfopatologie
In colita ulcerativa este prezenta o reactie inflamatorie care afecteaza in principal mucoasa colonului. Macroscopic, colonul apare ulcerat, hiperemic si de regula hemoragic. O caracteristica remarcabila a inflamatiei este faptul ca este continua si uniforma, fara intercalarea unor arii de mucoasa normala (vezi figura 5). De obicei este afectat si rectul (95% din cazuri), inflamatia extinzandu-se proximal intr-o maniera continua, dar pe distanta variabila.
Din punct de vedere al severitatii leziunilor, se utilizeaza urmatorul sistem de stadializare, in patru stadii de severitate, conform clasificarii endoscopice a rectocolitei ulcero-hemoragice:
0 - Mucoasa normala
1 - Pierderea patternului vascular normal
2 - Mucoasa granulara nefriabila
3 - Friabilitate la atingere
4 - Sangerare spontana, ulceratie
Atunci cand colonul este interesat in intregime, ileonul terminal poate fi, de asemenea, implicat insa doar pe o lungime de cativa centimetri, afectare numita "ileita in contracurent", ce nu conduce niciodata la ingrosarile si ingustarile caracteristice bolii Crohn.
Celulele superficiale ale mucoasei si epiteliul criptelor sunt implicate intr-o reactie inflamatorie cu infiltrare neutrofilica. Aceasta progreseaza spre lezarea epiteliului cu pierderea a numeroase celule epiteliale, avand drept rezultat formarea de ulceratii multiple. Infiltrarea criptelor cu neutrofile conduce la formarea unor abcese mici ale criptelor, caracteristice (dar nu specifice) si la eventuala distructie a criptelor. Poate aparea, de asemenea, o pierdere de epiteliu la nivelul criptelor, dar si o pierdere de celule caliciforme (producatoare de mucus) si edem submucos. Prin repetarea ciclurilor inflamatorii apare o usoara fibroza submucoasa. Activitatea regenerativa este evidentiata de criptele cu epiteliu neregulat si bifurcatie bazala.
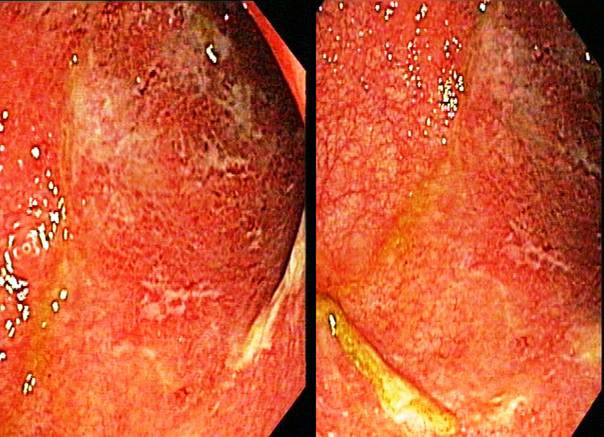
Figura 5: Aspect endoscopic de colita ulcerativa . Se observa o inflamatie uniforma si eritem, ulceratii mici, superficiale
Este important de subliniat faptul ca, spre deosebire de boala Crohn, nu sunt afectate, de regula, si tunicile mai profunde decat submucoasa. In colita ulcerativa severa, asa cum se observa in megacolonul toxic, peretele intestinal poate deveni extrem de subtire si cu mucoasa denudata, iar inflamatia se poate extinde la seroasa, determinand dilatatie si perforatie consecutiva.
Inflamatia recurenta poate conduce la aspecte caracteristice de cronicitate. Fibroza si retractia longitudinala determina scurtarea colonului. Pierderea haustratiilor determina deci aspect radiologic neted, de "teava" al colonului. Insulele de mucoasa regenerata, inconjurate de arii de mucoasa ulcerate si denudata, determina un aspect de "polipi" ce patrund in lumenul colonului. Totusi, acestia au o natura inflamatorie si nu una neoplazica, fiind denumiti, de aceea, pseudopolipi.
In colita ulcerativa cu evolutie prelungita, epiteliul mucoasei poate prezenta modificari displazice. Modificarile de tipul atipiilor nucleare si celulare se presupune ca reprezinta modificari cu caracter de premalignitate care apar dupa evolutii prelungite ale colitei ulcerative.
Displazia marcata, evidentiata la biopsiile de colon ale pacientilor cu colita ulcerativa veche, este asociata cu un risc crescut de coexistenta a unui carcinom de colon localizat in alt segment al colonului si poate influenta decizia efectuarii unei colectomii.
Boala Crohn, spre deosebire de colita ulcerativa, este caracterizata printr-o inflamatie cronica care afecteaza toate tunicile peretelui intestinal, precum si mezenterul si ganglionii limfatici regionali. Indiferent daca este afectat colonul sau intestinul subtire, modificarile anatomopatologice de baza sunt aceleasi.
Modificarile anatomopatologice cele mai precoce in boala Crohn sunt putin descrise, deoarece interventia chirurgicala nu se efectueaza, de electie, in faza precoce a bolii.
La laparotomie, ileonul terminal apare hiperemiat si infiltrat, cu tumefierea si hiperemia mezenterului si a ganglionilor limfatici regionali. In acest stadiu precoce, peretele intestinal, desi edematiat, este de regula suplu. In timp ce un numar de pacienti cu acest tablou initial va dezvolta ulterior enterita regionala, o proportie semnificativa va prezenta o remisiune completa. Aceasta forma acuta de ileita va prezenta, indubitabil, cauze diverse. Intr-adevar, s-a demonstrat ca un numar semnificativ de pacienti cu acest tablou de debut sunt infectati cu Yersinia enterocolitica, un microorganism capabil sa produca o ileita inflamatorie acuta, autolimitata.
Pe masura ce boala progreseaza, aspectul macroscopic devine caracteristic. Intestinul apare foarte ingrosat si tare, cu lumenul ingustat. Aceasta stenoza caracteristica poate aparea in orice regiune a intestinului si poate fi asociata cu grade variate de obstructie intestinala.
Mezenterul apare ingrosat, grasos si se extinde deseori la nivelul suprafetei seroasei intestinale sub forma unor proiectii digitiforme. Aspectul mucoasei este variabil, depinzand de severitatea si stadiul bolii, dar spre deosebire de colita ulcerativa, aspectul mucoasei poate fi relativ normal.
In cazurile mult mai avansate, mucoasa are un aspect nodular, "in pietre de pavaj". Acest aspect rezulta din ingrosarea si ulceratiile mucoasei, avand de regula o distributie liniara de-a lungul axului longitudinal al intestinului subtire, la baza pliurilor mucoasei. Ulceratiile pot penetra in submucoasa si musculara si pot conflua, formand canale intramurale, care se manifesta sub forma de fistule si fisuri.
Exista si alte modificari morfologice care diferentiaza boala Crohn de colita ulcerativa. In boala Crohn, afectarea este, de regula, discontinua; diferitele segmente intestinale afectate sunt separate intre ele prin "zone omise" de intestin aparent normal. In aproximativ 50% din cazurile de boala Crohn a colonului, rectul este crutat. O neta diferenta este afectarea continua a mucoasei si in toate cazurile a rectului, in colita ulcerativa.
In plus, in boala Crohn, procesul inflamator transmural, care afecteaza seroasa si mezenterul, determina si formarea de fistule si abcese. In urma inflamatiei seroasei, ansele intestinale adiacente pot adera printr-o reactie peritoneala fibroasa, formand o masa palpabila, localizata cel mai frecvent in fosa iliaca dreapta. Pot aparea fistule intre ansele intestinale aderente, colon si alte organe adiacente, cum ar fi vezica urinara sau vaginul. Traiectele fistuloase se pot intinde la piele sau se pot termina ca fistule oarbe in peritoneu sau spatiul retroperitoneal, fiind inconjurate de anse aderente de intestin subtire si de tesut inflamator. In colita ulcerativa nu se observa formare de fistule.
Din punct de vedere microscopic, prezenta granuloamelor joaca un rol important in diferentierea bolii Crohn de alte forme de boala inflamatorie intestinala, acestea nefiind prezente in colita ulcerativa. Granuloamele pot fi evidentiate prin biopsii rectale sau colonoscopice. Daca sunt prezente, evidentierea granuloamelor este foarte utila pentru stabilirea diagnosticului, insa caracteristica principala a bolii este inflamatia cronica a tuturor tunicilor peretelui intestinal.
In majoritatea statisticilor privind distributia bolii Crohn, aproximativ 30% afecteaza numai intestinul subtire (de obicei ileonul terminal), 30% afecteaza numai colonul si 40% afecteaza segmentul ileocolic, in special ileonul si colonul drept. La un numar mic de pacienti (in special copii si adolescenti), pot fi prezente ulceratii difuze si extensive ale jejunului si ileonului.
Desi deseori exista suficiente semne care sa permita diferentierea intre colita ulcerativa si boala Crohn, aceasta diferentiere nu este posibila totusi in 10-20% din cazuri.
Tablou clinic
Manifestarile clinice in colita ulcerativa se coreleaza cu severitatea si extensia bolii. Dintre manifestarile clinice caracteristice se numara diareea si hemoragia digestiva inferioara. Alte simptome intestinale frecvent intalnite sunt emisia de exudat mucopurulent, tenesmele rectale si durerea abdominala. Formele severe si extinse ale colitei ulcerative sunt insotite de manifestari sistemice cum ar fi febra, paloare, deshidratare, scadere ponderala, astenie, adinamie, stare generala alterata.
In raport cu severitatea, puseele de activitate colita ulcerativa se clasifica in blande, moderate si severe, iar in raport cu extensia afectiunii se descriu proctite si proctosigmoidite, colite stangi, colite stangi extinse si pancolite.
In raport cu severitatea puseelor de activitate si evolutia afectiunii se descriu 3 forme clinico-evolutive ale colitei ulcerative: forma acuta fulminanta, forma cronica recurenta si forma cronica continua.
Simptomele principale ale colitei ulcerative sunt diareea, hemoragia digestiva inferioara si durerea abdominala,asociind frecvent, in cazurile mai severe, febra si scadere ponderala. In cazurile usoare de boala pot aparea unul sau doua scaune neformate pe zi continand putin sange, fara manifestari sistemice. In schimb, pacientul cu boala severa poate prezenta scaune neformate frecvente, continand sange si puroi, acuzand crampe severe si prezentand simptome si semne de deshidratare, anemie, febra si scadere ponderala.
In cazul unei afectari predominant rectale, constipatia apare mai frecvent decat diareea, iar tenesmele pot constitui acuza principala. Ocazional, simptomele intestinale pot fi mascate de febra, scadere ponderala sau alte manifestari extracolonice ale bolii.
Semnele fizice ale colitei ulcerative sunt de obicei nespecifice; poate fi prezenta o distensie abdominala sau o sensibilitate de-a lungul colonului. In cazurile usoare, examenul fizic general va fi normal.
Manifestarile extracolonice includ artrita, modificari cutanate sau semne de afectare hepatica. Febra, tahicardia si hipotensiunea posturala sunt, de regula, asociate cazurilor mai grave. Examenele de laborator sunt adesea nespecifice si reflecta de regula gradul si severitatea hemoragiei si inflamatiei.
Poate fi prezenta anemia, care reflecta o afectiune cronica, dar si un deficit de fier secundar pierderii cronice de sange. La pacientul cu boala severa, febril, se observa frecvent o leucocitoza cu devierea la stanga a formulei leucocitare, precum si o viteza de sedimentare a hematiilor crescuta.
Anomaliile electrolitice, in special hipopotasemia, reflecta gradul diareei. Hipoalbuminemia apare frecvent in forma severa, fiind de regula secundara pierderii intraluminale de proteine prin mucoasa ulcerata. Un nivel crescut al fosfatazei alkaline poate indica asocierea unei afectari hepatobiliare.
Evolutia clinica a colitei ulcerative este variabila. Majoritatea bolnavilor sufera o recadere in anul care urmeaza primului atac, reflectand natura recurenta a bolii. Pot exista totusi si perioade prelungite de remisiune, cu simptome minime. In general, severitatea simptomelor reflecta extinderea afectarii colonului si intensitatea inflamatiei. Exista, pe de o parte, pacienti care prezinta o afectare limitata a rectului (proctita ulcerativa) sau a rectului si sigmoidului (proctosigmoidita ulcerativa).
Boala este de regula usoara, cu manifestari sistemice sau extracolonice minime, cu toate ca tratamentul proctitei ulcerative poate fi ocazional dificil, prezentand sangerare rectala si tenesme. Simptomele majore sunt sangerarea rectala si tenesmele. Majoritatea acestor pacienti, in special cei cu afectare rectala izolata, nu vor dezvolta o forma severa. La restul pacientilor,boala se poate extinde proximal, afectand o arie variabila de intestin. Este posibil ca 85% din pacientii cu colita ulcerativa sa prezinte o simptomatologie usoara sau moderata de natura intermitenta, care poate fi tratata ambulator. La aproximativ 15% din pacienti, boala prezinta o evolutie fulminanta, afecteaza intregul colon si se manifesta prin diaree cu sange severa si semne si simptome sistemice. Acesti pacienti prezinta riscul dezvoltarii unei dilatatii si perforatii toxice a colonului si reprezinta o urgenta medicala.
Diagnosticul corect al colitei ulcerative trebuie sa cuprinda severitatea puseului de activitate, extensia bolii, forma clinico-evolutiva si complicatiile. Diareea este reprezentata prin scaune de volum redus, numeroase (4-20/24 h), diurne si nocturne. In proctite si proctosigmoidite diareea poate lipsi sau poate fi inlocuita prin constipatie (ca urmare a spasmului rectal).
Inflamatia rectala determina tenesme rectale, senzatie de defecatie imperioasa, proctalgii. Hemoragia digestiva inferioara are caracter variabil in raport cu localizarea si severitatea afectiunii: sange rosu, proaspat, pe suprafata scaunului sau separate de emisia fecala in proctite si proctosigmoidite (caracter pseudo-hemoroidal), sange partial digerat amestecat cu fecalele in formele extinse sau o mixtura de fecale, puroi si sange in formele severe si extinse.
Durerea abdominala intalnita in colita ulcerativa nu este caracteristica. Are caracter de crampa, fiind localizata cel mai frecvent in cadranul stang inferior, fiind accentuata de mese si defecatie.
In ceea ce priveste examenul obiectiv, in colita ulcerativa acesta este normal sau sarac, punand in evidenta durere la palpare in cadranul stang inferior, paloare, tahicardie, deshidratare, denutritie. De asemenea, la semnele intestinale se pot adauga si manifestari extraintestinale specifice cum ar fi artrite, uveite, pioderma gangrenosum etc.
6. Diagnostic pozitiv
Evaluarea
severitatii colitei ulcerative este esentiala pentru
tratamentul afectiunii, formularea corecta a diagnosticului,
aprecierea prognosticului si incadrarea pacientilor in trialuri
terapeutice. In 1955, Truelove si Witts au elaborat un sistem operativ de
clasificare a puseelor de activitate in colitele ulcerative blande, moderate
si severe pe baza unor simptome, semne clinice si constante de
laborator de prima linie (hemoglobina,
Puseul de activitate
sever se caracterizeaza prin: diaree >6/24 h, cu sange in amestec,
febra >37,5°C, minimum 2 din 4 zile, tahicardie sinusala
>90b/min, anemie severa (Hb<7,5 g/dl),
Puseul de activitate
bland are urmatoarele caracteristici: diaree blanda (<4/zi), cu
prezenta inconstanta de sange, in cantitate mica,
fara febra, fara tahicardie, anemie blanda (>9
g hemoglobina/dl),
In raport cu extinderea afectiunii se descriu proctite si proctosigmoidite ulcero-hemoragice (inflamatia intestinala este limitata la rect si sigmoid), colite stangi, colite stangi extinse (limita de demarcatie a inflamatiei colonice este situata la unghiul splenic, respectiv in 1/3 proximala a colonului transvers) si pancolite (intreg colonul este afectat).
In raport cu severitatea puseelor de activitate si evolutia afectiunii se descriu 3 forme clinico-evolutive ale colitei ulcerative: forma acuta fulminanta, caracterizata prin existenta unui singur puseu de activitate severa si durata sub 6 luni, forma cronica recurenta, caracterizata prin pusee de activitate blanda, moderata sau severa, separate prin perioade de remisiune clinica, avand o evolutie de peste 6 luni si forma cronica continua, caracterizata prin pusee blande sau moderate de activitate, fara perioade de remisiune, datand de peste 6 luni.
O alta clasificare a severitatii RCUH a fost propusa de Montreal in tabelul 3 :
|
Severitate |
Definite |
|
S0 Remisiune clinica |
Asimtomatic |
|
S1 RCUH usoara |
Patru sau mai putine scaune pe zi (cu sau fara sange), absenta semnelor sistemice,
si markeri de inflamatie normali ( |
|
S2 RCUH moderata |
Mai mult de patru scaune pe zi dar cu semne minime de toxicitate sistemica |
|
S3 RCUH severa |
Cel putin sase scaune cu sange pe zi, puls de cel putin 90 batai pe minut, temperatura cel putin 37.5°C, hemoglobina cel putin 10.5
g/100 ml, iar |
Tabel 5 : clasificarea RCUH in functie de severitate (Montreal) ;
Diagnosticul corect al colitei ulcerative trebuie sa cuprinda incadrarea severitatii puseului de activitate, extensia bolii, definirea formei clinico-evolutive si notificarea complicatiilor. Diagnosticul trebuie suspectat la toti pacientii care se prezinta cu diaree sau diaree cu sange, infectii perianale persistente si durere abdominala. Apar, de asemenea, si debuturi atipice, cum ar fi febra de origine inexplicabila in absenta manifestarilor intestinale sau cu manifestari extracolonice de tipul artritei sau a afectarii hepatice, care preced sau mascheaza afectarea intestinala. Deoarece boala Crohn poate afecta si intestinul subtire, trebuie luata in considerare in cadrul diagnosticului diferential al tuturor sindroamelor de malabsorbtie, al obstructiilor intestinale intermitente si al fistulelor abdominale.
Examenele de laborator sunt, de regula, nespecifice, reflectand extinderea si severitatea reactiei inflamatorii. In plus, atunci cand boala Crohn afecteaza intestinul subtire, pot fi prezente manifestari ale malabsorbtiei. Poate fi prezenta o anemie de grad variat, rezultata in urma pierderii oculte de sange sau a reactiei inflamatorii cronice a maduvei osoase. La aparitia anemiei pot contribui, de asemenea, malabsorbtia vitaminei B12 si a folatilor. Desi testul Schilling poate fi anormal la pacientii cu afectare ileala extinsa, anemia macrocitara secundara deficitului de vitamina B12 este rara, confirmand eficacitatea absorbtiva crescuta a vitaminei la nivel ileal.
Atunci cand este prezenta o diaree semnificativa, anomaliile electrolitice pot fi semnificative (hipopotasemie, hipomagnezemie). Hipocalcemia poate reflecta o afectare extinsa a mucoasei si malabsorbtia vitaminei D. Hipoalbuminemia poate rezulta in urma malabsorbtiei aminoacizilor, precum si a enteropatiei cu pierdere de proteine. Secundar depletiei de saruri biliare si leziunilor mucoasei pot apare grade diferite de steatoree.
Anomaliile usoare ale markerilor functiei hepatice (in special cresterea nivelului fosfatazei alcaline serice) pot reflecta dezvoltarea unei steatoze hepatice la un pacient malnutrit sau coexistenta unei colangite sclerozante precoce. Icterul semnificativ nu este frecvent.
Reactivitatea serului impotriva neutrofilelor se determina prin metoda ELISA, o procedura de o sensibilitate inalta, urmata de metoda de coloratie prin imunofluorescenta a probelor ANCA pozitive prin metoda ELISA, o procedura mai specifica. Specificitatea este confirmata prin disparitia coloratiei dupa tratamentul neutrofilelor cu DN- aza.
Exista 2 subclase majore ale ANCA, definite prin pattern-ul la coloratia pentru imunofluorescenta indirecta a neutrofilelor:
- pattern difuz granular citoplasmic (c- ANCA);
- pattern perinuclear (p- ANCA).
Anticorpii anti-citoplasma neutrofilica perinucleari pot fi gasiti la 50 - 80 % din pacientii cu RCUH. pANCA sunt pozitivi in 15% din BC si pot caracteriza un subgrup de BC
colonica.
Dozarea anticorpilor anti-Sacharomices cerevisiae-
|
BC(%) |
RCUH(%) |
|
|
Prevalenta pANCA+ | ||
|
Prevalenta | ||
|
Sb. pANCA+ | ||
|
Sp. pANCA+ | ||
|
VPP pANCA+ | ||
|
Sb. | ||
|
Sp. | ||
|
VPP |
Tabel 6 : Reprezentarea procentualǎ a anticorpilor ANCA și ASCA in BC și RCUH;
se noteazǎ Sb= sensibilitate; Sp= specificitate;
Aceasta specificitate inalta si sensibilitate redusa scade valoarea lor in screening si diagnostic, si orice sugestie ca serologia ar putea inlocui endoscopia sau alte metode conventionale de diagnostic este prematura si nerealista. Daca se combina dozarile celor doi autoanticorpi, specificitatea creste foarte mult, in dauna sensibilitati, care scade accentuat.
Atat in RCUH cat si in colangita sclerozanta primitiva (CSP), prevalenta si titrul ANCA nu se coreleaza cu activitatea bolii sau cu extensia. In RCUH, durata mediana a bolii a
fost semnificativ mai mare la pacientii ANCA pozitivi. Fleshner considera ca titrul inalt al pANCA (>100 unit.ELISA/ml) inainte de colectomie reprezinta un factor predictiv pentru dezvoltarea pouchitei cronice.
In studiul lui Quinton si Sendid efectuat in 1997, nu a existat corelatie intre ANCA sau
Sigmoidoscopia si examenele radiologice ale intestinului sunt foarte importante in stabilirea diagnosticului bolilor inflamatorii intestinale. Aspectul mucoasei colonice la examenul colonoscopic este reprezentat de edem, hiperemie si inflamatie cronica a mucoasei care poate fi urmata de segment de intestin neafectatate (vezi figura 6).
Sigmoidoscopia trebuie efectuata la toti pacientii cu diaree cronica si in toate cazurile de sangerare rectala. In timp ce examenele meticuloase prin clisma baritata cu contrast de aer ale unui colon bine pregatit pot evidentia modificarile precoce ale bolii Crohn si colitei ulcerative, examenul conventional prin clisma baritata este de obicei "normal" in stadiile precoce.
Vizualizarea directa a mucoasei colonice, in asociere cu biopsia acesteia, constituie modalitatea cea mai sensibila de determinare a inflamatiei mucoasei rectale. La pacientul cu diaree activa, aceasta poate fi adesea efectuata fara o pregatire anterioara prin clisme.
Scopul sigmoidoscopiei initiale este de a determina daca este prezenta inflamatia mucoasei si nu neaparat de a determina, de la prima examinare, extinderea bolii. Astfel, daca se detecteaza modificari sigmoidoscopice in primii 8-10 cm, nu mai este necesara introducerea instrumentului pe toata lungimea sa, ceea ce ar putea cauza disconfort in cazul inflamatiei intestinale acute. In colita ulcerativa, aspectul cuprinde pierderea vascularizatiei sanguine, eritem difuz, friabilitatea mucoasei si frecvent exsudat alcatuit din mucus, sange si puroi.
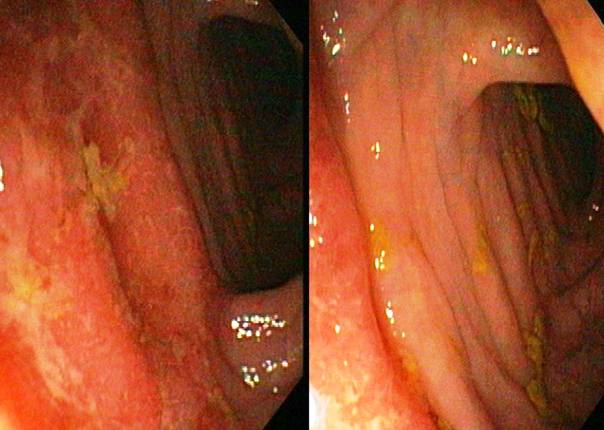
Figura 6: Aspect endoscopic de colita ulcerativa. Se observa edemul, hiperemia si inflamatia cronica a mucoasei. De notat relativ brusca demarcatie dintre segmentul de intestin afectat si mucoasa normala.
Sunt caracteristice friabilitatea mucoasei si afectarea uniforma a mucoasei. O data detectate arii de mucoasa afectata (de regula la nivelul rectului), nu mai exista zone de mucoasa normala pana la atingerea capatului proximal al leziunii. Ulcerele sunt superficiale, pot fi mici sau confluente dar ulceratiile apar invariabil in zonele de colita activa. Examenul colonoscopic complet nu este indicat la pacientul cu colita ulcerativa acuta. Biopsia rectala poate demonstra inflamatia rectala. In cazurile cronice, mucoasa poate prezenta un aspect granulomatos, putand fi prezenti pseudopolipi.
Pentru diagnosticul bolii Crohn a colonului este de valoare si examenul endoscopic al colonului. Cel mai proeminent aspect il constituie ulceratiile, care pot fi eroziuni superficiale aftoide sau fisuri longitudinale profunde. Ele apar de obicei in segmente de mucoasa aparent normale. Deoarece mucoasa nu este afectata uniform, friabilitatea si granulatiile difuze, caracteristice colitei ulcerative, nu caracterizeaza si colita Crohn. In schimb, aspectul de piatra de pavaj, rezultat in urma unor leziuni neregulate ale suprafetei mucoasei, reflecta inflamatia submucoasei si este caracteristic bolii Crohn.
Pseudopolipii, edemul si stenozele pot fi observate atat in colita Crohn, cat si in colita ulcerativa. Biopsiile mucoasei colonice releva granuloame la 30-50% din probele prelevate din ariile afectate. Este compatibila, dar nespecifica, prezenta abceselor criptice, infiltratia cu celule inflamatorii sau ulceratiile.
Deoarece ariile de "omisiune" si crutarea rectului sunt caracteristice bolii Crohn, colonoscopia poate fi superioara sigmoidoscopiei in evaluarea bolii Crohn. Examenul colonoscopic este indicat si atunci cand boala Crohn pare sa afecteze numai intestinul subtire. Biopsiile ileale pot fi utile, iar afectarea colonica concomitenta apare intr-un numar semnificativ de cazuri. Leziunile inflamatorii perianale, ca si ariile de afectare rectala vizualizate la endoscopie, evidentiaza frecvent o inflamatie granulomatoasa.
Biopsiile rectale de la nivelul mucoasei aparent nealterate prezinta si aspecte microscopice de inflamatie granulomatoasa, la 5-15% dintre pacienti.
Investigarea intestinala radiologica furnizeaza informatii importante pentru diagnosticul bolilor inflamatorii intestinale. In colita ulcerativa, clismele baritate pot evidentia extinderea bolii si pot contribui la definirea modificarilor asociate de tipul stenozelor, pseudopolipilor si carcinoamelor. Modificarile cele mai precoce observate in colita ulcerativa sunt iritabilitatea si umplerea incompleta, secundare inflamatiei asociate. Pot fi observate ulceratii fine, serpiginoase, determinand un contur neregulat al intestinului. Ulceratiile pot deveni mai adanci si determina, in evolutiile fulminante de boala, un contur aspru, neregulat. Formatiunile polipoide sunt rezultatul edematierii mucoasei dintre ulceratii. Distributia difuza a ulceratiilor este observata cel mai bine pe filmele de evacuare si cu ajutorul clismelor baritate cu contrast de aer.
In stadiul cronic de boala, aspectele caracteristice sunt scurtarea intestinului, rigiditatea. Intestinul are un aspect simetric, fara haustratii, tubular, cu o estompare a modelului mucoasei. Stenozele nu sunt frecvente, iar atunci cand apar, au un lumen concentric cu margini ce se ingusteaza fuziform. Excentricitatea trebuie sa ridice suspiciunea de carcinom asociat.
Examenul cu clisma baritata la pacientii cu boala Crohn a colonului prezinta aspecte care permit, de regula, diferentierea de colita ulcerativa. Aspectele caracteristice bolii Crohn cuprind crutarea rectului, prezenta zonelor omise si evidentierea de ulceratii mici care apar la nivelul unor noduli mici, neregulati. Frecvent, ulceratiile mici se extind, pentru a forma ulceratii longitudinale si fisuri transverse care, in realitate, sunt tracturi sinusale limitate. Acestea se pot extinde la tesuturile vecine, producand fistule. Ingrosarile neregulate si fibroza pot determina formarea de stenoze, care pot fi multiple. In 10-15% din cazuri, boala poate afecta uniform intreg colonul, facand mai dificila diferentierea de colita ulcerativa. Refluxul bariului in ileonul terminal, pe parcursul clismei baritate, poate evidentia modificari ileale caracteristice enteritei regionale.
Cand boala Crohn afecteaza intestinul subtire, cel mai caracteristic este afectat ileonul terminal, modificarile fiind similare celor de la nivelul colonului. Examenul radiografic atent al intestinului subtire demonstreaza pierderea detaliilor mucoasei si rigiditatea segmentelor afectate, care rezulta secundar edemului submucos sau prezentei stenozelor. Inflamatia submucoasa poate conduce la un aspect caracteristic de piatra de pavaj, al mucoasei, putand fi observate traiecte fistuloase, in special la nivelul zonei ileocecale.
Afectarea stomacului si duodenului determina, de regula, un aspect radiografic de rigiditate si infiltrare a mucoasei, putand mima o tumora infiltrativa. Daca acest aspect este determinat de enterita regionala, aproape intotdeauna exista o afectare concomitenta a jejunului sau ileonului. In boala Crohn, examenul CT abdominal poate fi util in evaluarea anselor intestinale ingrosate, separate, si ajuta la diferentierea unor anse ingrosate, mate (flegmon), de abcesul intraabdominal.
Desi examenele baritate furnizeaza deseori informatii asupra caracteristicilor si intinderii bolii, la pacientul cu colita severa este necesara prudenta in efectuarea acestor investigatii, la care examenul baritat si golirea prealabila a intestinului pot determina agravarea bolii si pot precipita dilatarea toxica a colonului.
Colonoscopia este de mare ajutor in diagnosticul bolilor inflamatorii ale colonului. Astfel, ariile situate dincolo de distanta de investigare a sigmoidoscopului pot fi acum direct vizualizate si biopsiate. In faza de evolutie precoce a inflamatiei colonice, examenul endoscopic si biopsia constituie tehnicile cele mai sensibile pentru demonstrarea afectarii mucoasei. Leziunile polipoide, stenozele si zonele neclare la examenul radiologic pot fi definite, de regula, complet.
Examenele colonoscopice si biopsiile periodice sunt utilizate din ce in ce mai frecvent pentru supravegherea aparitiei cancerului la pacientii cu boli inflamatorii intestinale cu evolutie prelungita.
Diagnostic diferential
In diagnosticul diferential al bolilor inflamatorii intestinale trebuie luate in considerare multe afectiuni. Rationamentul va fi determinat, in mare masura, de manifestarile clinice de debut ale bolii. Atunci cand simptomul de debut este sangerarea rectala, trebuie luata in considerare o sursa colonica. Deoarece frecvent se constata prezenta hemoroizilor, ei trebuie considerati o sursa potentiala de hemoragie, pana la confirmarea prin sigmoidoscopie, colonoscopie si/sau clisma baritata a altor leziuni colonice. Neoplasmele colonice (carcinoame, polipi adenomatosi) se pot manifesta, de asemenea, prin sangerare rectala, putand fi diagnosticate, de regula, prin clisma baritata si biopsie ulterioara sigmoidoscopica sau colonoscopica. Trebuie reamintit faptul ca neoplasmul de colon poate complica colita ulcerativa cu evolutie prelungita. Sangerarea rectala din diverticulii colonici sau malformatiile arteriovenoase nu prezinta, de regula, probleme de diagnostic diferential, deoarece sunt absente modificarile radiologice si endoscopice de boala inflamatorie intestinala.
Proctita de iradiere, care se poate prezenta ca o arie localizata de colita, constituie o descoperire frecventa dupa iradierea pelvina. Totusi, debutul poate aparea la perioade diferite dupa iradiere (luni sau ani). Aspectele caracteristice la sigmoidoscopie cuprind atrofia mucoasei si telangiectazii, precum si friabilitate si mici ulceratii. In sindromul Behcet poate aparea o colita uneori nediferentiabila de colita ulcerativa, asociata cu ulceratii aftoide bucale, uveita si uretrita.
Colita acuta poate fi determinata de o varietate de agenti infectiosi. Manifestandu-se frecvent prin diaree sanguinolenta, colita infectioasa poate fi greu diferentiabila de bolile inflamatorii intestinale la debut, iar cazurile severe pot prezenta o dilatatie toxica a colonului simuland megacolonul toxic. Biopsia rectala in colita infectioasa arata un infiltrat marcat cu polimorfonucleare, un edem pronuntat si crutarea relativa a criptelor, aspecte care o pot diferentia de boala inflamatorie intestinala idiopatica. Trebuie remarcat de asemenea ca o exacerbare neexplicata a simptomelor bolile inflamatorii intestinale se poate datora unei colite infectioase suprapuse. Astfel, in toate cazurile de exacerbare a bolile inflamatorii intestinale, trebuie realizate culturi corespunzatoare pentru a depista o infectie asociata.
Amibiaza poate debuta cu diaree sanguinolenta si poate fi nediferentiabila la sigmoidoscopie de colita ulcerativa idiopatica. Studiile serologice privind amibiaza pot fi utile, cu toate ca titrurile pozitive indica o infectie anterioara, nelocalizata in timp. Deoarece pentru eradicarea infectiei este necesar un tratament amibicid specific iar corticoterapia poate fi nociva, trebuie facute toate eforturile pentru a exclude acest diagnostic la indivizii suspecti, pe baza titrurilor serologice si a examenului atent al secretiilor si biopsiilor colonice.
Dizenteria acuta bacilara poate fi determinata de Shigella si Salmonella sau Campylobacter, toate diagnosticate usor prin coprocultura. Infectia cu Yersinia enterocolitica, ce se poate prezenta ca ileita acuta, poate produce, de asemenea, o colita autolimitata, uneori cu reactie granulomatoasa. Agentii infectiosi pot produce si o proctita acuta nediferentiabila de proctita ulcerativa idiopatica. Astfel de infectii, frecvent intalnite la homosexuali, pot fi determinate de infectia cu virusul herpes simplex, gonoree, limfogranulomatoza veneriana (LGV), infectia cu citomegalovirusuri, Isospora sau Treponema pallidum, ca si de amibiaza. La barbatii homosexuali, colonii non-LGV de Chlamydia produc o proctita granulomatoasa foarte asemanatoare bolii Crohn rectale.
Colita pseudomembranoasa (colita asociata antibioterapiei) este determinata de o toxina necrolitica elaborata de Clostridium difficile care prolifereaza in intestin in anumite conditii. Foarte frecvent, boala apare dupa antibioterapie, care deterioreaza probabil echilibrul ecologic normal al florei intestinale, permitand astfel proliferarea Clostridium difficile. Au fost implicate aproape toate antibioticele, cu toate ca frecventa cazurilor legate de utilizarea de vancomicina sau de aminoglicozide este redusa. De cele mai multe ori diareea este abundenta, apoasa, desi in 5% din cazuri apare si o diaree sanguinolenta. La sigmoidoscopie se evidentiaza leziuni caracteristice, multiple, sub forma unor placi discrete de culoare galbuie, care prezinta la biopsie semne de inflamatie acuta si ulceratie, cu o pseudomembrana de fibrina si material necrotic. Uneori, leziunile pot fi localizate dincolo de zona de accesibilitate a sigmoidoscopului, fiind necesara colonoscopia.
Diagnosticul se obtine cel mai bine prin detectarea toxinei Clostridium difficile in scaun. Tratamentul este directionat initial pe eradicarea Clostridium difficile din scaun.Vancomicina (250 mg po. x 4/zi timp de 7-14 zile) constituie tratamentul de electie pentru pacientii cu boala severa, iar ameliorarea trebuie sa apara in decurs de 5 zile. Deoarece tratamentul cu vancomicina este scump, au fost propuse si tratamente alternative. Utilizarea metronidazolului (500 mg po. x 4/zi timp de 7-14 zile) s-a demonstrat a fi la fel de eficienta ca si a vancomicinei. Bacitracinul (20.000 unitati x 4/zi timp de 7-14 zile) este destul de eficient. Dupa toate formele de terapie s-au observant recaderi (15-30% din cazuri), necesitand reinstituirea antibioterapiei pentru eradicarea microorganismului. Ocazional, cauze infectioase de colita se suprapun peste colita ulcerativa sau boala Crohn nesuspectate. In acest caz, o data ce infectia acuta s-a remis, simptomatologia si modificarile inflamatorii ale mucoasei pot persista, ridicand suspiciunea unei boli inflamatorii intestinale asociate. Situatii similare pot surveni la pacientul cu boala inflamatorie intestinala, care poate dezvolta rareori o colita pseudomembranoasa. Detectarea toxinei Clostridium difficile in scaun si tratamentul consecutiv ajuta la clarificarea acestei situatii.
Colita ischemica poate produce durere abdominala si sangerare rectala, in special la varstnici, putand fi foarte greu de diferentiat de boala inflamatorie intestinala, in special de boala Crohn. Datorita unei circulatii colaterale excelente, rectul este, de regula, neafectat. Aspectele radiologice sunt deseori caracteristice, evidentiind edem sau hemoragie submucoasa ("amprente digitale") care, tipic, dispar spontan in decurs de cateva saptamani.
Precoce in evolutia bolii, boala inflamatorie intestinala poate fi greu de diferentiat de diareea functionala. Prezenta unor simptome constitutionale de tipul extenuarii, febrei, scaderii ponderale, diareei nocturne, in asociatie cu semne de laborator ce indica anemie, viteza de sedimentare a hematiilor crescuta sau prezenta sangelui ocult in scaun, trebuie sa alerteze clinicianul asupra posibilitatii bolile inflamatorii intestinale. Similar, identificarea leucocitelor pe frotiul de scaun colorat sugereaza o cauza inflamatorie a diareei. In toate cazurile, sunt necesare coproculturi si examene parazitologice ale scaunului, pentru a exclude agentii patogeni bacterieni sau amibiaza. In sindromul de colon iritabil, sigmoidoscopia, biopsiile rectale si clisma baritata sunt toate normale.O data stabilit diagnosticul de bolile inflamatorii intestinale, diferentierea intre colita ulcerativa si boala Crohn este, de regula, posibila.
In cazul afectarii intestinului subtire (enterita regionala), diagnosticul diferential trebuie sa aiba in vedere boli care se manifesta prin abcese intraabdominale, fistule, ocluzie intestinala si malabsorbtie. Detectarea unei afectari colonice concomitente la pacientii cu boala ileala ajuta deseori la diferentierea bolii Crohn de alte afectiuni ale ileonului. In cazul unei afectari difuze a jejunului si ileonului, enterita regionala trebuie diferentiata de jejunoileita ulcerativa negranulomatoasa. In aceasta boala, durerea abdominala si diareea constituie manifestari predominante, iar scaderea ponderala, malabsorbtia si hipoproteinemia tind sa fie mult mai marcate decat in enterita regionala. Biopsiile intestinului subtire arata o leziune mult mai difuza cu vilozitati aplatizate (similar celei din sprue celiac), infiltrarea laminei propria si ulceratii mucoase.
Limfomul abdominal poate prezenta de asemenea aspecte radiologice si clinice greu de diferentiat de enterita regionala. Cand sunt prezente, hepatosplenomegalia si adenopatiile periferice reprezinta indicii importante, dar deseori boala este limitata la intestin. In astfel de cazuri, pentru stabilirea diagnosticului histologic definitiv este de obicei necesara laparotomia.
In fazele avansate ale ileitei regionale, cu arii de stenoza si fistule de drenaj, aceasta poate fi confundata, de asemenea si cu infectia fungica intestinala cronica de tipul actinomicozei, aspergilozei si blastomicozei. Aceste infectii sunt frecvent observate la pacientii debilitati, cu sistem imun compromis.
Testele cutanate fungice si examenul lichidului de drenaj al fistulelor si al materialului bioptic pentru granule caracteristice si fungi, sunt utile in stabilirea diagnosticului.
Tuberculoza intestinala produce leziuni stenotice caracteristice, de regula la nivelul ileonului terminal, dar frecvent prin contiguitate si la nivelul cecului si al colonului ascendent. Spre deosebire de enterita regionala, ariile de omitere nu sunt comune. Histologic, inflamatia granulomatoasa observata in infectia cu Mycobacterium tuberculosis poate fi nediferentiabila de enterita regionala; pentru aceasta sunt necesare coloratii care evidentiaza bacilii acid-alcoolo-rezistenti si culturi. Din fericire, in tarile vestice tuberculoza intestinala primara este rara in prezent.
Evolutie si complicatii
Principalele complicatii intestinale intalnite in evolutia colitei ulcerative sunt: megacolonul toxic, perforatia colonica, hemoragia digestiva inferioara severa, stenozele colonice si cancerul colorectal. Dintre complicatiile extraintestinale amintim artritele, uveite, eritem nodos, pioderma gangrenosum, pericolangita etc; acestea se coreleaza cu activitatea inflamatorie intestinala si sunt controlate de tratamentul specific al acesteia. O serie de manifestari extraintestinale severe evolueaza independent de cursul inflamatiei intestinale: spondilita anchilozanta, colangita sclerozanta primitiva, amiloidoza renala etc.
Boala
Crohn si colita ulcerativa sunt boli inflamatorii intestinale destul de
comune in Statele Unite si alte tari occidentale. Pacientii care sufera aceste afectiuni
sunt mai expusi riscului de a dezvolta adenocarcinom colorectal decat
populatia generala. Ambele, adenom-carcinomul si procesele de
inflamatie-carcinogeneza sunt caracterizate de angiogeneza
activa. Studii recente au aratat ca, de asemenea,
anti-angiogeneza ar putea fi un roman de abordare terapeutica pentru
bolile inflamatorii intestinale. Thrombospondina 1 (
Perforatia intestinala poate aparea in colita ulcerativa severa, deoarece, datorita ulceratiilor extinse, peretele intestinal poate deveni extrem de subtire. Manifestarile clinice sunt cele ale peritonitei acute, cu semne de inflamatie peritoneala si demonstrarea prezentei aerului liber sub diafragm la radiografiile abdominale simple, efectuate in pozitie ortostatica. Acestea reprezinta indicatii pentru colectomie imediata.
Dilatarea toxica a colonului poate aparea in boala Crohn, insa este mult mai frecventa in colita ulcerativa. Aceasta complicatie poate fi cel mai bine considerata o forma severa de colita ulcerativa, care prezinta in plus, dilatarea colonului. Se presupune ca tonusul neuromuscular al intestinului este afectat de inflamatia severa ce determina dilatatia. Utilizarea nejudicioasa a unor agenti care induc hipomotilitate (codeina, difenoxilat, loperamid, paregoric, agenti anticolinergici) pentru tratamentul diareei aparute in cadrul colitei ulceroase, poate precipita aparitia acestei complicatii. Similar, pregatirea cu purgative pentru clisma baritata, ca si o hipopotasemie coexistenta, pot reprezenta factori favorizanti. Din punct de vedere clinic,manifestarile colitei severe cuprind febra inalta, tahicardie, depletie de volum, dezechilibru electrolitic si durere abdominala.
La examenul obiectiv, pacientul prezinta o stare toxica, iar dilatarea colonului poate fi evidenta. Este prezenta sensibilitatea abdominala, iar in cazul in care s-a produs deja perforatia, apar semne de iritatie peritoneala. Diareea se poate reduce mult, datorita atoniei colonice, creand falsa impresie de ameliorare a colitei ulcerative. Radiografiile abdominale simple evidentiaza dilatarea colonului cu un diametru colonic ce depaseste 6 cm. In peretele colonului poate fi prezent aer si pot sa apara imagini de insule neregulate, de ulceratie a mucoasei.
Sediul cel mai frecvent al dilatatiei este colonul transvers, acest lucru fiind probabil o consecinta a pozitiei pacientului, deoarece, daca pacientul se afla in ortostatism, acesta reprezinta segmentul cel mai inalt al colonului. Aceasta forma de colita constituie o urgenta medicala reala, fiind asociata unei mortalitati ce depaseste 30% in cazul aparitiei perforatiei.
In comparatie cu populatia generala, persoanele cu boala inflamatorie intestinala cronica prezinta o incidenta crescuta a carcinoamelor, in special persoanele cu afectare extinsa a mucoasei (pancolita) si cele a caror boala evolueaza o perioada lunga de timp. Riscul cumulativ de cancer incepe sa creasca dupa 10 ani de la stabilirea diagnosticului. Desi incidenta cancerului variaza in functie de populatia de pacienti studiati, incidenta globala a cancerului a fost estimata la 0,5-1% dupa o perioada de 10 ani. S-a estimat ca, in cazul pancolitei, incidenta cancerului este de 12% la 15 ani, 23% la 20 de ani si 42% la 24 de ani dupa debutul bolii, cu toate ca rezultatele obtinute la nivelul policlinicilor au fost mai mici, sugerand o incidenta a cancerului colonului de 10% dupa 26 de ani de evolutie. La copii, riscul de cancer creste mult mai abrupt dupa primii 10 ani de evolutie, reflectand probabil incidenta mai mare a pancolitei la copii. Pacientii cu proctita ulcerativa (boala limitata la rect) nu prezinta un risc crescut de cancer. Cancerul intestinului subtire sau al colonului aparut in boala Crohn a fost mai putin studiat, dar incidenta ambelor cancere este crescuta comparativ cu populatia generala. Aceasta este totusi mai mica decat in colita ulcerativa, poate datorita afectarii mai reduse a mucoasei in boala Crohn, fata de colita ulcerativa. Dezvoltarea carcinomului colonic in evolutia bolilor inflamatorii intestinale demonstreaza diferente importante fata de carcinomul aparut la populatia fara colita. In conditiile prezentei colitei, diferitele semne precoce de alarma ale neoplasmului colonic (sangerare rectala, tulburari de tranzit intestinal) pot fi deseori dificil de interpretat. La pacientii cu colita, distributia carcinoamelor este mult mai uniforma de-a lungul colonului decat la pacientii fara colita; la cei din urma, majoritatea carcinoamelor sunt rectosigmoidiene, fiind localizate in zona accesibila sigmoidoscopului.
La pacientii cu colita, tumorile sunt deseori multiple, plate si infiltrate si par sa aiba un grad mai mare de malignitate. Exista unele dovezi care sugereaza ca acest lucru reflecta mai mult varsta mai tanara a celor afectati, decat coexistent colitei. Alti factori suplimentari care contribuie la dificultatea diagnosticarii sunt neregularitatile mucoasei, ulceratiile si pseudopolipii, facand carcinoamele mici dificil de diagnosticat radiologic sau endoscopic.
Au fost facute eforturi pentru dezvoltarea unor metode de screening eficiente pentru detectarea carcinoamelor dezvoltate in cadrul bolilor inflamatorii intestinale. Antigenul carcinoembrionar (ACE) poate fi crescut nespecific la pacientii cu colita ulcerativa, avand de aceea o valoare limitata. S-a sugerat efectuarea unor clisme baritate si/sau sigmoidoscopii sau colonoscopii periodice, dar interpretarea este uneori impiedicata de anomaliile proprii colitei. Efectuarea suplimentara a biopsiilor de mucoasa colonica poate aduce un ajutor semnificativ.
S-a sugerat initial ca, la pacientii cu colita cu risc crescut, poate fi prezenta o leziune precanceroasa generalizata, acestia avand fie un neoplasm ocult fie dezvoltand ulterior un neoplasm. Studiile efectuate la pacientii cu colita cu evolutie prelungita au aratat ca daca era prezenta o displazie severa, sansele prezentei concomitente a unui neoplasm malign sunt de 50% la pacientii care au fost supusi ulterior colectomiei.
Aceste observatii au fost complicate de faptul ca modificarile displazice au fost evidentiate numai in 60% din biopsiile rectale, facand recomandabila colonoscopia cu biopsii multiple.
In plus, la unii pacienti fara colectomie, displazia nu a fost o descoperire consistenta la biopsiile ulterioare. Oricum, este prudent ca pacientii cu colita ulcerativa cu o evolutie de peste 8-10 ani sa fie examinati periodic, la intervale regulate, prin colonoscopii si biopsii mucoase multiple. Nu a fost stabilita frecventa acestor examinari, recomandarile variind intre 6 luni si 2 ani. Daca se identifica o displazie severa, prudenta recomanda controale la perioade mai mici de 6 luni.
Desi majoritatea clinicienilor nu recomanda colectomia "profilactica" la pacientul cu colita ulcerativa veche si displazie usoara sau moderata, prezenta displaziei severe poate identifica un subgrup de pacienti care au deja un carcinom ocult sau un risc crescut de a dezvolta unul. Nu se pot face recomandari generale pentru acest grup restrans de pacienti dar, in aceasta situatie, multi medici recomanda colectomia.
Tratamentul rectocolitei ulcero-hemoragice
9.1. Tratamenul medical
Tratamentul bolilor inflamatorii intestinale idiopatice are ca scop controlul manifestarilor clinice, reducerea ratei complicatiilor, ameliorarea calitatii vietii si ameliorarea prognosticului pe termen lung.
Tratamentul colitei ulcerative si al bolii Crohn se bazeaza pe anumite principii terapeutice comune. Tratamentul initial al tuturor formelor de boala inflamatorie intestinala necomplicata este in primul rand medicamentos, iar principiile terapiei medicamentoase sunt similare in cele doua tipuri de afectiuni. Tratamentul chirurgical este rezervat pentru cazurile cu (1) complicatii specifice si (2) lipsa de raspuns la tratament. Exista totusi diferente semnificative in ce priveste abordarea pacientului cu colita ulcerativa si a celui cu boala Crohn.
Raspunsul la terapia medicamentoasa poate sa difere, complicatiile difera adesea si prognosticul dupa terapia chirurgicala nu este acelasi. Odata ce diagnosticul a fost stabilit, trebuie evaluata severitatea bolii. Forma usoara de colita ulcerativa, inclusiv proctita ulcerativa, poate fi tratata de regula ambulator. Trebuie remarcat ca, in anumite cazuri, afectiunea, desi limitata la nivelul rectului, poate fi severa. Starea pacientului se poate inrautati brusc, desi gravitatea crizelor nu este anuntata de debutul insidios. Scopul terapiei este controlul procesului inflamator si compensarea pierderilor nutritionale. Corectarea echilibrului hidroelectrolitic prin perfuzii cu lichide si electroliti ofera de obicei o anumita ameliorare. Transfuziile de sange pot fi necesare, in special atunci cand are loc o sangerare continua.
Agentii care controleaza diareea (difenoxilat, loperamid, codeina, anticolinergice) trebuie folositi cu maxima prudenta, pentru a nu induce dilatatia colonica si megacolonul toxic. Decizia de a institui alimentatia parenterala trebuie sa fie determinata de starea nutritionala a pacientului si cand se anticipeaza o evolutie de lunga durata a bolii.
In formele severe, chiar lichidele limpezi administrate pe cale orala pot stimula activitatea colonului, de aceea se recomanda adesea suspendarea alimentarii orale. In acest stadiu, alimentatia intravenoasa periferica sau centrala este utilizata temporar, ca terapie de substitutie. Desi nu exista nici o dovada ca alimentatia parenterala este eficienta ca terapie primara, aceasta este o componenta importanta a planului terapeutic. In formele mai putin severe, cand pacientii tolereaza administrarea orala de lichide, dietele fluide (lichidiene) se pot dovedi de mare ajutor, crescand aportul de principii nutritive elementare cu un volum minim de materii fecale.
Principalele medicamente folosite in terapia colitei ulcerative sunt antiinflamatoarele, sulfasalazina sau Salazopirina si glucocorticoizii.
9.1.1. Derivatii de acid 5- aminosalicilic (5-ASA)
Preparatele de acid 5-aminosalicilic (5-ASA) se clasifica in preparate sulfatate (Salazopirina) si non-sulfatate (Mesalazina, Olsalazina, Balsalazina).
Sulfasalazina este o combinatie de sulfapiridina (o sulfonamida) si acid 5-aminosalicilic. Nu se absoarbe in stomac si jejun, ajunge in ileon si colon unde este scindata de bacterii in partile componente. Sulfapiridina eliberata este eficient absorbita si excretata masiv in urina, iar salicilatul liber - componentul activ - ramane masiv in colon si e excretat in scaun. Rata acetilarii hepatice variaza individual determinand nivelul seric al sulfapiridinei. Majoritatea efectelor adverse ale salazopirinei se coreleaza cu rata acetilarii si nivelul seric al sulfapiridinei.
5-ASA reprezinta
compusul activ din molecula de salazopirina. Slab absorbabila in colon,
molecula 5-ASA ramane in lumen unde isi exercita efectul
terapeutic, dupa care se elimina in fecale. Compusii 5-ASA
detin o larga gama de efecte terapeutice. Aminosalicilatii
inhiba ciclooxigenaza si 5-lipooxigenaza, inhiband astfel sinteza
leucotrienei B4 (LTB4), tromboxanului A2 (TxA2) si prostaglandinelor. Intervin in raspunsul
imun, diminuand sinteza de anticorpi si activitatea limfocitelor. Au si o
activitate de indepartare a radicalilor liberi de oxigen (
Salazopirina prezinta si efecte adverse. Dintre aceste, unele sunt corelate cu doza (greata, varsaturi, anorexie, cefalee, malabsorbtia de folati), altele sunt independente de doza (rash, anemie hemolitica, granulocitopenie, diminuarea fertilitatii masculine).
In timp ce majoritatea medicilor recunosc rolul sulfasalazinei in profilaxia recidivelor colitei ulcerative, este mai putin cunoscut faptul ca acest agent este benefic in tratamentul colitei ulcerative acute in formele usoare si moderate. Sunt recomandate doze terapeutice de 4-6 g/zi. Doza initiala este de 500 mg x 2/zi si se creste treptat, zilnic sau la doua zile cu 1 g, pana la atingerea dozei terapeutice. Preparatele topice de 5-aminosalicilat (mesalazina) administrate sub forma de clisma sunt eficiente in controlul proctocolitei distal.
Compusii 5-ASA sunt recomandati in formele blande si moderate de colita ulcerativa. Salazopirina este ineficienta in tratamentul formelor severe si fulminante. Tratamentul de intretinere cu 5-ASA scade substantial rata recidivelor, fiind indicat pacientilor care au raspuns tratamentului de atac, pentru profilaxia recidivelor inflamatorii, precum si pacientilor operati pentru profilaxia recidivelor postoperatorii. Eficienta preparatelor 5-ASA in mentinerea remisiunii este corelata cu doza, o doza de 2-3g/zi fiind recomandata in acest scop.Doza de atac de Mesalazina este de 3,2-4,8 g/zi.
Principalul avantaj al preparatelor non-sulfatate de 5-ASA constau in efectele adverse reduse, buna toleranta a preparatelor orale si disponibilitatea sub forma de preparate topice (supozitoare, microclisme) pentru tratamentul localizarilor distale.
9.1.2. Glucocorticoizii
In formele severe in care pacientul nu tolereaza medicatia orala si se doreste adesea un efect rapid, se incepe tratamentul cu glucocorticoizi. ACTH-ul este la fel de eficient in aceleasi doze si administrat pe aceleasi cai, dar majoritatea medicilor il recomanda mai rar. Alegerea tine de preferinta individuala; de obicei, se incepe cu prednison - 45-60 mg/zi, per os. In formele severe, administrarea parentala a corticosteroizilor (exemplu prednisolon 45-60 mg/zi iv.) este de preferat, pentru a evita incertitudinea absorbtiei orale. Ameliorarea starii pacientului survine de obicei in 7-10 zile, cu reducerea febrei, revenirea apetitului si incetarea scaunelor cu sange. Dupa o imbunatatire initiala a starii generale se poate relua alimentarea orala, cu alimente sarace in fibre; in acest moment, doza de steroizi poate fi redusa treptat. Principiul de baza este ca odata ce starea generala a pacientului s-a ameliorat, nu exista nici o dovada ca administrarea de steroizi influenteaza favorabil evolutia ulterioara a bolii sau ca are un rol in profilaxia recurentelor. In practica, terapia steroidica poate fi redusa treptat sau intrerupta 2-3 luni dupa incheierea tratamentului.
Corticosteroizii reprezinta unul dintre agentii terapeutici a caror eficienta in bolile inflamatorii intestinale idiopatice este de multa vreme recunoscuta. Ei intervin atat in etapele inflamatiei intestinale cat si in raspunsul imunologic. Corticosteroizii inhiba direct functia leucocitara: inhiba marginatia neutrofilelor, pasajul acestora prin peretele intestinal, chemotactismul si fagocitoza si interfera cu metabolismul acidului arahidonic, stimuland productia de lipomodulina care blocheaza eliberarea de acid arahidonic din fosfolipide si determina scaderea productiei de leucotriene si prostaglandine. De asemenea, corticosteroizii diminueaza productia citokinelor proinflamatorii: IL-1, IL-6, chemokinelor (IL-8), citokinelor elaborate de Th1 (IL-2, IFN- ) si Th2 (IL-4, IL-5).
Corticosteroizii sunt eficienti in tratamentul pe termen scurt al formelor moderat-severe si fulminante ale colitei ulcerative. Dozele recomandate pentru inducerea remisiunii sunt 0,5-0,75 mg/kgc de prednison sau echivalente, pana la rezolutia simptomelor. S-a constatat un raspuns spectacular la corticoterapie in aproximativ 1-4 saptamani. Dupa disparitia simptomelor, dozele se scad progresiv in raport cu evolutia clinica, in general cu 5-10 mg/saptamana pana la 20 mg, apoi cu 2,5-5 mg/saptamana pana la intreruperea tratamentului. In formele fulminante este indicata corticoterapia pe cale parenterala, cu 40-60 mg/zi in doze divizate sau in perfuzie continua. Foarte multi pacienti cu colita ulcerativa severa sau fulminanta care au necesitat tratament cu corticosteroizi, au dezvoltat forme corticodependente (recidive inflamatorii la tentativele de intrerupere a tratamentului sau de reducere a dozelor) sau corticorezistente (persistenta manifestarilor clinice in ciuda tratamentului). Corticosteroizii sunt ineficienti in mentinerea remisiunii si profilaxia recidivelor postoperatorii. De asemenea, numeroasele efecte adverse ale corticosteroizilor limiteaza utilizarea acestora pe termen lung.
Noii agenti corticoterapici au eficienta similara corticosteroizilor clasici si biodisponibilitate redusa, minimalizand efectele adverse sistemice ale corticoterapiei in bolile inflamatorii intestinale idiopatice. Budesonid este un agent corticoterapic eficient, a carui toxicitate sistemica este limitata prin metabolizarea hepatica rapida, la "prima trecere". Formula sa de prezentare (preparatul este acoperit cu o capsula enterosolubila de Eudragit) il face disponibil in aria de inflamatie activa. In trialurile clinice, doza de 9 mg/zi de Budesonide are eficienta similara dozei de 40-60 mg/zi de prednison pentru inducerea remisiunii in boala Crohn, iar nivelul seric al cortizonului si efectele adverse sistemice sunt net diminuate. Efectele adverse in tratamentul de lunga durata cu Budesonide sunt in curs de evaluare. Preparatul este disponibil sub forma de microclisme de retentie pentru tratamentul colitei ulcerative.
La unii pacienti (10-15%) eforturile de a elimina complet steroizii se pot asocia cu recaderi si pot fi necesare doze de intretinere mici pana la moderate de steroizi (10-15 mg prednison/zi) pentru a inhiba activitatea bolii. Nu trebuie facuta confuzia cu administrarea profilactica de steroizi la pacientii la care se inregistreaza remisiuni ale bolii ci reprezinta mai degraba un tratament al unei forme de boala care nu raspunde complet. O data ce in stadiul acut pacientul reia alimentatia orala, trebuie adaugata in tratament sulfasalazina, dupa cum s-a aratat anterior, intr-o doza de 2 g/zi. Studii recente au demonstrat ca aceasta doza, administrata ca doza de intretinere la pacientii cu colita ulcerativa, este eficienta in scaderea frecventei recidivelor si trebuie continuata si dupa intreruperea tratamentului cu glucocorticoizi. Din pacate, pacientii cu deficit de glucozo-6- fosfat-dehidrogenaza sau cei care prezinta reactii alergice severe la gruparea sulfamidica nu pot fi mentinuti cu aceasta terapie.
Agentii imunomodulatori
Sunt reprezentati de agenti ce blocheaza proliferarea, activarea si mecanismele efectorii ale limfocitelor. In practica sunt larg utilizate azatioprina si 6-mercaptopurina, iar o utilizare mai restransa o au ciclosporina si metotrexatul.
Agentii imunomodulatori sunt indicati in formele corticodependente, corticorezistente si in terapia de intretinere, dupa instalarea remisiunii. Metabolitul activ al azatioprinei si 6-mercaptopurinei este 6-tioguanina ce este incorporata in ribonucleotide exercitand un efect antiproliferativ asupra populatiei limfocitare mitotic active. Azatioprina si 6-mercaptopurina poseda si proprietati antiinflamatorii, inhiband activitatea limfocitelor T citotoxice si NK (natural killer). Dozele utilizate in tratamentul colitei ulcerative sunt 2-2,5 mg/kgc Azatioprina si 1,5 mg/kgc 6-mercaptopurina. Raspunsul se instaleaza lent, in aproximativ 3-4 luni de la initierea tratamentului. Principalul factor limitativ in tratamentul cu azatioprina si 6-mercaptopurina este reprezentat de toxicitate. Frecvent, aceste medicamente induc leucopenie impunand monitorizarea numarului de leucocite saptamanal la inceputul tratamentului si la 1-3 luni ulterior. Alte efecte secundare sunt reprezentate de pancreatite, depresie medulara, reactii alergice, complicatii infectioase.
Ciclosporina este un agent imunomodulator cu o actiune specifica. Aceasta formeaza un complex cu ciclofilina celulara. Acest complex va inhiba serin-treonin fosfataza responsabila de activarea transcriptiei factorilor proinflamatori. Ciclosporina inhiba producerea de IL-2, IL-4, IFN si TNF , avand un efect antiproliferativ asupra limfocitelor si diminua producerea de cytokine proinflamatorii. Ciclosporina este indicata in cazuri selectionate de colita ulcerativa severa, rezistenta la alte terapii si, ocazional, in tratamentul fistulelor. Doza recomandata este de 4 mg/kgc/zi in perfuzie continua. Este recomandata reducerea dozelor la pacientii varstnici si la cei cu afectarea functiei renale (2-3 mg/kgc/zi). Raspunsul terapeutic la ciclosporina se instaleaza relativ rapid, in aproximativ 2 saptamani de la initierea tratamentului, ceea ce o face indicata in preambulul terapiei imunomodulatoare de lunga durata cu azatioprina. Efectele adverse numeroase fac ca ciclosporina sa nu fie utilizata in tratamentul de lunga durata (de intretinere). Cele mai frecvente efecte adverse ale ciclosporinei sunt reprezentate de alterarea reversibila sau ireversibila a functiei renale (20% din cazuri), hipertensiune, tremor, cefalee, parestezii. Efectele adverse numeroase si severe ale ciclosporinei impun monitorizarea nivelului seric prin RIA cu mentinerea concentratiei intre 300-400 ng/ml.Rolul imunosupresoarelor (de exemplu azatioprina) in colita ulcerativa nu este pe deplin elucidat. Administrate ca agenti unici in colita ulceroasa, se dovedesc ineficiente.
Terapia cu imunosupresoare poate fi instituita, totusi, in doze de 1,5-2 mg/kg corp cand glucocorticoizii se dovedesc ineficienti sau cand este necesara o doza foarte mare de steroizi pentru a reduce inflamatia. Se recomanda monitorizarea hemogramei si observarea atenta pentru prevenirea infectiilor. Introducerea azatioprinei in tratament poate avea de asemenea un rol important in scaderea dozei de steroizi la pacientii cu colita ulcerativa cronica, la care trebuie mentinut tratamentul cu glucocorticoizi pentru a controla activitatea bolii. Ciclosporina (4 mg/kg pe zi), un puternic agent imunosupresor, este eficace in special in formele severe, producand ameliorari clare la pacientii care altfel ar necesita colectomie.
9.1.4. Antibioticele
Pornind de la rolul florei intestinale in patogeneza bolilor inflamatorii intestinale idiopatice, antibioticele au fost utilizate empiric in tratamentul colitei ulcerative. Antibioticele cu spectru larg sunt utilizate in complicatiile supurative si pentru tratamentul sindromului de poluare bacteriana ce este determinat de existenta stenozelor si segmentelor intestinale excluse din transit (fistule, derivatii chirurgicale).
Metronidazolul si chinolonele sunt recunoscute pentru proprietatile imunomodulatorii pe care le poseda, pe langa cele antibacteriene. Astfel, ele inhiba fenomenul de marginatie leucocitara si au un efect de indepartare a radicalilor liberi de oxigen. Administrarea de Metronidazol nu este recomandata pe termen lung deoarece efectele adverse, in special neurotoxicitatea se coreleaza cu doza totala. Doza eficienta este de 10-20 mg/kgc/zi. In RCUH metronidazolul este recomandat in special pentru profilaxia recidivelor postoperatorii.
9.1.5. Agentii biologici
Factorul de necroza tumorala alfa (TNF ) s-a dovedit a juca un rol critic in patogeneza bolii inflamatorii intestinale. TNF blocantele sunt agenti biologici care vizeaza in mod specific aceste citokine cheie in procesul inflamator si au devenit un sprijin in terapia bolilor inflamatorii intestinale. Inaintea utilizarii acestor agenti trebuie facute investigatiile necesare, se testeaza folosirea lor in timpul sarcinii si alaptarii, se verifica eficacitatea si siguranta, adaptarea dozei. In prezent, exista trei blocante ale TNF disponibile pentru utilizarea clinica in bolile inflamatorii intestinale in Elvetia: Infliximab (Remicade), Adalimumab (Humira) si Certolizumab pegol (Cimzia).
Infliximab (Remicade) este un agent anti-TNF himeric constituit din anticorpi monoclonali de tip IgG1, 25% murini si 75% umani (vezi figura 7). Se administreaza intravenos in perfuzie lenta cu durata de 2 ore, in sectii de gastroenterologie, sub atenta urmarire a medicului curant si a personalului specializat si in prezenta echipamentului de urgenta destinat tratamentului reactiilor adverse infuzionale. Inductia remisiunii se realizeaza cu 3 doze administrate la 0, 2 si 6 saptamani, iar mentinerea remisiunii se realizeaza cu doze administrate la interval de 8 saptamani. Pacientii necesita monitorizare in timpul perfuziei si 1-2 ore dupa aceasta.
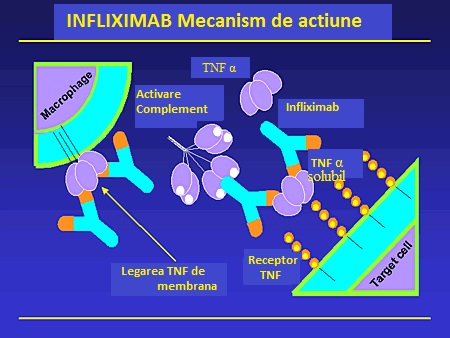
Figura 7: Infliximabul neutralizeaza atat TNF- de la nivelul receptorilor solubili, cat si pe cel de la nivelul membranelor celulelor producatoare de TNF- .
Adalimumab (Humira) este un agent anti-TNF complet umanizat de tip IgG1. Se administreaza subcutanat, de catre pacientul educat in prealabil in acest scop. Inductia remisiunii se realizeaza cu 2 doze, la 0 si la 2 saptamani, iar mentinerea remisiunii cu doze auto-administrate la interval de 2 saptamani.
9.2. Psihoterapia
Increderea si intelegerea reciproca, precum si compasiunea si atentia acordate de medic sunt esentiale in terapia oricarei boli cronice si in special in tratamentul de durata al pacientilor cu boli inflamatorii intestinale. Deseori, pacientii sunt adulti tineri si inteligenti, refractari fata de o boala care ii afecteaza in cei mai productivi ani. Medicul ii poate totusi convinge, printr-o participare viguroasa, sa duca o viata normala si productiva pe cat posibil. Asistenta psihiatrica poate fi necesara mai mult la cei cu boala inflamatorie intestinala cronica, in formele grave de depresie survenite la copii, adolescenti si varstnici, in special in cazurile in care se recomanda colectomia - atat in etapa preoperatorie, cat si postoperator.
9.3. Graviditatea si colita ulcerativa
Majoritatea medicilor se tem de implicatiile sarcinii asupra colitei ulcerative, dar prognosticul bolii este excelent, atat pentru gravida, cat si pentru fat. In general sarcina nu este amenintata de colita ca boala subiacenta, neinregistrandu-se cresterea ratei mortalitatii infantile sau a nasterilor premature fata de populatia generala. Cand pacientele cu colita inactiva raman insarcinate, la aproximativ 50% se inregistreaza o exacerbare a bolii, cu o crestere a frecventei crizelor in timpul primului trimestru sau post-partum. Terapia este mult asemanatoare celei administrate celorlalti pacienti. Sulfasalazina este recomandata in formele usoare si moderate. Nu exista dovezi ca acest medicament ar induce malformatii fetale sau ca ar produce alte tulburari fatului. Femeile care sufera de colita inactiva si se afla sub tratament cu sulfasalazina cand raman insarcinate pot continua tratamentul, pentru a proteja mama de o recadere a bolii in perioada post-partum. Atat sulfasalazina cat si 5-aminosalicilatul pot fi administrate pe perioada alaptarii. Corticosteroizii se administreaza in aceleasi doze si cu aceleasi indicatii ca inainte de sarcina. Imunosupresoarele trebuie, totusi, evitate in timpul sarcinii. O abordare terapeutica similara este valabila si in cazul tratarii bolii Crohn in timpul sarcinii.
Strategia terapeutica in rectocolita ulcerohemoragica
Variaza in raport cu localizarea, severitatea, forma clinico-evolutiva si prezenta complicatiilor. Tratamentul este divizat in tratamentul episodului acut si tratamentul de intretinere. Tratamentul chirurgical este destinat stenozelor, complicatiilor supurative, megacolonului toxic, perforatiei intestinale si formelor refractare la tratamentul medical.
Tratamentul puseului de activitate in proctita ulcero-hemoragica poate fi initiat cu preparate locale de tipul corticosteroizilor in microclisme (Cortenema) sau spume intrarectale (Cortifoam, Colofoam) 1/zi, seara la culcare timp de 2-3 saptamani. O alternativa terapeutica este reprezentata de microclismele de retentie sau supozitoarele cu 5-ASA. Corticosteroizii sub forma de spuma si supozitoarele 5-ASA sunt eficiente in formele distale extinse pana la 20 cm de orificiul anal, iar microclismele de retentie sunt eficiente in formele distale extinse pana la 60 cm. In cazul raspunsului clinic favorabil, tratamentul poate continua cu microclisme sau supozitoare la fiecare doua zile, alte 2-3 saptamani.
O alternativa terapeutica este reprezentata de tratamentul oral cu Salazopirina (3-4 g/zi) sau 5-ASA (2,4-4,8 g/zi).
Pacientii care nu raspund la aceste alternative terapeutice beneficiaza de Prednison per os 30-40 mg/zi. In proctitele si proctosigmoiditele refractare poate fi administrat tratament imunosupresor (6-Mercaptopurina sau Ciclosporina per os/microclisme).
In colita ulcerativa extinsa proximal de sigmoid cu pusee usoare-moderate de activitate, tratamentul este initiat cu Salazopirina sau 5-ASA in doza de atac pentru 3-4 saptamani. Pacientii refractari la acest tratament beneficiaza de corticoterapie cu doze de 20-40 mg/zi, redusa progresiv dupa atingerea remisiunii, concomitent cu introducerea Salazopirinei/5-ASA in doze de intretinere.
In colita ulcerativa severa/fulminanta spitalizarea pacientilor este obligatorie. Evaluarea initiala este destinata detectiei complicatiilor (megacolon toxic) care beneficiaza de tratament specific. Anticholinergicele si antidiareicele nespecifice sunt contraindicate in formele severe datorita riscului de a induce megacolon toxic. Tratamentul cuprinde repaus la pat, hidratare, corectii nutritionale si electrolitice si corticoterapie parenterala (Prednisolon 60-80 mg/zi). Pacientii cu anemie semnificativa (<8 g/dl) necesita corectie transfuzionala, iar cei cu fenomene infectioase necesita antibioterapie cu spectru larg (Metronidazol, Ampicilina, aminoglicozide sau cefalosporine parenteral).
Pacientii care raspund favorabil continua corticoterapia orala pana la atingerea remisiunii, dupa care corticosteroizii sunt suprimati progresiv si inlocuiti cu Salazopirina in doze de intretinere. In cazul pacientilor non-responsivi este recomandat repausul digestiv, nutritia totala parenterala si corticosteroizi parenteral timp de 7-10 zile. Formele refractare beneficiaza de administrarea de Ciclosporina 4 mg/kgc timp de 7-10 zile. In cazul pacientilor non-responsivi este indicata colectomia.
Un grup restrans de pacienti cu colita ulcerativa sunt cortico-refractari sau corticodependenti. In aceste cazuri, continuarea terapiei cu corticosteroizi in doze de atac reprezinta o eroare. Daca pacientii cu colita ulcerativa necesita Prednison in doze ce depasesc 15 mg/zi, timp de peste 6 luni, este recomandata terapia imunosupresoare (6-MP, Azatioprina sau Ciclosporina A). In cazul pacientilor non-responsivi este indicata colectomia curativa. Pentru pacientii responsivi, problema majora este reprezentata de durata tratamentului imunosupresor. Se recomanda suprimarea tratamentului dupa 1-3 ani. Datorita riscului malign asociat cu tratamentul imunosupresor pe termen lung, la care se asociaza riscul cancerului colorectal supraimpus colitei ulcerative (in formele cu evolutie de peste 8 ani), colectomia curativa este o alternativa preferata in formele refractare.
Dupa atingerea remisiunii, tratamentul de intretinere cu preparate de 5-ASA este recomandat pe tot parcursul vietii pentru profilaxia recidivelor. Doza recomandata este de 2-3 g/zi.
Megacolonul toxic este complicatia majora a colitei ulcerative severe care necesita interventie urgenta si tratament intensiv, precum si un control interdisciplinar - internist sau gastroenterolog si chirurg. Odata stabilit diagnosticul, se recomanda administrarea de fluide iv., corectarea echilibrului hidroelectrolitic si transfuzii de sange. Multi medici recomanda antibioterapia cu antibiotice cu spectru larg (dupa efectuarea corespunzatoare a antibiogramei) deoarece exista teama de perforatie si o mare probabilitate de a se produce bacteriemie si perforatie oculta. Alimentatia orala este suspendata si se monteaza sonda nazogastrica. De asemenea, se incepe administrarea iv. de corticosteroizi. Stabilizarea starii generale se produce in 24-48 ore, dupa parerea majoritatii medicilor. Daca in acest timp nu au aparut semne de evolutie pozitiva si perforatia pare iminenta, se face de urgenta colectomia.
Uneori, prin tratamentul medicamentos adecvat se pot obtine unele rezultate cu evitarea colectomiei, dar acest procedeu este riscant si pune in pericol viata pacientului, rata mortalitatii crescand marcat daca apare perforatie si atingand aproximativ 50% in cazurile in care colectomia se efectueaza ulterior.
La celalalt capat al spectrului se afla pacientii cu forme usoare de colita ulcerativa, limitata la rect sau rectosigmoid. Terapia se incepe cu sulfasalazina, 0,5-1 g de 4 ori pe zi, dupa masa. Alternativ, la pacientii ce prezinta alergie la grupari sulfat, se instituie clismele cu 5-aminosalicilat sau preparatele orale cu 5-aminosalicilat. Daca simptomele rectale, cum ar fi tenesmele, sunt foarte intense, steroizii topici sub forma de clisma pot produce imbunatatiri substantiale. Echivalentul a 100 mg hidrocortizon (20 mg prednison) se dilueaza in 60-100 ml de ser fiziologic si se administreaza in clisma inainte de culcare. Uneori, pacientii cu tenesme severe tolereaza mai bine steroizii preparati sub forma de spuma. Clismele de retentie s-a demonstrat ca elibereaza substanta activa pe toata lungimea colonului descendent, iar absorbtia steroizilor este redusa (10-20% pana in colonul descendent). Daca se recomanda pentru control doze crescute de steroizi administrati rectal, este preferabil sa se administreze oral prednison in doze moderate (20 mg/zi po.)
9.5. Tratamentul chirurgical
Aproximativ 20-25% din pacientii cu colita ulcerativa necesita colectomie in cursul evolutiei bolii lor. O indicatie majora pentru colectomie este lipsa de raspuns la tratamentul medicamentos intensiv. Acest grup include pacientii la care nu se inregistreaza ameliorare dupa 7-10 zile de terapie medicala optima, chiar daca nu prezinta semne de dilatatie colonica. Febra, diareea sanguinolenta si starea de oboseala accentuata pot persista si necesita a se lua in considerare colectomia de semielectie.
Colectomia de electie este rezervata pacientilor a caror boala ramane cronic activa si necesita tratament continuu cu corticosteroizi. La acesti pacienti exista riscul de a dezvolta complicatiile secundare corticoterapiei permanente. Dupa colectomie, acesti pacienti isi recapata in general energia si isi recastiga greutatea pe care au avut-o inainte de imbolnavire. Dupa cum s-a aratat, pacientii cu colita cronica prezinta un risc ridicat de a dezvolta cancer colonic. Majoritatea specialistilor nu recomanda colectomia profilactica la pacientii cu boala putin activa, dar displazia pronuntata la biopsia colonoscopica realizata ca parte a unui program de investigare, ar trebui sa-i determine pe medici sa recomande colectomia. Decizia de a indica colectomia in afara situatiilor de urgenta este dificila, atat pentru medic, cat si pentru pacient. Multi pacienti este firesc sa fie refactari la ideea colectomiei si nu se pot obisnui cu ideea de a trai permanent cu o ileostoma.
In majoritatea centrelor din orasele mari din S.U.A. exista grupuri specializate care viziteaza pacientii inainte de operatie si le raspund la o serie de intrebari practice legate de ileostoma. De asemenea, este indicat sa se apeleze la o asistenta competent in ingrijirea ileostomei pentru sfaturi practice legate de folosirea acesteia.
Procedura chirurgicala standard pentru aproape toti pacientii supusi colectomiei este proctocolectomia totala cu ileostoma permanenta, dar mai exista cateva alternative care nu sunt de neglijat. Ileostoma continenta are un rezervor ileal fixat subcutan cu o valva proeminenta pentru prevenirea refluarii continutului ileal. Acesta se colecteaza in rezervor, care se goleste prin intermediul unui cateter cauciucat. Doar o mica deschizatura este vizibila la exterior, fiind mai estetica decat clasica ileostoma. Totusi, frecventele probleme datorate
scurgerilor si lipsei de etanseitate au facut aceasta procedura putin atractiva. Exista un mare entuziasm pentru anastomoza ileo-rectata cu punga ileala interna creata pentru a functiona ca un rezervor. Aceasta are de regula rezultate bune, cu continenta si 5-7 scaune/zi.
Complicatiile cum sunt inflamatia pungii ileale si necesitatea revizuirii chirurgicale sunt mai putin frecvente decat in ileostoma continenta. Imbunatatirea tehnicilor a permis anastomoza ileo-anala cu punga interna modelata din intestinul subtire anastomozat la canalul anal. Atunci cand acest procedeu este realizat de chirurgi cu experienta, continenta este excelenta, totusi la 20% din pacienti apar scurgeri nocturne. Deoarece dupa aceste procedure anastomotice poate ramane mucoasa rectala, trebuie realizata proctoscopia de supraveghere a displaziei.
Sunt utilizate urmatoarele clase de medicamente: preparatele de acid 5-aminosalicilic (5-ASA), corticosteroizii, antibioticele, agentii imunosupresori si modificatorii raspunsului biologic. Tratamentul este divizat in tratamentul episodului inflamator acut si tratamentul de intretinere.
Pentru tratamentul complicatiilor cum ar fi stenozele, supuratii, megacolonul toxic, perforatia intestinala se recurge la chirurgie. De asemenea tratamentul chirurgical este folosit si pentru tratarea bolii refractare la tratamentul medical.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |