Sistemele cromogene exogene interfereaza cu metabolismul biostructurilor, suprimand unele functii biologice, in special prin modificari conformationale si xxxxxxx sterica a componentilor acizilor nucleici. Efectul poate fi asimilat cu o actiune radiometrica, dupa cum nu pot fi omise interactiile corelate cu excitarea in domeniul U.V. a componentilor acizilor nucleici, respectiv foto sensibilizarea produsa in coloranti.
Leziunile celulare datorita transmiterii energiei electromagnetice absorbite, de la coloranti la biopolimeri, impun cu stringenta clarificarea locului si naturii interactiilor, indicarea parametrilor determinanti, stabilirea modelelor fizico-chimice de inregistrare si estimare cantitativa a efectelor.
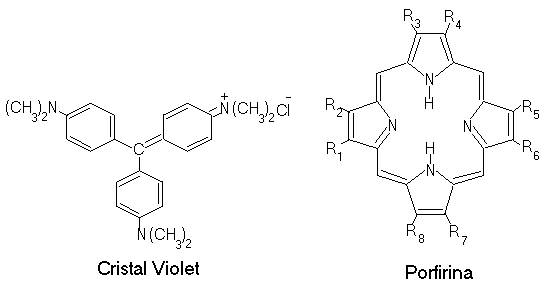
Sistemele cromogene reactive sunt cele heterociclice, condendate, coplanare (triazinice, azinice, xantenice, furocumarinice) structurile diamino-sau triamino-trifenil-metanice, bromura de etidin si componente biologice (riboflavina, porfirinele).
Decelabila pe cale spectrala, prin efecte de metacromazie, dicroism circular si fluorescenta, precum si prin modificarea proprietatilor hidrodinamice, formarea complecsilor dintre coloranti si biomolecule implica o problematica vasta si dificila, abordabila prin apelare la tehnici de investigare si calcul de mare acuratete.
Specificarea interactiilor dintre coloranti si biopolimeri este de certa valoare pentru biologia moleculara, contribuind la clarificarea efectelor fotodinamice, mutagen, cancerigen si de inactivare celulara, furnizand remedii potentiale in unele afectiuni, ca si elemente de modificare genetica selectiva a biostructurilor.
Sisteme cromogene reactive fata de biopolimeri
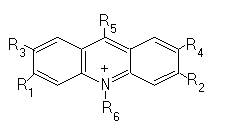
Acridine: Proflavina: R1=R2=-NH2; R3.R6=H
Acridin oranj: R1=R2=N(CH3)2; R3.R6=H
Acriflavina:R1=R2=NH2; R3..R5=H; R6=CH3
Galben de acridina: R1=R2=-NH2; R3=R4=CH3; R5=R6=H
9-Amino-acridina: R1,R2,R3,R4,R6=H; R5=-NH2
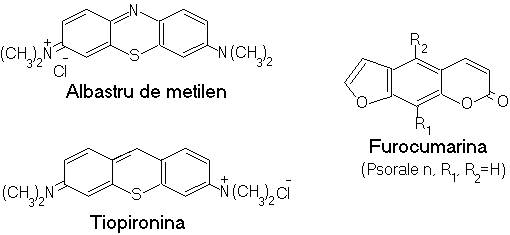
1.Interactii coloranti-acizi nucleici
La baza functionarii tuturor celulelor sta macromolecula de ADN ce detine codul de informatie ereditara ce conditioneaza realizarea tuturor caracteristicilor morfologice, biochimice, fiziologice si comportamentale.
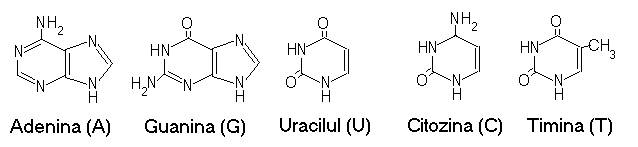
Acizii nucleici (ADN si ARN) sunt denumiti astfel deoarece contin grupari fosfat cu caracter hidrofil si au fost descoperiti prima data in nucleul celulelor.
Componentele esentiale ale nucleotidelor (unitati structurale ale acizilor nucleici) sunt bazele azotate alcatuite din C, O, H,N.
Ele sunt de doua feluri:
- purinice: -adenina (A)
-guanina (G)
- pirimidinice: -timina (T) si citozina (C) in ADN
-uracilul (U) si citozina in ARN
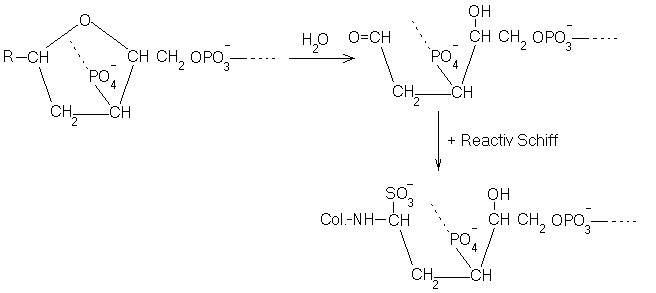
La acestea se leaga D-riboza (in ARN) si D,2-deoxiriboza (in ADN) sub forma izomerica β, forma ce are gruparea oxidril de la C1 deasupra planului molecular. Din cuplarea covalenta a unei baze azotate cu pentoza rezulta nucleosidul iar prin atasarea covalenta a unui rest fosforic la acesta, rezulta nucleotidul.
Din polimerizarea nucleotidelor rezulta macromolecula de acizi nucleici. Ciclurile deoxiribozice ale ADN sunt deschise prin intermediul hidrolizei acide, urmata de expunerea hidrolizatului la actiunea bazei Schiff.
Horobin (1982,1988) demonstreaza ca, colorarea este bazata pe interactiunea colorant-substrat si pe cinetica sa, asemanator cu colorarea textilelor.
Tesuturile vii sunt alcatuite din unitati morfologice diferite, si in consecinta, colorarea selectiva este mai importanta.
Selectivitatea se bazeaza atat pe afinitatile diferite cat si pe viteza diferita de difuziune a colorantului in substrat.
De exemplu, colorantii cationici coloreaza ADN si ARN deoarece sunt bogati in anioni. Proteinele nu sunt colorate in conditii acide.
Agregarea colorant-colorant este importanta, ca si colorarea agregatelor diferita de aceea a monomerilor.
Agregarea poate fi de asemenea cauza schimbarilor de culoare in colorarea biologica fluorescenta. Oranjul de acridina (colorant acridinic corespunzator la acriflavina, dar fara o grupa metil la heteroatomul de azot arata o fluorescenta galben-verzuie a ADN si rosie fluorescenta a ARN).
Foarte adesea colorarea selectiva nu este bazata pe afinitatile diferite semnificativ ci pe vitezele diferite ale difuziei. Un caz binecunoscut este amestecul Pyron C si Metil Green (cristal violet dar cu o grupa
N (CH3)3+ in locul unei grupe
N (CH3)2 ).
Cationul relativ mare al verdelui de metil (M=408/coloreaza ADN, Pyrosina (M=267) numai ARN.
Interactiile colorantilor cationici cu acizii nucleici in solutii apoase, dependente de raportul de legare r, conformatia macromoleculei, gradul de agregare al colorantului si natura legaturilor formate se soldeaza cu deplasari spectrale. Astfel, in cazul colorantilor acridinici, pentru o valoare mica a parametrului r s-a inregistrat o deplasare batocroma (banda α) corespunzatoare complexarii monomerului colorantului. Marimea valorii r, ca si interactiile cu dimerii colorantilor conduc la efecte hipsocrome (banda β). Deplasarea hipsocroma este maxima (banda γ) pentru interactia agregatelor mari ale colorantului cu biopolimerul.
1.1.Legarea interna-Modelul intercalarii
Legarea interna implica intercalarea colorantului cationic in stare monomera intre bazele purinice si pirimidinice, suturarea corespunzand la un raport colorant/nucleotida de 1/4-5 iar variatia energiei libere fiind de 6-9 kcal/mol colorant. Conform modelului intercalarii Lermann, interactia puternica dintre colorantii cationici si bazele azotate se soldeaza cu marirea distantei dintre acestia de la 3,4 la 6,8Å, de asemenea se soldeaza cu rasucirea spiralei polinucleotidice fara afectarea pozitiei bazelor azotate fata de axa spiralei. Planul moleculei colorantului intercalat este dispus normal la axa spiralei si paralel cu planele ce contin moleculele bazelor, astfel incat se realizeaza o conjugare maxima a electronilor π.
Complexarea colorant-biopolimer conduce la marirea conturului si micsorarea masei per unitatea de legare, modificari decelabile prin metode de sedimentare, viscozimetrie si difractia cu raze X.
Estimarea gradului de intercalare se face prin intermediul unghiurilor de torsiune dintre moleculele de colorant si domeniul de intercalare, respectiv perechile de baze adiacente este deocamdata neconcludenta datorita neconcordantei rezultate consemnate in literatura. Studiul intercalarii poate fi condus pe baza depolarizarii fluorescentei, ca masura a transferului de energie intre moleculele de coloranti legate dependent de orientarea reciproca a acestora.
Pe de alta parte, estimarea duratei de relaxare a complexului ADN - colorant, la temperatura inalta, a indicat prezenta a doi complecsi aflati in echilibru, desfasurarea procesului de intercalare implicand doua etape controlate cinetic, respectiv termodinamic.
Primul stadiu presupune interactia electrostatica intre colorantii cationici si grupele fosfat ionizate si energia de activare mica, fiind conditionat de difuzia colorantului in vecinatatea polielectrolitului.
In al doilea stadiu, patrunderea colorantului in spirala polinucleotidica decurge lent, este conditionata de factori sterici si implica energie de activare de 15 kcal/mol, pentru disocierea legaturilor exterioare si invingerea interactiilor dintre perechile de baza.
Distantarea perechilor de baze este o deplasare "tip acordeon" cu mentinerea legaturilor de hidrogen dintre acestea, intercalarea colorantului prezentand caracter anticooperativ. In cazul ADN monocatenar este valabil un model modificat al intercalarii conform caruia moleculele de colorant patrunzand intre perechile de baze provoaca o dublare a distantei dintre acestea, concomitent producandu-se si o rasucire spre interior a grupei fosfat constitutive a lantului polinucleotidic astfel incat sa fie favorizata interactia electrostatica a colorantului cationic.
Adaptarea modelului de intercalare-completa sau partiala se bazeaza pe compararea proprietatilor de echilibru si legare ale colorantilor de ADN nativ si denaturat.
Studiile termodinamice furnizeaza informatii asupra proprietatilor aparente ale legarii pe cand cele cinetice descriu procesul de reactie elementar. In cazul interactiei colorantilor cu ADN nativ sau denaturat se tine seama de gradul de agregare a colorantului precum si de echilibrul si cinetica complexarii cu biopolimerul.
1.Legarea externa
Interactiile electrostatice externe dintre colorantii cationici si polielectroliti implica energii de activare de 2-3 kcal/mol pentru γ=1, fiind influentate de forte Van der Waals, prezenta substituentilor hidrofobi si flexibilitatea catenei polinucleotidice.
La valori mari ale parametrului γ, moleculele de colorant sunt orientate paralel cu cele ale bazelor azotate, ceea ce explica absenta in spectrul de absorbtie a punctului de inflexiune isosbestic caracteristic pentru agregatele de colorant in solutie.
Legarea externa prezinta caracter cooperativ, ocuparea unui loc de legare influentand asupra capacitatii de interactie a locurile vecine.
1.3.Factori determinanti
Interactia acizilor nucleici cu sistemele cromogene heterociclice este conditionata de caracterul cationic si coplanaritatea acestora. Intercalarea colorantului intre perechile invecinate de baze modifica structura secundara a acidului nucleic, ducand la marirea stabilitatii termice a acestuia, efectul fiind mai accentuat in cazul ADN decat ARN.
Natura interactiei colorant-acid nucleic este influentata de structura ordonata si rigida a biopolimerului, determinata de prezenta perechilor de baze azotate. Astfel, numarul locurilor de legare este mai mic in ARN decat in ADN, dependent de marimea domeniilor cu baze imperecheate, care stabilizeaza structura.
Pe de alta parte, legarea colorantilor este mai pregnanta la ADN liniar decat la cel ciclic, fiind influentata si de marimea flexibilitatii catenei macromoleculare prin denaturare. Legarea colorantilor se coreleaza cu compozitia si secventa bazelor.
Astfel, derivatii acridinici prezinta tendinta accentuata de interactie cu polimerii cu continut mare de adenina, in acesta interactie se inregistreaza o descrestere liniara a randamentului de legare al colorantului, paralel cu cresterea continutului in perechi guanina citozina(G≡C). Numarul locurilor de legare depinde de tipul colorantului si tipul acidului nucleic, in cazul legarii interne, respectiv de numarul sarcinilor ionice care asigura neutralitatea electrica, in legarea externa.
Intercalarea unei molecule de colorant determina o rasucire a spiralei ADN cu 12o.
Marirea cantitatii de colorant legat micsoreaza superrasucirea ADN ciclic, fiind posibila chiar o modificare conformationala prin rasucire in sens opus.
Modificarile conformationale ale acizilor nucleici provocate de variatii ale compozitiei ionice, concentratiei si temperaturii explica influenta acestor factori asupra legarii colorantilor. Gradul de legare depinde de taria ionica ceea ce dovedeste contributia fortelor electrostatice. Pe de alta parte, echilibrul dintre legarea interna si externa a colorantului pentru o valoare constanta a parametrului γ depinde de asemenea, de taria ionica.
1.4.Efecte la nivel celular
Patrunderea colorantilor in celule decurge probabil prin difuzie, viteza procesului depinzand de concentratia colorantului, temperatura si starea fiziologica a celulei. Penetrarea colorantului prin membranele celulare, distributia acestuia in celula ca si legarea de biomacromolecule sunt importante in contextul actiunii fotodinamice. Efectul mutagen exercitat de colorantii acridinici se coreleaza in primul rand cu bazicitatea si capacitatea bacteriostatica a acestora. Mutatiile provocate de intercalare se manifesta (in faza de replicare) prin stabilizarea legaturilor de hidrogen in domeniile cu imperechere incorecta a bazelor azotate. In plus, legarea colorantilor acridinici la ADN inhiba sinteza de ARN prin ecranare sterica a ARN - polimerazei, ceea ce explica efectul citostatic al
9-amino-acridinei.
Leziunile produse de coloranti depind de concentratia lor, la valori mici ale acesteia se produc inactivari sau mutatii ale ADN, iar la valori mari sunt afectate si alte componente celulare.
Metacromazie
Interactia colorantilor cationici cu polielectroliti determina modificari spectrale incluse in termenul de metacromazie.
Metacromazia consta in aparitia unei benzi de absorbtie( banda "meta") deplasata hipsocrom fata de maximul de absorbtie al colorantului liber. Acest efect poate fi atribuit diferitelor moduri de legare dintre moleculele de coloranti si polielectroliti.
Interpretarea benzilor de absorbtie arata ca moleculele de colorant se leaga de polimer sub forma de monomer, dar in interiorul acestuia se pot produce fenomene de agregare similare cu cele observate in solutii apoase concentrate.
Fara a fi fost elucidat fenomenul, au fost emise teorii bazate pe studiul echilibrelor si proprietatilor dinamice ale interactiilor colorant-biopolimer in solutii apoase. Baza fizico-chimica a metacromaziei este complexa, comportarea metacromatica depinzand de structura chimica a colorantului si conformatia polimerului. Astfel, modificarile metacromatice ale colorantilor triaril-metanici si acridinici depind de gradul de polimerizare a biopolimerului pe cand cele ale colorantilor triazinici sunt conditionate de natura grupelor functionale din polianion. Modificarea spectrului de absorbtie al unui colorant metacromatic in prezenta unui biopolimer este corelata cu o serie de caracteristici ale polimerului cum ar fi: lungimea si conformatia catenei macromoleculare, factorii sterici, natura, numarul si distributia grupelor functionale sau ionizabile.
Pe de alta parte, interactiile dintre colorant si polimer sunt influentate de factori ca pH, temperatura, taria ionica si raportul molar polimer/colorant(P/D). De deosebit interes sunt interactiile dintre colorantii metacromici si ADN, datorita efectelor mutagene la nivel celular.
1.Aspecte calitative
Interactia colorantilor acridinici (cu acid poli α,L-glutamic) este semnificativa pentru clarificarea rolului structurii polianionului. Tinand seama de modificarile conformationale in solutie apoasa, dependente de pH (elice α la pH<5 si ghem haotic la pH>7) si de variatia constantei de asociere a complexului colorant-polielectrolit cu taria ionica. In prezenta polianionului, agregarea colorantului este influentata de taria ionica, de pH-ul mediului si de raportul P/D. Interactia dintre acridin oranj si acid poli α,L-glutamic decurge in mai multe stadii, formarea agregatelor de coloranti soldandu-se cu modificarea pozitiei si intensitatii benzilor de absorbtie, dupa cum reiese din urmatorul tabel:
|
Natura agregatului |
Banda α λnm |
Banda β λnm |
Banda γ λnm |
Banda polimera λnm |
|
Agregate ale acridin oranjului in solutie apoasa |
- |
|||
|
Complecsi ai acridin oranjului cu acid poli α,L-glutamic |
490 |
La fiecare unitate structurala a polianionului se leaga 4-5 molecule de acridin-oranj, oligomerul colorantului dispunandu-se in exteriorul elicei polimere.
Asocierea a 4-5 molecule de acridin-oranj conduce la identificarea in spectre a benzii γ, an timp ce agregarea in continuare, la inregistrarea benzii "polimere" (535 nm), confirmata prin studii de dicroism circular.
Procesul primar este legarea rapida a cationului colorantului la gruparea carboxilica ionizata din unitatea structurala a polianionului, dupa neutralizarea sarcinii electrice urmeaza o interactie a moleculei colorantului la locuri adiacente, soldata cu formarea de oligomeri si polimeri ai acridin-oranjului, dispusi pe elicea acidului poli α,L-glutamic.
In scopul studierii interactiilor colorantilor cationici cu acizii nucleici s-a utilizat polifosfatul de sodiu, in calitate de model polimer simplificat, astfel incat sa se evite complexitatea structurala a biopolimerilor. Conditiile legarii competitive la polifosfatul de sodiu a colorantilor cationici pot fi inregistrate prin spectroscopie de absorbtie, titrare conductometrica si ultrafiltrare.
Semnificativa este comportarea colorantilor triamino-trifenil-metanici (cristal-violet) si 3,6-diamino-acridinici (proflavina, tripaflavina).
Interactia acestor coloranti cu polifosfatul de sodiu este de natura electrostatica. Desi modul de legare se coreleaza cu prezenta unui carbocation trifenil-metanic sau a unei structuri chinon-iminice, respectiv cu cuaternizarea unui atom de azot heteroacid, se remarca particularitati spectrale chiar in cazul apartenentei la acelasi8 tip structural. Comportarea metacromatica a complecsilor polifosfatului de sodiu cu tripaflavina si cristal-violetul prezinta diferente de natura calitativa, desi o serie de aspecte cantitative sunt similare. Diferenta esentiala consta in prezebta unei benzi de metacromazie la 506 nm in aspectul cristal-violetului legat si absenta acesteia in prezenta tripaflavinei legate de polifosfat de sodiu, la 370-374 nm, inregistrandu-se doar un punct isosbestic.
Deosebirile dintre cei doi coloranti se refera si la variatia pozitiei si intensitatii maximului de absorbtie in prezenta polifosfatului de sodiu. Astfel, banda de la 451 nm a tripaflavinei este deplasata hipsocrom si sufera un efect hipsocrom in timp ce in cristal-violet banda de lungime de unda maximp (592 nm) umarul de la 550 nm si banda de metacromazie (506) nm) raman nemodificate.
Trasaturile spectrale comune includ prezenta spectrelor izobestice (475-479 nm) pentru tripaflavina si 637-639 nm pentru cristal-violet, precum si dependenta modificarilor metacromatice de lungimea catenei polimere (n) si raportul (P/D) (P=polimer, D=dimer).
Dimensiunile critice pentru acesti parametri sunt P/D=2-10 si n=7-20. La valori foarte mari sau foarte mici ale raportului P/D, absorbanta corespunde colorantilor liberi, independent de lungimea catenei macromoleculare.
Implicatiile biologice ale metacromaziei derivatilor acridinici au suscitat interesul pentru studiul corelatiilor dintre structura chimica a colorantilor si natura modificarilor spectrale in prezenta polielectrolitilor. Astfel, substitutia in pozitiile 3,6 ale nucleului acridinic cu grupari electrodonoare (aminice, alchil-aminice) este raspunzatoare de comportarea metacromatica, absenta la derivatii substituiti in pozitia 9 (10)-saruri de metil-acridin-dar pregnanta la colorantii 3,6-diamino-acridinici si sarurile de 9(10)-metil-3,6-diamino-acridin.
Spectrele de absorbtie ale colorantilor acridinici 3,6-disubstituiti simetrici prezinta o singura banda de absorbtie in domeniul vizibil, constiruita din doua componente (polarizate ortogonal, cu structura vibrationala). Acilarea unei grupari aminice, determina aparitia a doua benzi de absorbtie de intensitate apropiata, spectrul inregistrat fiind asemanator cu cel al 3,6-diamino-acridinei legate de polielectroliti.
Micsorarea simetrica moleculara poate fi conditia necesara, dar nu si suficienta pentru o astfel de modificare spectrala, fiind, evident, implicata perturbatoarea sistemului π electronic acridinic, prin conjugare cu gruparile amidice din pozitiile 3 si 6.
Monoacil-amino-acridine si derivati diamino-acridinici simetrici interactioneaza cu domeniile nucleofile ale polimerilor (grupari -COO-, SO3-,-PO43-). Explicarea modificarilor spectrale produse de substituirea grupelor exonucleare si estimarea cantitativa a efectelor inregistrate impun aplicarea metodelor cuanto-chimice.
Estimari cantitative
Metacromazia implica interactii multiple intre coloranti si polianioni, studiul cantitativ al fenomenului comportand determinarea numarului speciilor absorbante si a spectrului pur al componentilor sistemului in echilibru colorant-polimer, in functie de valoarea P/D.
Pozitia benzilor de metacromazie depinde de natura grupelor functionale si conformatia polianionilor ca si de tranzitiile electronice ale colorantului legat. Stabilirea schemei de echilibru in interactiile coloranti-polielectroliti, este posibila fara considerarea concentratiilor de echilibru ale componentilor, prin aplicarea metodei analizei componentului principal (metoda P.C.A.) care presupune cunoasterea concentratiilor initiale si a unui set de spectre de absorbtie. Extinderea acestor metode permite estimarea simultana a numarului speciilor absorbamte in echilibru pentru reactii de neutralizare, dimerizare si agregare. Estimarile pe baza metodei P.C.A. indica prezenta a doua specii de coloranti-liber si legat la valori mici ale raportului P/D respectiv a doua sau mai multe specii de colorant agregat la valori mari ale acestui parametru. Concluziile mentionate (infirma modelul legarii cooperative) si pledeaza pentru un model conform caruia colorantii sunt complexati si agregati in vecinatatea polielectrolitului.
Elucidarea fenomenului de metacromazie este conditionata si de factori ca: stabilirea corelatiilor cantitative, pe baza calculelor cuanto-chimice, intre pozitia benzilor de metacromazie si momentele de tranzitie ale colorantilor legati, precum si de considerarea influentei temperaturii si tariei ionice asupra echilibrelor multicomponente.
1.Spectrul si structura speciilor de coloranti legati
S-au efectuat spectrele de absorbtie pentru sistemele 9-amino-acridina-, cristal- violet-, tripaflavina-polifosfat de sodiu, la valori mari ale raportului P/D. In spectrul pur, al acestor sisteme colorant-polielectrolit se remarca modificari, corelate cu natura speciilor de coloranti legati. Astfel, spectrele de absorbtie ale monomerilor legati prezinta deplasari batocrome slabe fata de maximele de absorbtie ale colorantilor liberi. Aceste deplasari sunt explicabile tinand seama ca benzile de absorbtie ale colorantilor aril-carbonic se atribuie tranzitiilor π→π*, modificate batocrom in prezenta solventilor polari, sau prin formare de legaturi de hidrogen si interactii electrostatice. Efectul batocrom inregistrat este provocat de interactiile colorantului cu grupele ionizate din polifosfatul de sodiu; valoarea mica a deplasarii fiind corelata cu posibilitatile de miscare a monomerului colorantului in vecinatatea polielectrolitului. Spectrele de absorbtie ale dimerului 9-amino-acridinei prezinta o deplasare batocroma slaba, in timp ce spectrele dimerului si tetramerului cristal-violetului, respectiv tripaflavina indica efecte hipsocrome, respectiv batocrome fata de pozitiile benzilor de absorbtie ale colorantilor liberi.
Pozitia si numarul benzilor de metacromazie depind de orientarea momentelor de tranzitie in oligomerii colorantilor, precum si de simetria structurala a acestora.
Teoria excitarii sesizeaza trei moduri de orientare a momentelor de tranzitie in agregatele de coloranti:
orientarea paralela - determina o marire a benzii "meta" deplasata hipsocrom fata de tranzitia corespunzatoare monomerului;
orientare oblica, asimetrica - conduce la formarea a doua noi benzi de absorbtie, deplasate batocrom, respectiv hipsocrom fata de banda de absorbtie originala;
orientare in prelungire - promoveaza o deplasare batocroma.
Dimerul 9-aminoacridinei nu corespunde tipurilor de orientare mentionate.
Spectrele de absorbtie in domeniile U.V. si vizibil ale dimerului legat prezinta
deplasari batocrome, corelate cu orientarea diferita a celor doua perechi de momente de tranzitie: una in prelungire iar cealalta paralela.
Perturbarea simetriei structurale a colorantului prin agregare influenteaza pozitia si numarul benzilor de metacromazie de absorbtie, pe cand una slaba, doar intr-o deplasare a benzii originale.
Dimerii cristal-violetului si tripaflavinei, spre deosebire de cei ai 9-aminoacridinei se caracterizeaza printr-o perturbare accentuata a simetriei, consecinta a interactiilor hidrofobe si electrostatice. Evident si simetria tetramerului este pregnant afectata, banda de absorbtie de lungime de unda mica este puternic deplasata batocrom. Efectul se coreleaza cu intensitatea mare a interactiilor dintre cei patru atomi de azot cuaternizati si polianion. Cu alte cuvinte, conformatia agregatului de colorant, implicit pozitia si intensitatea benzilor de metacromazie depind si de structura polielectrolitului, in special de distanta dintre grupele ionizabile. Interpretarea modificarilor spectrale metacromatice reclama cunoasterea caracteristicilor optice ale colorantului liber, neperturbat. O solutie este oferita de apelarea la tehnicile bazate pe efectul de dicroism, care furnizeaza informatii cantitative asupra proprietatilor spectroscopice si structurale ale colorantilor liberi cat si ale complecsilor acestora cu biopolimerii.
Unele molecule organice prezinta in U.V.-ul spectrului una sau mai multe benzi de absorbtie active (exemplu gruparea C=O)
Spectropolarimetrie
Lucrarile referitoare la fizico-chimia si biochimia interactiilor biopolimerilor cu sistemele cromogene (exogene) impun estimarea efectului Votton, indus in spectrele electronice ale acestora. Pe masura ce frecventa luminii polarizate se apropie de domeniul benzii active, valoarea unghiului α creste atingand un maxim, apoi scade repede trecand prin zero si ajungand la valori negative. Aceasta anomalie poarta numele de efect Cotton.
Aceasta este o metoda de analiza riguroasa a naturii interactiilor ca si a structurilor geometrice si electronice implicate.
Efectul Cotton (de dicroism) consta intr-o absorbtie selectiva, inegala a celor doua componente ale luminii circular polarizate. Dupa parcurgerea unui mediu optic activ, radiatiile circular polarizate spre dreapta sau stanga sunt defazate si au amplitudini diferite (indici de refractie si coeficienti de extinctie diferiti in conditiile unei absorbtii partiale a luminii monocromatice incidente. Astfel, fascicolul luminos emergent este polarizat eliptic, ceea ce explica puterea rotatorie mare, la lungimi de unda corespunzand maximului de absorbtie, pentru complecsii colorati. Curbele de dicroism circular prezinta o distributie gaussiana ingusta, ceea ce face accesibila separarea benzilor corespunzatoare tranzitiilor electronice partial suprapuse datorita cuplajelor vibrationale. Astfel, pot fi sesizate si caracterizate scindarile nedecelabile in spectrele electronice, dar importante pentru evaluarea interactiilor slabe, de tipul celor dintre coloranti si biopolimeri.
Au fost perfectate diferite tehnici, bazate pe metodele directe sau indirecte de inregistrare a dicroismului circular.
Metodele directe presupun masurarea diferentei dintre absorbtiile a doua fascicole de lumina circular polarizate, la trecerea alternativa prin solutia de analizat.
Metodele indirecte implica determinarea unghiului planului de polarizare la conversia, prin intermediul unui cristal anizotrop, a fascicolului polarizat eliptic, transmis de o solutie optic activa, in lumina plan polarizata.
Pozitia, numarul si intensitatea benzilor de dicroism circular depind de tipul interactiilor colorant-biopolimer, natura speciilor de colorant legat, conformatia catenei macromoleculare, valoarea raportului P/D precum si de pH-ul mediului.
Spectrele de absorbtie si dicroism circular pentru sistemul acridin oranj-poli(S-carboximetil-L-cisteina), in apa la pH<7; P/D=1; D=4,94x10-5M; A, pH=2,57; B, pH=2,68; C, pH=2,75; D, pH=2,91; E, pH=3,39; F, pH=3,81.
Astfel, in cazul interactiilor predominant electrostatice dintre acridin oranj si poli(5-carboxi-metil-cisteina) au fost remarcate trei tipuri de spectre de dicroism circular induse de lagarea dimerilor colorantului la polimerul in conformatie β (tip I), dispunerea asimetrica a dimerilor pe polipeptida in conformatie de ghem haotic, la grad mic de ionizare (tip II) si legarea dimerului de polimer in conformatie de ghem haotic, la grad de ionizare mare si valori mici ale raportului P/D (tip III). Aplicarea tehnicii dicroismului (continuu) in cazul sistemului acridinoranj-ADN a permis stabilirea pozitiei reciproce a colorantului si bazelor azotate. Masuratorile de dicroism (continuu) au indicat o orientare paralela a planului colorantului acridinic fata de cel al bazelor azotate constitutive ale ADN. Grupele fosfat si spatiile libere dintre perechile de baze adiacente actioneaza ca locuri de legare. Benzile de dicroism circular corespunzatoare componentelor vibrationale ale colorantului, ce dobandeste activitate optica datorita mediului asimetric din ADN, se pot atribui, dependent de valoarea raportului P/D, monomerilor colorantului perturbati de dezoxiriboze sau interactiei excitare a dimerilor.
Semnele benzilor de dicroism sunt determinate de configuratia sterica a complecsilor, fiind influentate de natura locurilor de legare din elicea ADN, ca si de orientarea moleculelor in dimer.
Dicroismul liniar ca absorbtie preferentiala a luminii monocromatice incidente liniar polarizate paralel si perpendicular pe directia de orientare a unui ansamblu de molecule orientate unidirectional ofera informatii asupra unghiului dintre axa moleculara si directia momentului de tranzitie a cromoforului cu implicatii majore in interpretarea spectrelor de absorbtie (izotropice). Orientarea moleculelor in solutie prin aplicarea unor campuri electrice continue nu este adecvata pentru structuri globulare, flexibile sau de dimensiuni mici, fiind indicata tehnica dicroismului in film. Metoda consta in tensionarea mecanica, pe directie normala la directia de propagare a luminii incidente polarizate, a unui film confectionat din alcool polivinilic dupa includere prealabila, prin dizolvare sau dispersare, a compusilor de studiat. Interpretarea spectrelor polarizate paralel si perpendicular in sisteme ideale, pentru diferite valori ale factorului de tensionare Rs, se bazeaza pe stabilirea dependentei dicroismului redus si coeficientului dicroic de lungimea de unda. Aplicarea dicroismului in film a permis evidentierea modificarii metacromatice a 10-metil-acridinoranjului in prezenta α-poli (acidului L-glutamic).
Spectrele polarizate ale complexului colorant-polimer la tensionare mecanica adecvata difera de cele corespunzatoare colorantului in film umed de alcool polivinil, remarcandu-se intensitatea mai mare a absorbtiei polarizate perpendicular fata de cea polarizata paralel, pe intregul domeniu spectral, exceptand banda de 500 nm.
Presupunand ca axa de orientare a complexului colorant-polimer la tensionare mecanica coincide cu directia catenei polimere, rezulta ca axa lunga a planului colorantului legat ar trebui sa fie perpendiculara pe lantul macromolecular, in timp ce axa mica ar forma cu aceasta un unghi de minimum 54,7°. Estimarea exacta a geometriei locurilor de legare implica considerarea conformatiei polielectrolitului in filmul de alcool polivinil.
Atribuirea corecta a tranzitiilor electronice polarizate benzilor de absorbtie inregistrate contribue nu numai la elucidarea configuratiei sistemelor cromogene ci si la explicarea unor interactii ale acestora cu biopolimerii.
3.Fluorimetrie
Dificultatea interpretarii spectrelor de dicroism circular datorita suprapunerii unor tranzitii electronice sau modificarii acestora prin dimerizarea colorantilor a adus in atentie utilizarea fluorimetriei pentru studiul interactiilor dintre derivatii acridinici si acizii nucleici.
Spre deosebire de spectrul de absorbtie, spectrul de fluorescenta al unei structuri condensate implica o singura tranzitie electronica de la cea mai joasa stare excitata singlet la starea fundamentala. Pe de alta parte este posibil sa se puna in evidenta si chiralitatea moleculelor fluorescente prin polarizarea circulara a luminiscentei, factorul de anizotropie, gem, fiind de forma:
gem = Δf
f/2
in care F reprezinta intensitatea luminii emise, iar Δf fractiunea polarizata circular din lumina emisa.
In timp ce factorul de anizotropie al absorbtiei caracterizeaza conformatia moleculelor in stare fundamentala, factorul de anizotropie al emisiei da indicii supra conformatiei moleculare cu stare excitata, fiind posibila caracterizarea fotofizica si fotochimica a complecsilor dintre sistemele cromogene si biopolimeri.
Adoptarea modelului intercalarii (Lerman) pentru interactia colorantilor acridinici cu ADN ofera premisa considerarii transferului de energie intre bazele azotate, in calitate de donori si moleculele de colorant, ca acceptori, fenomen ce poate fi studiat prin intermediul luminiscentei complecsilor cu excitare in domeniul de absorbtie al ADN.
In formarea radicalilor fotosensibilizati ai complecsilor sunt implicate starile triplet ale colorantilor acridinici. Studiul luminiscentei complecsilor colorant-ADN in mediu apos, la 77K, ca si compararea spectrelor de emisie cu cele de absorbtie au atras atentia asupra rolului colorantilor in stare monomera.
Astfel, fluorescenta intarziata a fost corelata cu anihilarea triplet-triplet intre doua molecule de colorant excitate, invecinate, efectul fiind atenuat in prezenta ADN, ceea ce dovedeste implicarea interactiunii cu biopolimerul si necesitatea considerarii conformatiei compusului macromolecular.
De asemenea, s-a pus in evidenta fluorescenta intarziata sensibilizata datorita transferului de energie triplet-singlet de la baze purinice si pirimidinice, nucleozide, nucleotide si polinucleotide la coloranti acridinici. Transferul de energie depinde de diferenta dintre nivelele energetice ale donorului si acceptorului. In formarea complecsilor ADN-coloranti acridinici un rol esential revenind starii triplet a timinei din constitutia acidului nucleic. Pe de alta parte, transferul de energie este influentat de conformatia macromoleculara, fiind atenuat in cayul aciyilor nucleici denaturati.
Analiya spectrelor de emisie totala si intaryiata a sistemelor proflavina+adenoyin+dinucleotida, respectiv acid poliadenilic ofera indicii referitoare la mecanismul transferului de energie in complecsii colorantilor acridinici cu nucleotidele, ca si criterii de apreciere a rolului conformatiei macromoleculare.
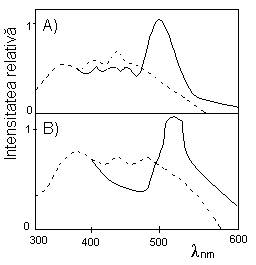
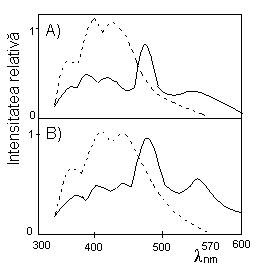
Spectre de emisie totala pentru sisteme Spectre de emisie intarziata pentru
apoase congelate de proflavina si nucleotide sisteme apoase congelate proflavina-
A) Adenil-3';5'-adenozina-proflavina; A)Adenil-3';5'-adenozina-proflavina;
B)acid poliadenilic-proflavina; B)acid poliadenilic-proflavina;
- - - in absenta colorantului; - - - in absenta colorantului;
___in prezenta colorantului; conc.5x10-5M ___in prezenta colorantului
pentru proflavina si 5x10-3M unitati de
adenina
In absenta colorantului picul de la 340 nm se atribue fluorescentei adeninei, in timp ce banda de la 390-500 nm se coreleaza cu fluorescenta bazei purinice. In prezenta proflavinei se remarca emisiile intarziate constituite din fluorescenta adeninei la 490 nm si fluorescenta derivatului acridinic la 570 nm, aspectul spectrului de fluorescenta intarziata sensibilizata se coreleaza cu transferul de energie de la starea triplet a restului de adenina la starea singlet a proflavinei.
Eficineta cuantica a fosforescentei bazei azotate, se estimeaza in functie de randamentul cuantic al fluorescentei sensibilizate intarziate, eficienta transferului de energie si randamentul cuantic al fluorescentei colorantului. Eficienta transferului de energie se apreciaza pe baza raportului dintre fluorescenta si fosforescenta bazei azotate in prezenta colorantului si in absenta acestuia. Fluorescenta sensibilizata intarziata poate fi corelata si cu transferul de energie triplet-triplet, atestat in cazul dinucleotidelor si al amestecurilor de nucleotide. Examinarea sistemelor ce contin proflavina si adenil-3';5'-citidina (ApC), adenozin monofosfat-citidin monofosfat (AMP+CMP) sau adenozin monofosfat-timidin monofosfat (AMP+TMP) este edificatoare in acest sens:
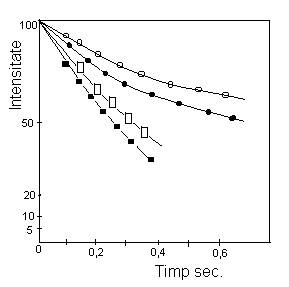
Curbe de extinctie a fluorescentei sensibilizate intarziate
![]() adenozin
monofosfat-proflavina
adenozin
monofosfat-proflavina
![]() citidin
monofosfat-proflavina
citidin
monofosfat-proflavina
![]() adenozin
monofosfat-citidin monofosfat-proflavina
adenozin
monofosfat-citidin monofosfat-proflavina
![]() adenil
3';5'-citidina-proflavina;
adenil
3';5'-citidina-proflavina;
concentratia nucleotidelor 5x10-9M
concentratia colorantului 5x10-5M.
In cazul ApC sau amestecurilor de mononucleotide se observa o scadere a intensitatii fosforescentei adeninei si o crestere a acestui parametru pentru citozina si timina; paralel, decelandu-se o extinctie mai rapida a fluorescentei sensibilizate fata de AMP. Interpretarea acestor efecte reclama considerarea transferului energiei triplet intre bazele azotate, urmat de transferul triplet-singlet de la CMP sau TMP la colorantul acridinic. Comparatia fluorescentei de injumatatire ca masura a constantelor de viteza la extinctia fluorescentei, ApA, poly-A si AMP, a indicat valori mai mici pentru primele doua sisteme, datorita probabil, diferentei de conformatie intre monomerul si polimerii acidului adenilic.
Modificarea proprietatilor de emisie ale colorantului evidentiata prin complexare cu ADN, implica tranzitii conformationale ale acidului nucleic, ca si interactiile dintre moleculele de colorant in vecinatatea biopolimerului, corelate cu legarea interna sau externa si dimerizarea.
Colorantul legat nu este uniform distribuit in ADN, ci formeaza agregate,in special dimeri. Procesul este favorizat de congelarea solutiilor. La temperaturi cuprinse intre 77 si 150K spectrul de luminiscenta al sistemului acridin-oranj-ADN se caracterizeaza printr-o banda de fosforescenta la 620 nm si benzi de emisie dependente de valoarea raportului P/D. Astfel, la valori mari ale acestui raport si temperaturi ridicate se inregistreaza o banda de fluorescenta termica intarziata situata la 530 nm, pentru ca la micsorarea valorii P/D sa se identifice o noua banda de emisie la 640 nm, valoare apropiata de cea corespunzatoare dimerului colorantului acridinic in solutie apoasa.
Luminiscenta complecsilor in domeniul 77-150K este rezultatul a doua procese: excitarea termica a starii triplet a dimerului (sub forma de excimer) si aparitia excimerului dupa excitarea termica a starii triplet a monomerului colorantului la prima stare excitata singlet. In contextul intercalarii complete distanta dintre moleculele de colorant legate este de 10,2Å, presupunand excluderea locurilor de legare adiacente in timp ce aceasta distanta este de 3,4Å la intercalarea partiala. Orientarea (mutuala) si extinderea acoperirii moleculelor adiacente de colorant sunt categoric implicate in formarea excimerului.
Pe de alta parte, particularitatile transferului de energie triplet-singlet si triplet-triplet dintre bazele ADN si colorantii acridinici la 77K pledeaza pentru similitudine structurala a complecsilor la diferite temperaturi. Pe baza considerarii distantei dintre doua molecule de colorant legate, modelul intercalarii partiale pare favorabil formarii excimerului. De interes major sunt studiile referitoare la interactiile 9-amino-acridinei cu acizii nucleici, tinand seama de proprietatile mutagene marcante ale acestui colorant. Astfel, s-a stabilit ca perechea de baze guanina-citozina atenueaza fluorescenta 9-amino-acridinei, dupa legare de ADN, in timp ce perechea adenina timina o argumenteaza. In general curbele de extinctie a fluorescentei prezinta trei domenii (exponentiale) datorate heterogenitatii locurilor de emisie, dupa legarea de acidul nucleic.
Elucidarea naturii interactiilor dintre colorantii acridinici si ADN presupune studii pe modele: polinucleotide sintetice si mononucleotide.
Mononucleotidele purinice determina o intensificare a extinctiei fluorescentei, proprietatile de emisie ale 9-amino-acridinei depinzand de prezenta grupei 6-aminice in adenina, libera sau angajata in legaturi de hidrogen. Explicarea naturii interactiilor dintre 9-amino-acridina si restul de adenina este posibila prin interpretarea modificarii spectrului de fluorescenta la complexare cu acid poliriboadenilic, care sufera tranzitii conformationale dependente de pH, temperatura si tarie ionica. Studiile de fluorimetrie au fost efectuate pentru valori mari ale raportului P/D (P/D>400), cand concentratia colorantului este neglijabila.
4.Interactii coloranti-enzime
Enzimele actioneaza in mediul celular intr-o ambianta heterogena dar in cicluri de reactii bine definite care implica o stricta specificitate de substrat si de actiune.
Legatura dintre substrat si enzima este temporara, instabila, desfacandu-se dupa ce s-a produs modificarea imprimata de enzima.
In formatii utile ofera studiile de blocare, inhibare, activare+inactivare selectiva a enyimelor. Astfel de investigatii clarifica o serie de aspecte structurale, ca si unele mecanisme metabolice sau de actiune a substantelor bioactive.
In acest context, interactiile dintre enzime si sisteme cromogene constitue un instrument adecvat de abordare a problematicii referitoare la compatibilitatea structurala, identificarea si caracterizarea centrului activ, precum si a modificarilor induse in aceasta prin complexare.
Un cromogen corespunzator s-a dovedit a fi proflavina, inhibitor competitiv pentru α-chimiotripsina si tripsina datorita similitudinii structurale cu substratul specific enzimei. α-chimiotripsina este o proteaza care prezinta conformatii diferite si implicit activitate modificata in functie de variatiile pH-ului.
In timp ce tranzitia de la conformatia activa la pH neutru la cea inactiva in mediu alcalin se produce la pH=8,8, pierderea activitatii catalitice la pH acid se atribue fie penetrarii grupei carboxilice terminale din lantul β al α-chimiotripsinei intr-o zona activa a altei enzime, fie protonarii grupei β-carboxilice printr-o punte salina, ceea ce poate provoca izomerizarea in interiorul sau in vecinatatea sistemului activ al enzimei. Interactiile proflavinei cu α-chimiotripsina sunt importante pentru clarificarea mecanismului de legare a substratului la centrul activ al enzimei. Astfel de interactii se deceleaza spectral prin deplasarea maximului de absorbtie al colorantului de la 444 la 460 nm.
5.Efectul fotodinamic
Efectul fotodinamic este o fotooxidare a biomacromoleculelor sensibiliyate de sisteme cromogene heterociclice condensate.
Se diferentiaya trei tipuri de mecanisme de producere a efectului fotodinamic. Mecanismul de tip I (intrinsec) presupune transmiterea energiei luminoase absorbite de colorant componentelor celulare dupa legarea de acestea, neexistand interferente intre modificarea sistemului cromogen si inactivarea biomoleculelor. Mecanismul de tip II (extrinsec) implica modificarea colorantului sub actiunea luminii vizibile si inducerea fotooxidarii soldate cu legarea componentelor celulare, nefiind obligatorie legarea preliminara a sensibilizatorului de substrat.
Fara a fi un efect fotodinamic propriu-zis deoarece nu necesita prezenta oxigenului, mecanismul de tip III conduce la leziuni celulare prin aditia derivatilor furocumarinici la bazele pirimidinice constitutive ale ADN. Problematica circumscrisa efectului fotodinamic profund ancorata in biologia moleculara, vizeaza interactii fizico-chimice, absorbtia optica si transferul de energie. Conform conceptului fizico-chimic, efectul fotodinamic implica, in prima etapa, excitarea colorantului prin absorbtia energiei electronegative in domeniul vizibil. Punctele de vedere referitoare la natura starii exccitate sunt contradictorii. Se pare ca raspunzatoare de efectul fotodinamic este cea mai joasa stare triplet, care se formeaza cu eficienta cuantica mare, prezinta timp de viata lung si posibilitatea participarii la procese redox fotodinamice. Investigarea fizico-chimica a procesului fotodinamic pe sisteme model (colorant-oxigen-substrat-apa) a indicat posibilitatea legarii colorantului excitat de substrat, urmata de o fotooxidare sensibilizata a acestuia.
Fotosensibilizarea biostructurilor cu coloranti acridinici si xantenici, in prezenta oxigenului, conduce la formarea a doua tipuri de radicali liberi decelabili prin rezonanta paramagnetica a electronului. Prima categorie de radicali (R) se formeaza prin mecanism difotonic, fiind similari cu cei rezultati prin actiunea radiatiilor ionizate. Cea de-a doua categorie este reprezentata de radicalii peroxidici (ROO·) formati in prezenta moleculelor de oxigen electrono-excitabile. La nivelul nucleotidelor au fost decelati radicali liberi, indusi prin mecanism difotonic, localizati in bazele azotate, ca si radicali generati in proces fotodinamic, apartinand formelor radicalice oxidate ale pentozei constitutive.
Localizarea distructiilor biochimice produse de efectul fotodinamic a fost intensiv studiata si bine caracterizata, desi mecanismul chimic nu este elucidat. Se admite, insa, ca fotooxidarea sensibilizata de coloranti este factorul declansator al inactivarilor inregistrate la nivel celular. Susceptibilitatea la fotooxidare sensibilizata este diferita pentru proteine, polipeptide si aminoacizi, fiind pregnanta la metionina, histidina, triptofan si cisteina, in stare libera sau in catene peptidice.
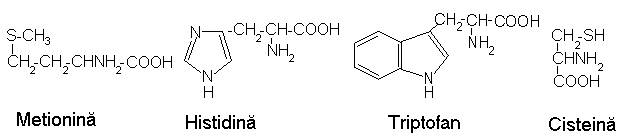
Sunt sensibile la fotooxidare, puntile disulfitice -S-S-. Modificarile structurale determinare de scindarea puntilor se soldeaza cu alterari fizico-biologice ale proteinelor manifestate in diminuarea activitatii enzimatice, afectarea proprietatilor antigenice sau ale toxinelor bacteriene, perturbarea activitatii anticorpilor si hormonilor proteici. Pe de alta parte, tranzitiile conformationale micsoreaza sensibilitatea la fotooxidare a unor domenii constitutive ale biosistemelor, deosebirile de reactivitate estompandu-se prin denaturare. Astfel, este posibila distructia oxidativa a aminoacizilor enzimelor sau pierderea stabilitatii conformationale a acestora.
Metionina este oxidata de majoritatea colorantilor fotosensibilizatori la sulfoxid.
Histidina da produsi de scindare a ciclului imidazolic la nivelul legaturii enaminice.
La fotooxidarea triptofanului se formeaza un amestec complex de produsi, reactia implicand ruperea legaturilor enaminice datorita actiunii oxigenului singlet.
Oxidarea sensibilizata de albastru de metilen a tirozinei afecteaza ciclul fenolic. Cisteina se oxideaza lent la acid cisteinic, fiind posibila si formarea cistinei.
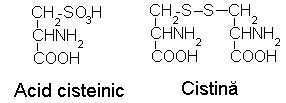
Studiul reactivitatii proteinelor si peptidelor a condus la constatarea ca oxidarea metioninei sau histidinei din constitutia centrilor activi ai unor enzime poate fi implicata in activitatea acestora. Se pare ca fotooxidarea enzimelor implica ca intermediar activ oxigenul singlet, punandu-se in evidenta inactivarea sensibilizata a tripsinei de catre coloranti acridinici, xantenici si tiazinici si fosfatazei alcaline.
Oxidarea lipidelor constitue cauza detensionarii membranelor cum ar fi de exemplu, fotooxidarea colesterinei din eritrocite, in porfirii:
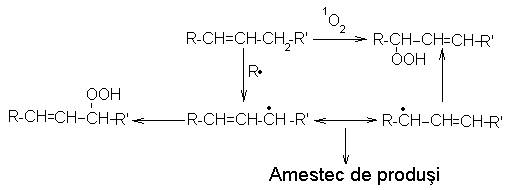
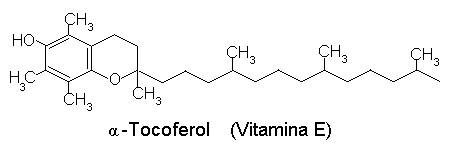
Tocofenolii pot exercita un efect de protejare a lipidelor in distructiile oxidative, datorita participarii la reactii de fotooxidare cu oxigen singlet.
Polizaharidele sunt fotooxidate in prezenta sensibilizatorilor cetonici, cu formare de cetone sau acizi si micsorarea masei moleculare. Produsii primari de fotooxidare sensibilizata a acizilor nucleici au fost studiati in mica masura. S-a stabilit totusi susceptibilitatea marita la oxidare a guaninei, precum si sediul degradarii oxidative, anume legaturile duble enaminice constitutive ale bazelor si nucleozidelor. Distructia chimica a componentilor ADN si ARN indusa la sistemele constituite din cromozomi-lumina-oxigen afecteaza proprietatile fizice si biologice ale acizilor nucleici (micsorarea coeficientului de sedimentare a viscozitatii si a temperaturii de topire).
Aceste modificari sunt corelate cu tranzitiile conformationale si depolimerizarea produsilor prin scindari.
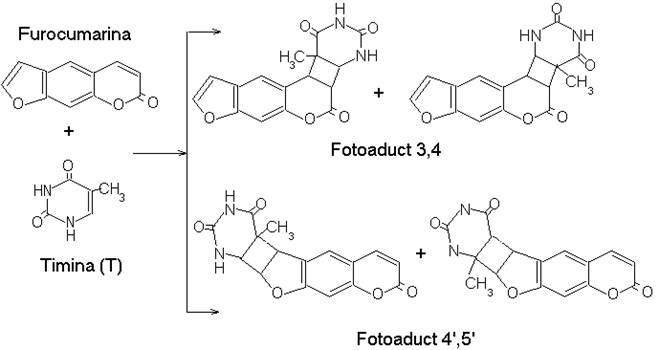
Furocumarinele (derivati ai psoralenului) dau ciclofotoaducti cu bazele pirimidinice, sub actiunea luminii de λ=365 nm, cu participarea legaturilor nesaturate corespunzatoare pozitiilor 3,4 sau 4',5' din agentul fotosensibilizator si 5,6 din baza azotata, reactia producandu-se si in absenta oxigenului.
Cei doi fotoprodusi prezinta caracteristici de absorbtie diferite. Prin iradiere la 365 nm este excitat doar aductul 4',5' care poate servi ca agent bifunctional, de reticulare a catenelor de ADN, dependent, evident si de factori sterici.
Legaturile transversale datorate fotoaductilor stabilizeaza ADN-ul prin marirea temperaturii de topire si capacitate limitata de denaturare si renaturare, efectul fiind pregnant la nivelul celulelor epidermei.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |