CALORIMETRIE
1. Scopul lucrarii
In aceasta lucrare se va determina echivalentul in apa al calorimetrului, utilizandu-se si de corectia de temperatura.
2. Consideratii teoretice
Calorimetria este o parte a fizicii care studiaza si metodele de masurare a cantitatilor de caldura. Dupa cum se stie, in sistemul international, unitatea de masura pentru caldura este 1 Joule. In practica se foloseste o unitate tolerata: caloria de 15°, ce reprezinta cantitatea de caldura necesara unui gram de apa pura, lipsita de aer, pentru a-si ridica temperatura cu 1°C (de la 14,5°C la 15,5°C) printr-o incalzire izobara (sub presiunea de o atmosfera):
Cal15 = 4,1855 J
Masuratorile calorimetrice se bazeaza pe doua principii:
Principiul schimbului de caldura : cand se produce un schimb de caldura intre doua corpuri, cantitatea de caldura cedata de un corp este egala cu cea primita de celalalt corp.
Principiul transformarilor inverse: cantitatea de caldura pe care o absoarbe un corp, intr-o transformare, este egala cu cea degajata de acel corp in transformarea inversa.
Schema celui mai
simplu calorimetru este prezentata in figura alaturata. 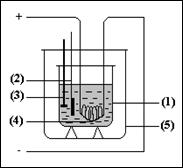 El este format
dintr-un vas metalic (1) in care se gaseste un lichid oarecare (de
obicei, apa). In acest vas se gaseste un termometru (2), un
agitator (3) (cu rol in uniformizarea temperaturii) si o
rezistenta electrica (4). Vasul (1) este introdus in alt vas
(5), astfel ca intre ele se afla un strat de aer izolator termic ce
are rolul de a impiedica pierderea caldurii prin transmisie.
El este format
dintr-un vas metalic (1) in care se gaseste un lichid oarecare (de
obicei, apa). In acest vas se gaseste un termometru (2), un
agitator (3) (cu rol in uniformizarea temperaturii) si o
rezistenta electrica (4). Vasul (1) este introdus in alt vas
(5), astfel ca intre ele se afla un strat de aer izolator termic ce
are rolul de a impiedica pierderea caldurii prin transmisie.
Dintre metodele folosite pentru masurarea cantitatiilor de caldura vom studia metoda amestecurilor, aplicata pentru prima oara de Richmann. Principiul acestei metode este de a ceda caldura ce trebuie determinata unei cantitati date de apa dintr-un calorimetru si de a masura cresterea de temperatura a acesteia. Metoda amestecurilor necesita mai multe corectii datorita faptului ca temperatura calorimetrului variaza in timpul experimentului, iar apa absoarbe numai o parte din caldura primita, restul fiind preluata de calorimetru si accesoriile acestuia.
Fie M masa apei din calorimetru, m1 masa calorimetrului, m2 masa termometrului si m3 masa agitatorului. Prin absorbirea unei cantitati de caldura Q, temperatura va deveni in final tf. Aceasta cantitate de caldura se distribuie apei, vasului calorimetric si accesoriilor sale, deci va avea expresia:
Q = (Mc + m1c1 + m2 c2 + m3c3) (tf - t0) (1)
unde: c = 4180J/kg grd este caldura specifica a apei, c1 - caldura specifica a vasului calorimetric, c2 - caldura specifica a termometrului, c3 - caldura specifica a agitatorului.
Marimea E = ∑mici se numeste echivalentul in apa al calorimetrului deoarece este echivalenta cu capacitatea calorica a unei anumite cantitati de apa ce s-ar adauga apei din calorimetru.
Masa de apa din calorimetru este incalzita prin trecerea unui curent electric de intensitate I la tensiunea U prin rezistenta de incalzire un timp τ . Din legea lui Joule, caldura va avea expresia:
Q = UIτ (2)
Deci,
UIτ = (Mc +E) (tf - t0) (3)
Din aceasta relatie se poate afla expresia echivalentului in apa al calorimetrului:
E = UIτ/ tf - t0 - Mc (4)
3. Dispozitiv experimental
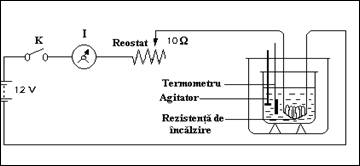
Se realizeaza dispozitivul experimental din figura de mai jos, pentru care sunt necesare urmatoarele componente:
sursa de tensiune de 6-12-24V
rezistente de imersie R de diferite valori:
ampermetru
reostat Rh
intrerupator
4. Mod de lucru
Etapele realizarii experimentului sunt urmatoarele:
se pune in calorimetru o cantitate de M = 300g apa distilata si se masoara temperatura initiala;
se conecteaza rezistenta incalzitorului la sursa de curent electric masurandu-se timpul precum si intensitatea si tensiunea curentului;
se masoara temperatura finala, tf;
se calculeaza E cu formula (4), tinandu-se cont de corectia temperaturii finale.
datele se trec intr-un tabel de forma:
|
U(V) |
I(A) |
τ (s) |
tf |
t0 |
E(J/K) |
5. Corectia de temperatura
Avand in vedere ca izolarea termica nu este perfecta, din calorimetru se pierde o cantitate de caldura, totul petrecandu-se ca si cand temperatura finala la care se ajunge ar fi mai mica cu Δt fata de cea reala, in cazul unei izolari perfecte. Cu aceasta corectie, valoarea de calcul a temperaturii finale intr-o masuratoare calorimetrica este tf' = tf + Δt, unde tf este temperatura finala masurata.
Calculul corectiei se va face astfel:
se incalzeste apa din calorimetru cu 2-3 sC peste temperatura mediului ambiant, temperatura apei fiind t1.
se lasa sa treaca un timp τ1 (cateva minute) si se citeste noua temperatura t2 la care a ajuns sistemul ca urmare a pierderilor de caldura. Aceste masuratori se fac inainte de inceperea experientei propriu-zise.
dupa terminarea experientei si citirea temperaturii finale careia i se aplica corectia, se citeste din nou o temperatura t3
se asteapta sa treaca un timp τ2 pana ce temperatura a scazut la t4. Intrucat pierderea de caldura nu este uniforma in timp, se va face o medie, astfel incat variatia medie de temperatura in timp de o secunda va fi:
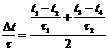
![]() ( 5 )
( 5 )
se masoara timpul t cat a durat experienta
se calculeaza corectia de temperatura, t .
rezultatele corectiei se trec in tabelul:
|
t1 |
t2 |
t3 |
t4 |
Δt/τ |
||
Rezultatul final al experimentului se va scrie sub forma stiintifica:
E = E + sE
unde sE reprezinta abaterea patratica medie a echivalentului si se calculeaza cu formula:
![]()
Constantele t si E fiind determinate, se pot folosi ori de cate ori se fac masuratori calorimetrice cu calorimetrul respectiv, in conditia folosirii aproximativ aceleasi cantitati de apa. Bineinteles, este nevoie sa se masoare de fiecare data timpul cat a durat procesul pana la stabilirea temperaturii de echilibru.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |