Cinetica electrochimica
Traversarea interfetei conductor electronic-conductor ionic, care reprezinta un electrod, se poate face in doua situatii distincte: la echilibru sau in conditii de neechilibru.
La echilibru, fluxul sarcinilor electrice intr-un sens este egal cu fluxul sarcinilor electrice in sens invers. Cele doua fluxuri de sarcini electrice reprezinta doi curenti partiali egali si de sens contrar, astfel incat curentul net care traverseaza interfata este nul. Valoarea absoluta a acestor curenti partiali poarta numele de curent de schimb io (se subintelege ca io reprezinta in realitate o densitate de curent). Pentru semnul curentilor se adopta conventia conform careia curentul in sens anodic este pozitiv, iar curentul in sens catodic este negativ.
Daca sistemul electrochimic considerat nu este in echilibru, cei doi curenti partiali nu sunt egali, suma lor algebrica reprezinta un curent net care traverseaza interfata. Traversarea interfetei de un curent net duce la deplasarea potentialului electrodului de la valoarea de echilibru. Acest fenomen de deplasare a potentialului unui electrod de la echilibru se numeste polarizare. Valoarea polarizarii, h, este data de diferenta dintre potentialul electrodului polarizat e(i) si potentialul electrodului la curent nul e
h e(i) e (1)
Daca pe electrod are loc un singur proces, polarizarea este numita suprapotential, care este dat de diferenta dintre potentialul electrodului polarizat e(i) si potentialul reversibil al electrodului erev
h e(i) erev (2)
Aparitia polarizarii este datorata desfasurarii cu viteza finita a procesului de electrod. Dar un proces global de electrod se desfasoara in mai multe etape, oricare dintre ele putand fi etapa determinanta a vitezei procesului global de electrod.
Etape posibile in desfasurarea unei reactii de electrod:
- transportul de masa;
- transferul de sarcina;
- reactia chimica;
- electrosorbtia sau desorbtia;
- formarea unei noi faze (solide - electrocristalizarea sau gazoase - degajarea unui gaz).
În functie de etapa determinanta de viteza se deosebesc urmatoarele tipuri de suprapotential:
- suprapotential de transfer de sarcina,
- suprapotential de transport de masa,
- suprapotential de reactie,
- suprapotential de cristalizare.
Aparitia suprapotetialului se poate datora si desfasurarii cu viteza finita a mai multor etape ale procesului global de electrod (suprapotential mixt).
Suprapotentialul de transfer de sarcina
Suprapotentialul de transfer de sarcina apare in situatia in care procesul global de electrod este controlat cinetic de etapa de transfer de sarcina, celelalte etape ale procesului global desfasurandu-se la echilibru. Dependenta densitatii curentului i care traverseaza electrodul de suprapotentialul de transfer de sarcina este data de relatia Butler-Volmer:
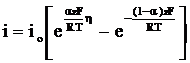 (3)
(3)
in care:
io - densitatea de curent de schimb, A×m-2
a - coeficient de transfer in sens anodic,
1-a - coeficient de transfer in sens catodic, cunoscut si sub numele de factor de simetrie (b
Coeficientii de transfer a si 1-a reprezinta fractiunea din lucrul electric efectuat pentru transferul particulei incarcate prin interfata in sens anodic sau catodic, necesar aducerii acesteia in planul de reactie in care energia potentiala a particulei este maxima.
Uzual relatia Butler-Volmer se particularizeaza pentru doua domenii ale suprapotentialelor: domeniul suprapotentialelor mari si domeniul suprapotentialelor mici, functie de raportul dintre h si RT/F.
In domeniul suprapotentialelor mari la polarizare anodica (h > 0) si h > 100 mV), relatia (3) devine:
![]() (4)
(4)
sau daca se transforma logaritmii naturali in logaritmi zecimali:
![]()
Se obtine astfel o dependenta de tip Tafel a suprapotentialului de transfer de sarcina de densitatea curentului net care traverseaza electrodul:
h= a + b×lg i (6)
Valorile parametrilor a si b sunt date de relatiile:
![]() (7)
(7)
![]() (8)
(8)
La polarizare catodica, in domeniul suprapotentialelor mari (h<0 si ïhï>100 mV), relatia (3) devine:
![]() (9)
(9)
respectiv:
![]() (10)
(10)
Se obtine o dependenta de tip Tafel de forma:
h = a + b×lg ïiï (11)
in care parametrii a si b sunt dati de relatiile:
![]() (12)
(12)
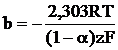 (13)
(13)
In domeniul suprapotentialelor mici (ïhï< 10 mV) relatia (3) devine:
![]() (14)
(14)
in care raportul RT/zFio reprezinta rezistenta la transfer.
Curentul de schimb io depinde de conditiile concrete in care se gaseste electrodul. De exemplu, in cazul unui echilibru redox, curentul de schimb este functie de concentratia oxidantului (cOx) si de concentratia reducatorului (cR), conform relatiei:
![]() (15)
(15)
in care ks este constanta de viteza standard.
Pentru procesele de electrod lente, parametrii cinetici io (curent de schimb) si a, respectiv 1-a (coeficienti de transfer) se determina prin metoda pantei Tafel. Aceasta consta in reprezentarea grafica a dependentei h functie de lg i pentru procese anodice sau functie de lg êi ê pentru procese catodice. Din panta portiunii drepte se determina parametrul b din relatia lui Tafel, din care pe baza relatiilor (8) sau (13) se calculeaza coeficientul de transfer. Din valoarea ordonatei la origine a se calculeaza curentul de schimb io, pe baza relatiilor (7) sau (12). Curentul de schimb depinde de conditiile de lucru in care se gaseste electrodul.
In cazul in care reactiile electrochimice sunt rapide, avand o constanta de viteza standard care depaseste 2×10-2 cm×s-1, dependenta curentului de potentialul electrodului nu mai respecta ecuatia Butler-Volmer sau ecuatiile derivate din aceasta, iar pentru determinarea parametrilor cinetici se aplica metode electrochimice de relaxare, cum sunt: metoda potentiostatica, metoda galvanostatica si metoda impedantei Faraday.
Suprapotentialul de transport
Daca procesul global de electrod este controlat cinetic de etapa de transport a particulelor electroactive din solutie la electrod sau a produsilor de reactie de la electrod spre solutia de electrolit, suprapotential care apare este numit suprapotential de transport.
De exemplu, in cazul procesului de reducere catodica a ionilor unui metal:
Mz+ + ze- M (16)
transportul particulelor electroactive Mz+ din solutie la electrod se poate realiza prin difuzie, migrare sau convectie. Daca transportul se face exclusiv prin difuzie, densitatea curentului net care traverseaza catodul in conditii stationare (gradient de concentratie constant) este data de relatia:
![]() (17)
(17)
in care D este coeficientul de difuzie, m2×s-1
d - grosimea stratului de difuzie, m
co - concentratia particulelor electroactive in solutia de electrolit, mol×m-3
c - concentratia la interfata, mol×m-3
Valoarea maxima a densitatii curentului de difuzie pura, numita 'curent limita de difuzie' sau simplu 'curent de difuzie' (id), se obtine cand concentratia particulelor electroactive de la interfata c este nula:
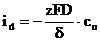 (18)
(18)
Pentru ca transportul ionilor Mz+ din solutie la electrod sa se realizeze prin difuzie pura este necesar ca in solutie, alaturi de particulele electroactive, sa existe un electrolit a carui ioni, in concentratie mult mai mare decat concentratia particulelor electroactive, participa doar la transportul curentului electric prin solutie, nu si la procesele de electrod.
In mod obisnuit transportul particulelor electroactive se face atat prin migrare, cat si prin difuzie si convectie. In cazul in care se iau masuri pentru impiedicarea convectiei, densitatea curentului care traverseaza electrodul este:
![]() (19)
(19)
in care t+ este numarul de transport al cationilor Mz+.
Relatia (19) se poate scrie sub forma:
![]() (20)
(20)
in care t este suma numerelor de transport ale ionilor prezenti in solutia de electrolit, cu exceptia ionilor Mz+.
Densitatea maxima a curentului (curent limita) se obtine cand concentratia ionilor Mz+ la interfata este nula:
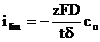 (21)
(21)
Pentru procesul global de electrod descrise de reactia (16) expresia suprapotentialului de transport este data de relatia:
![]()
care se poate scrie sub forma:
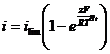 (23)
(23)
Pentru un proces de electrod dat de reactia:
O + ze- R (24)
expresia suprapotentialului de difuzie este data de relatia:
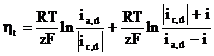
in care ia,d si ic,d sunt curentii limita de difuzie pentru procesul anodic, respectiv catodic.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |