Structura solidelor
Proprietatile unei substante sunt determinate de structura acesteia si de compozitia chimica. De vreme ce comportamentul chimic depinde esentialmente de structura dispozitiei interne a atomilor, toate proprietatile substantei pot fi atribuite structurii. Exista numeroase niveluri de structura. Aceste niveluri pot fi caracterizate in mod arbitrar ca fiind : moleculare sau atomice (0.1.1nm), de ordinul nanometrilor, ultrastructurale sau substructurale (1nm .1μm), microstructurale (1μm .1mm) si macrostructurale (>1mm). In cazul elementelor pure, aliajelor, ceramicelor si polimerilor, majoritatea caracteristicilor structurale sunt la nivel atomic/molecular. Substantele policristaline, precum metalele maleabile, sunt alcatuite din graunti/granule, care pot fi chiar de dimensiuni mari ; cu toate acestea, legaturile dintre granule sunt de natura atomica.
1 Legaturile atomice
Toate substantele solide sunt formate din atomi legati intre ei datorita interactiunii celor mai indepartati electroni (de valenta). Fortele de legatura dintre atomi sunt de natura electrica. Fortele de legatura sau de interactiune pot fi primare (puternice sau principale caracterizate prin energii mari de legatura intre atomi de la 1 la 10 eV/at: Legatura ionica sau heteropolara, Legatura covalenta sau homopolara, Legatura metalica) si secundare (slabe caracterizate prin energii mici de legatura intre atomi de la 0,01 la 0,1 eV/at: legatura de hidrogen si legatura van der Waals).
Cu toate ca legaturile au fost clasificate astfel, in realitate substantele pot prezenta combinatii ale caracteristicilor acestor legaturi. De exemplu, atomii de silicon impart electronii covalenti, dar o parte dintre acesti electroni pot fi eliberati si permit o conductivitate limitata (semiconductivitate). De aceea, siliconul prezinta atat caracteristici covalente, cat si metalice, asa cum se prezinta in Figura 3-1.
Rezistenta unor legaturi chimice vazuta din punct de vedere a temperaturii de vaporizare
Tabelul 3-1
|
Tipul legaturii |
Substanta |
Caldura specifica, kJ/mol |
|
van der Waals |
N2 | |
|
hidrogen |
fenol HF | |
|
metalica |
Na Fe | |
|
ionica |
NaCl MgO | |
|
covalenta |
diamant SiO2 |
IONICǍ
METALICǍ COVALENTǍ
Figura 3-1. Majoritatea substantelor prezinta o combinatie de diferite legaturi, facand dificil procesul de generalizare a legaturilor.
Structurile cristaline
2.1. Atomi de aceeasi marime
Dispunerea atomilor poate fi reprezentata grafic ca un aranjament de sfere grele, avandu-se in vedere pastrarea caracteristicii principale a acestora, si anume distantele echilibrate (lungimea legaturilor). Masurarea acestor distante se face cu ajutorul razelor X, care prezinta lungimi de unda scurte, de ordinul unui angstrom (Å =10-10m), apropiindu-se de raza atomului.
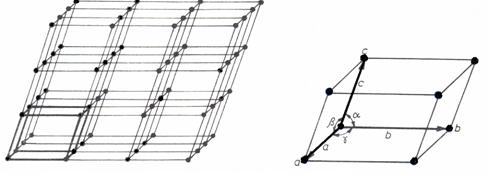
Aranjarea atomilor in reteaua cristalina a unui corp solid se face dupa reguli stricte caracteristice pentru fiecare metal sau aliaj. Reteaua cristalina este formata prin repetarea in spatiu a unor paralelipipede elementare aflate in contact si egale intre ele, Figura 3-2.a. Aceste paralelipipede poarta denumirea de celule elementare, care sunt definite de laturile si unghiurile paralelipipedului elementar, Figura 3-2.b.
a. b.
Figura 3-2. Reteaua cristalina (a) si celula elementara (b).
Sistemul cristalin se defineste prin parametrii celulei elementare. In functie de valoarea parametrilor exista sapte sisteme cristaline si 14 retele cristaline numite si retele Bravais, Tabelul 3-2.
Marea majoritate a metalelor cristalizeaza in unul din sistemele (1) cubic cu fete centrate (CFC), (2) cubic centrat (CC) sau cubic cu volum centrat (CVC) si (3) hexagonal compact (HC).
Structura cubica ale carei elemente sunt concentrate pe o latura a cubului (cfc), figura 3-3, se mai numeste si cu legaturi stranse (de fapt ar trebui sa se numeasca cu legaturile cele mai stranse) tridimensional.
Avand in vedere ca fiecare atom este in legatura cu 12 vecini (de unde si numarul de coordinatie CN = 12), si nu cu 6 atomi ca in cadrul structurii simple, structura rezultata este strans legata.
Sistemele si retelele cristaline
Tabelul 2.
|
Sistem cristalin |
Parametrii caracteristici |
Reteaua cristalina |
|
Cubic |
a = b = c; α = β = γ = 900 |
Simpla; cu volum centrat; cu fete centrate. |
|
Tetragonal |
a = b ≠ c; α = β = γ = 900 |
Simpla ; cu volum centrat. |
|
Ortorombic (Rombic) |
a ≠ b ≠ c; α = β = γ = 900 |
Simpla; cu volum centrat; cu baze centrate; cu fete centrate. |
|
Romboedric (trigonal) |
a = b = c; α = β = γ ≠ 900 |
Simpla. |
|
Hexagonal |
a = b ≠ c; α = β = 900, γ = 1200 |
Simpla. |
|
Monoclinic |
a ≠ b ≠ c; α = γ = 900 ≠ β |
Simpla ; cu baze centrate. |
|
Triclinic |
a ≠ b ≠ c; α ≠ β ≠ γ ≠ 900 |
Simpla. |
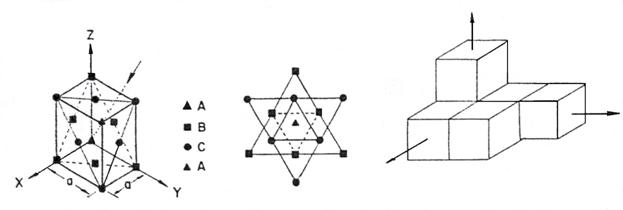
Vederea unei fete cubice Vedere plan diagonal al cubului
Figura 3- Structura cubica cu fete centrate.
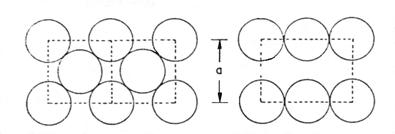
Un alt tip de structura cubica este cea centrata pe intreg corpul cubului ( cvc ) in cadrul careia un atom se afla in centrul cubului, ca in figura 3-4.
Aceasta structura se caracterizeaza printr-o eficienta a sistemului de legaturi mult mai mica (68%) decat cea a structurii cfc.
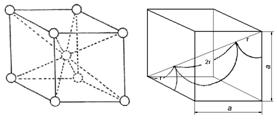

Figura 3-4. Structura cubica cu volum centrat. Diagonala cubului 4r = a/√
Structura hexagonala cu legaturi stranse ( hcp ) este formata din straturi repetitive din doua in doua sisteme de acest gen, adica atomii din al treilea strat se gasesc exact peste atomii din primul strat asa cum demonstreaza figura 3-5. Aceasta structura ar putea fi reprezentata ca ABAB. in timp ce structura cfc se poate schematiza sub forma a trei straturi ABCABC.Atat cfc cat si hc au aceelasi procentaj de eficienta (74%) din punct de vedere al legaturilor ; ambele structuri contin cele mai eficiente sisteme de legaturi atomice cu acelasi numar de coordinatie.
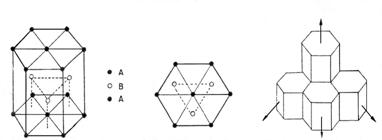
Figura 3-5. Structura hexagonala compacta, hc.
Exista cazuri cand unele metale cristalizeaza in sisteme diferite functie de temperatura. Aceasta temperatura poarta denumirea de temperatura critica, iar fenomenul poarta denumirea de alotropie si structurile, structuri alotropice.
Cateva exemple de structuri cristaline a unor substante reale sunt date in Tabelul 3-
Exemple de structuri cristaline
Tabelul 3-3
|
Substanta |
Structura cristalina |
|
Cr |
cvc |
|
Co - α - β |
hc (sub 417sC) cfc (peste 417sC) |
|
Fe Ferita ( Austenita ( Fier delta (δ) |
cvc (sub 912sC) cfc (912-1394sC) cvc (peste 1394sC) |
|
Sn - |
Tip diamant (sub 180C) Tetragonala centrata |
|
Mo |
cvc |
|
Ni |
cfc |
|
Ti |
hc (sub 900sC) cvc (peste 900sC) |
|
sare gema (NaCl) |
cfc |
|
Alumina (Al2O3) |
hc |
|
Polietilena |
ortorombic |
|
Poliizopren |
ortorombic |
Exemplul 3-1.
Fierul (Fe) are o structura cvc la temperatura camerei cu raza
atomica 1.24Å. Calculati-i densitatea (masa atomica a Fe = 55.85
g/mol).![]()
![]()
Raspuns:
Din figura 3-4, a=4r / √3 iar densitatea r este data de
![]()
SIMBOLURI DEFINITII
CN - numar de coordinatie.
Numarul de coordinatie - numarul de atomi la
distanta egala si cea mai mica de un atom dat. In
cazul sistemului cfc fiecare atom are 12 atomi vecini departati la
distanta a√2 ![]()
![]()
![]() 2 Atomi de marimi diferite
2 Atomi de marimi diferite
Pentru realizarea unui implant, se folosesc adesea substante pure. Majoritatea substantelor folosite pentru un implant sunt formate din mai mult de doua elemente. Atunci cand doi sau mai multi atomi de marimi diferite sunt alaturati intr-un solid, trebuie luati in considerare doi factori : (1) tipul structurii si (2) numarul structurii ocupate. Fie structura din Figura 3-6.a) si b) atomii interstitiali se ating de atomii mai mari si, cu toate acestea, sunt stabili, dar nu si in cazul c), unde acestia nu mai sunt stabili. Atingand o anumita valoare critica, atomul interstitial va ocupa spatiul dintre 6 atomi ( doar 4 atomi se pot vedea in reprezentarea bidimensionala), ceea ce va da nastere unor interactiuni maxime intre atomi si, deci, celei mai stabile structuri. De aceea, la o anumita valoare a razei primitorului si atomilor interstitiali, structura obtinuta va fi cea mai stabila.
a b c
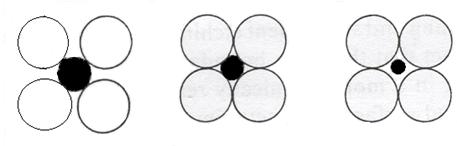
Stabil Stabil Instabil
Figura 3-6. Aranjamente posibile ale atomilor interstitiali.
Exemplul 3-2
Calculati valoarea minima a raportului razelor daca CN = 6, r - raza atomului interstitial, R - raza atomului structurii de baza.
Raspuns :
cos 45s = R / (R + r )
1/ √2 = R / (R+r)
√2R = R+r
r/R = √2 - 1 = 0.414
Imperfectiuni in structurile cristaline
Imperfectiunile in solidele cu structura cristalina sunt numite uneori defecte si joaca un rol major in stabilirea proprietatilor lor fizice.
Imperfectiunile reprezinta abateri de la aranjamentul ordonat al atomilor in reteaua cristalina. Ele pot fi clasificate dupa un criteriu geometric: imperfectiuni punctiforme - vacante, atomi interstitiali, imperfectiuni liniare - dislocatii si imperfectiuni plane (de suprafata sau bidimensionale) - limite de graunte, limita de subgraunte si defect de impachetare.
Volumul imperfectiunilor de retea in volumul materialului cristalin reprezinta o fractiune foarte mica. De exemplu, chiar in materialele puternic deformate proportia imperfectiunilor este mai mica de unu la mie. Totusi influenta lor asupra proprietatilor importante (ex. proprietatile de rezistenta si plasticitate) este foarte ridicata.
Astfel, proprietatile metalelor si aliajelor pot fi:
a. proprietati independente sau foarte putin dependente de structura: mecanice (constante elastice, densitae), termice (temperatura de topire, caldura specifica, conductibilitate termica, dilatare), magnetice (caracteristici de diamagnetism si paramagnetism), electrice (caracteristici termoelectrice), optice (putere de reflexie) si nucleare.
b. Proprietati dependente de structura sau sensibile la structura dar si de istoricul lor: proprietati mecanice de rezistenta si plasticitate si unele proprietati magnetice si electrice (caracteristici feromagnetice, rezistivitate electrica)
Imperfectiuni punctiforme apar adesea in structura sub forma unor spatii goale numite vacante (defect Schottky), unor atomi substitutionali si atomi interstitiali, Figura 3-7. Uneori un atom deplasat in pozitie interstitiala si vacanta asociata pe care o creeaza formeaza un defect complex numit defect Frenkel. Atomii substitutionali sau interstitiali sunt numiti uneori elemente de aliere daca au fost introduse intentionat, sau impuritati daca nu au fost introduse intentionat.
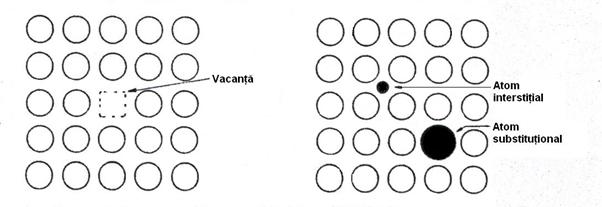
Figura 3-7. Defecte punctiforme in cristale.
Imperfectiuni liniare sunt create atunci cand un plan de atomi este mutat sau dislocat din structura lui obisnuita, Figura 3-8. Defectele liniare sau dislocatiile vor slabi foarte mult duritatea cristalului solid deoarece astfel ii trebuie mult mai putina energie pentru a se misca sau deforma o intreaga structura, plan cu plan si nu tot o data. La fel si daca prea multe dislocatii sunt introduse intr-o structura, atunci rezistenta solidului scade considerabil.
Explicatia ar fi urmatoarea : daca dislocatiile interactioneaxa atunci miscarea lor va fi impiedicata.
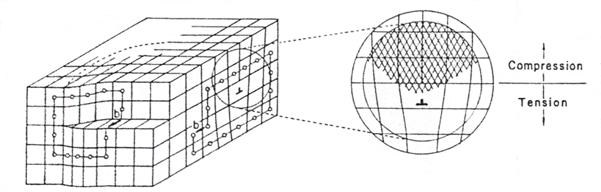
Figura
3-8. Defecte liniare (fata frontala a cristalului poseda o dislocatie elicoidala iar fata
laterala o dislocatie tip pana), ![]() - vector Burgers de inchidere a circuitului.
- vector Burgers de inchidere a circuitului.
Imperfectiunile plane (de suprafata) se localizeaza la marginile grauntilor (granule). Acestea apar, de regula, in materialele policristaline atunci cand doua sau mai multe cristale interactioneaza la margini ; acest lucru se intampla in timpul cristalizarii. La granitele dintre cristale, atomii formeaza o structura orientata specific care poarta denumirea de limite dintre graunti. Limitele dintre graunti au un aranjament de tranzitie cu un grad ridicat de dezordine, fiind o retea complexa de dislocatii si vacante. Limitele de subgraunte sunt limite intre granule a caror diferenta de orientare este foarte mica, de ordinul catorva grade. sublimite de graunti sunt limite aflate in interiorul grauntilor. Ele separa portiuni mici de retea perfecta numite blocuri de mozaic orientate la unghiuri relativ mici de ordinul minutelor, Figura 3-9. Blocurile in mozaic sunt separate deci de limite la unghiuri mici sau sublimite. Defectele de impachetare traseaza planul de separare dintre doua zone cristaline identice intre care s-a produs o anomalie a succesiunii normale a straturilor atomice. Aceste defecte apar la cristalele compacte (CFC, HC). Astfel la reteaua CFC cu succesiune ABCABC. se intercaleaza portiuni de retea HC cu succesiunea ABAB. : ABCABCABABC. Defectele de impachetare se produc prin cristalizare si prin deformare plastica.

a. b.
Figura 3-9. Structura in mozaic a unui cristal :
a - schema unei structuri in blocuri ; b - structura in blocuri a unui aliaj Fe-Ni, 50 000x.
Alte defecte de suprafata pot fi limitele de macle, peretii dintre domeniile magnetice, suprafetele dintre domeniul de antifaza etc.
SIMBOLURI DEFINITII
Atomi interstitiali - Atomi suplimentari in pozitie interstitiala.
Atomi de substitutie - sau de inlocuire, atomi de alta natura ce substituie atomii din retea.
Vacanta (defect Schottky) - atom absent dintr-un punct al retelei.
Defect Frenkel - Atom deplasat in pozitie interstitiala si vacanta asociata pe care o creeaza.
Dislocatie pana (marginala sau de tip Taylor) - consta intr-un sir de atomi ce au un atom vecin in minus (un plan cristalin incomplet sau un semiplan).
Dislocatie elicoidala (de tip Burgers) - sir de atomi in jurul caruia un plan cristalin normal se desfasoara in forma de spirala .
Limita de graunte - limita intre doua cristale (graunti) intr-un material policristalin.
Limita de subgraunte - limita dintre doua zone adiacente perfecte in acelasi cristal a carei diferenta de orientare este de ordinul catorva grade.
Sublimitele de graunti - sunt limite aflate in interiorul grauntilor care separa blocurile de mozaic orientate la unghiuri relativ mici de ordinul minutelor.
Compusi moleculari cu catene lungi (polimeri)
Polimerii contin catene lungi de molecule formate prin legaturi covalente de-a lungul lantului principal. Legaturile de-a lungul catenelor lungi sunt intarite fie prin legaturi secundare de tipul van der Waals si de hidrogen, fie prin legaturi primare covalente prin legaturi incrucisate intre catene. Catenele lungi sunt foarte flexibile si pot fi dezordonate cu usurinta. Structura partial cristalizata se numeste semicristalina , aceasta fiind structura comuna a polimerilor lineari. Structura semicristalina se caracterizeaza prin grupari noncristaline dezordonate si grupari cristaline ordonate, care pot contine catene incrucisate, Figura 3-10.
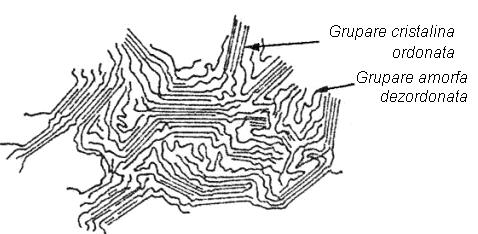
Figura 3-10. Modelul unui polimer liniar cu o structura semicristalina.
Gradul de polimerizare (DP) este unul dintre cei mai importanti parametri in determinarea proprietatilor polimerilor. DP se defineste ca fiind media unitatilor repetitive per molecula (mer), ex. catena. De aceea, avem de a face cu gradul mediu de polimerizare sau masa moleculara medie (M). Relatia dintre masa moleculara si gradul de polimerizare poate fi exprimat astfel :
M = DP × masa moleculara per mer (sau unitate repetitiva) (3-1)
Masa moleculara medie poate fi calculata in functie de masa fractionara (Wi) din fiecare masa fractionara moleculara (MWi) :
M = ( Σ Wi ∙ MWi ) / Σ Wi = Σ Wi . MWi (3-2)
in care Wi = 1.
Cu cat catenele moleculare devin mai lungi in urma continuarii procesului de polimerizare, scade si mobilitatea lor relativaExista trei moduri de aranjare a catenelor polimerice liniara, ramificata si in retea incrucisata sau tridimensionala ca in figura 3-11.
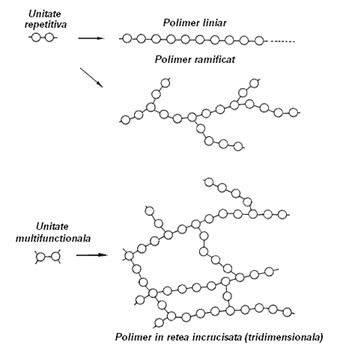
Figura 3-11. Tipuri de catene polimerice.
Polimerii lineari, precum polivinilii, poliamidele si poliesterii, sunt mult mai usor de cristalizat decat polimerii ramificati sau cei incrucisati. Cu toate acestea, nici acestia nu pot fi cristalizati 100% ca metalele, in schimb, ei devin polimeri semicristalini. Structura catenelor in grupari cristaline este o combinatie de catene incrucisate si extinse. Polimerii vinili contin o structura repetitiva -CH2-CHX-, in care X reprezinta o grupare monovalenta oarecare. Exista trei structuri posibile ale gruparii X : (1) atactica, (2) isotactica, (3) sindiotactica ca in figura 3-12. In structurile atactice aceste grupari se gasesc in pozitii alternative sau intr-una din marginile catenei principale.
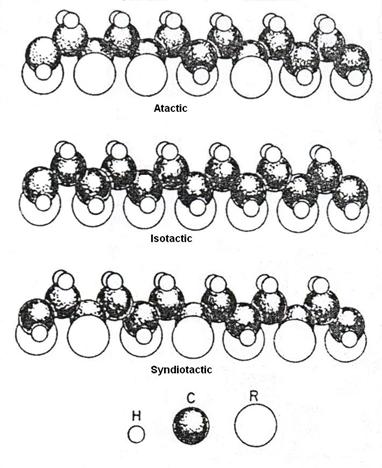
Figura 3-12. Tacticitatea polimerilor vinil.
Daca aceste grupari sunt mici ca polietilena (X = H) si catenele sunt liniare, polimerul cristalizeaza cu usurinta. Cu toate acestea, daca gruparile X sunt mari, precum clorura de polivinil (X = Cl) si polistirenul (X = C6H6), si sunt distribuite haotic de-a lungul catenelor (atactica), atunci se formeaza o structura noncristalina. De obicei, polimerii isotactici si sindiotactici cristalizeaza si atunci cand gruparile X sunt mari.
Copolimerizarea, in care doi sau mai multi homopolimeri (un fel de structura repetitiva de-a lungul structurii) formeaza compusi chimici, intotdeauna disturba regularitatea catenelor polimerice, ducand astfel la formarea structurilor noncristaline.
Elastomerii sau cauciucurile sunt polimeri cu o elasticitate puternica la temperatura camerei si pot reveni repede la dimensiunile originale in conditii normale. Elastomerii sunt polimeri noncristalini care prezinta o structura mediana formata din catene lungi moleculare in retele tridimensionale.
5. Structuri solide la temperaturi scazute
Unele solide cum ar fi sticla de geam nu au o structura cristalina regulata. Solidele cu o asemenea structura atomica se numesc substante amorfe sau noncristaline, Figura 3-1
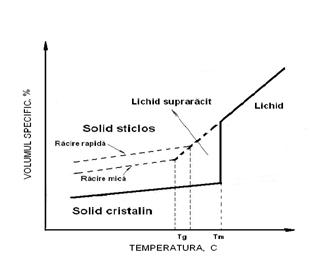
Figura 3-1 Variatia volumului cu temperatura solidului.
Temperatura de tranzitie a sticlelor (Tg) depinde de viteza de racire
si sub Tg materialul devine un solid ca sticla de cuart (mai corect: sticla de silice)
Structura retelei unui solid este tridimensionala si amorfa, datorita legaturilor restrictive si rigiditatii subunitatilor sale care le impiedica sa cristalizeze. Substante cu o structura comuna sunt polimerul fenolformaldehida (bachelita) si sticla de silice (SiO2) ca in Figura 3-14.
Exemplul 3-3
Calculati volumul ramas dupa ce 100g de iodura a fost racita din stare lichida, avand densitatea de 4.8 g/cm Presupuneti ca densitatea iodurii amorfe este de 4.3 g/cm3 iar densitatea cristalina de 4.93 g/cm
Raspuns :
Procentajul de iodura racita poate fi calculat prin extrapolare. Se considera densitatea proportionala cu cristalinitatea :
masa lichidului racit este 0.21 × 100mg = 21g ; de aceea, volumul total este:
(1/4.3 cm3/g - ¼.93 cm3/g ) × 21g = 0.65 cm3
dupa cristalizarea completa, volumul de iodura va scadea la 0.65 cm
6. Structura substantelor compozite
Substantele compuse sunt acelea care sunt formate din doua sau mai multe parti distincte. Termenul compus desemneaza de obicei acele substante in care proprietati ca elasticitatea sunt puternic alterate fata de cazul substantelor omogene. Astfel, oasele si fibrele de sticla sunt considerate substante compuse, pe cand aliaje neferoase, precum alama, sau aliajele metalice precum otelul cu particule de carburi, nu sunt. Cu toate ca substantele tehnice, incluse biomaterialele, nu sunt compusi, teoretic toate substantele naturale biologice sunt compuse.
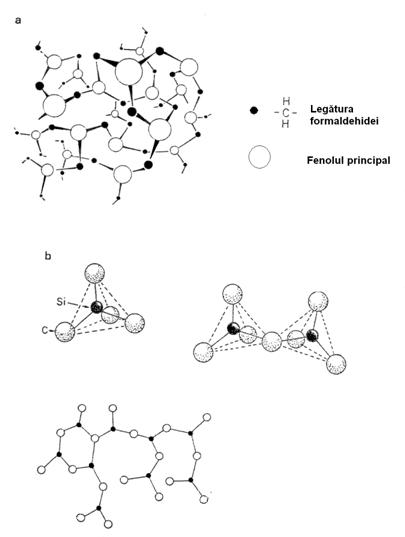
Figura 3-14. Structura solidelor amorfe : (a) fenolformaldehida (bachelita) ; (b) silice. Celula elementara pentru silice este un tetragon centrat cu un atom de siliciu.
Proprietatile substantelor compuse depind de forma eterogena (a doua stare a substantei), de volumul pe care il ocupa si de durittea si integritatea spatiului dintre constituenti. Neomogenitatilor dintr-o substanta compusa pot avea diferire forme, pe care le putem clasifica dupa cum urmeaza. Una dintre acestea este particula, formata din lanturi scurte ; fibra, cu un singur lant ; trombocitul sau lamela, cu doua lanturi.
Exemple de structuri complexe sunt compozitele dentare din Figura 3-18 care prezinta o structura aparte. Aceasta compozitie se introduce in cavitatea dentara cat este inca moale, iar dupa aceea se polimerizeaza in situ. Particulele de silice sunt folosite pentru a conferi duritate si rezistenta superioara compozitiei. Un exemplu tipic de solid fibros este aratat in figura 3 -19. Fibrele ajuta la intarirea si marirea rezistentei structurii polimerice. In acest exemplu, extragerea fibrelor in timpul fracturii absoarbe energie mecanica, marind rezistenta

Figura 3-18. Aliaj dentar tip compozit, / Boyer
Particulele de silice (SiO2) intr-o matrice polimerica.
materialului. Fibrele au fost adaugate fragmentelor polimerice in cazul protezelor totale de articulatii, in incercarea de a le imbunatati proprietatile mcanice. Figura 3-20 arata o structura laminata fibroasa, iar figura 3-21 arata materiale celulare sintetice reprezentative.
|
|
|
|
Figura 3-19. Compozit sticla-fibra-epoxy : extragerea fibrelor in timpul fracturii, /Agarwal |
Figura 3-20. Structura laminata fibroasa, / Agarwal |

Figura 3-21. Material celular sintetic (a) si natural (b), / Gibson
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |