
Concentratia ionilor de hidrogen sau pH-ul se defineste ca fiind logaritmul negativ al concentratiei ionilor de hidrogen dintr-o solutie, raportata la o cantitate de gramechivalent/litru. Deoarece pH-ul influenteaza reactiile in solutie, el are un rol deosebit de important in ciclul exogen. Pe masura ce solutiile au un caracter mai alcalin, vor fi favorizate procesele de oxidare.
S-a constatat ca valoarea pH-ului apelor naturale este cuprinsa intre 4 si 9. In Fig.2. este redata solubilitatea unora din cei mai importanti oxizi si hidroxizi raportata la pH.
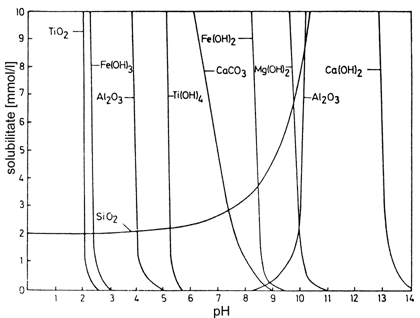
Fig.2.
Diagrama solubilitate / pH pentru cativa compusi
secundari rezultati prin alterare (Rösler & Lange, 1975)
Din diagrama se
observa ca in cadrul pH-ului 'normal' al apelor subterane,
Ca(OH)2 si Mg(OH)2 sunt complet solubili, pe cand
TiO2, Fe(OH)3 si Al2O3
raman insolubili si astfel nu pot fi mobilizati. Solubilitatea
silicei, de altfel scazuta, este relativ
Singurii componenti a caror mobilitate depinde de conditiile de pH sunt Ti(OH)4, Ca CO3 si Fe(OH)2. Totusi, in unele orizonturi din soluri bine drenate si bogate in materie organica, cum sunt podzolurile, pH-ul poate atinge valori sub 4. In aceste conditii, Al2O3 devine mobil si poate migra descendent spre zone mai putin acide unde au loc procese de imbogatire si precipitare.
Compusii oxigenati ai Fe3+ au o solubilitate foarte scazuta in conditiile de la suprafata crustei. Trecerea in solutie a Fe3+ are loc numai in medii puternic acide, pH<3 si oxidante.
Conform lui Loughnan (1962), ordinea pierderii constituentilor prin punerea lor in libertate in urma proceselor de alterare ar fi:
Ca2+ > Na+ > Mg2+ > K+ > SiO2 > Fe2O3 > Al2O3
Aceasta ordine ar corespunde cu cea obtinuta de Goldich (1938) si Bowen (1928) referitoare la succesiunea de alterare a unor roci, respectiv la succesiunea cristalizarii mineralelor dintr-o magma aflata in curs de racire. O particularitate interesanta in aceasta ordine ar fi pozitia aparent anormala a potasiului, insa aceasta ar putea fi explicata prin deosebita rezistenta la alterare a unor silicati cu K de tipul muscovitului.
Dupa cum s-a mentionat deja, cel mai important factor ce controleaza transformarile mineralelor primare si geneza produselor secundare este cantitatea de apa ce se infiltreaza si spala mediul prin care trece. Precipitatiile abundente si repetate tind sa indeparteze componentii solubili pusi in libertate de procesele de hidroliza de la suprafata mineralelor, permitand reactiilor de alterare sa se desfasoare complet. Constituentii solubili vor fi deplasati descendent, prin zona de alterare si in final, prin intermediul panzei freatice, vor ajunge in rauri, lacuri sau mari (oceane).
In cazul precipitatiilor abundente, a permeabilitatii si in timp, fara participarea proceselor erozionale, chiar si cele mai stabile minerale primare, de tipul cuartului, pot fi distruse, fiindca toate materialele au un anumit grad de solubilizare.
Mineralele se dizolva in apa diferentiat, in functie de compozitia chimica, structura reticulara, tipurile de legaturi din reteaua cristalina, temperatura, pH, continutul de CO2 si O2 din apa etc. Mineralele caracterizate prin legaturi ionice sunt mult mai solubile decat cele cu legaturi covalente, de aceea, ca ordine a solubilitatii, pe primul loc se afla clorurile, urmate de sulfati, carbonati si in final silicati. Solubilitatea silicatilor are la baza procesele de hidroliza si de schimb ionic, procese ce faciliteaza dizolvarea. Datorita valentelor nesatisfacute de la suprafata silicatilor, in contact cu apa are loc un schimb intre (OH)- din apa si oxigenul din tetraedrul Si-O-Si, cu formarea unor legaturi de tip Si-OH mai puternice decat Si-O. Schimbul de anioni precede dizolvarea propriu-zisa cand cationii metalici (Na+, K+, Ca2+, Mg2+ etc.) ies din retea si cedeaza locul ionilor H+ sau (OH)- simultan cu trecerea in solutie a cationilor solubili. Al3+ si Si4+ se vor redistribui in cadrul retelei alaturi de gruparile oxidril, formand germenii produselor reziduale rezultate prin alterarea silicatilor.
Solubilizarea aluminosilicatilor, mult mai lenta decat a silicatilor nealuminosi, conduce la indepartarea cationilor Na+, K+, Ca2+, Mg2+, la dizolvarea partiala a SiO2 si la formarea unor minerale noi (montmorillonit, illit, clorite, hidroxizi de Al si Fe, zeoliti, oxizi si hidroxizi de aluminiu).
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |