
UNIVERSITATEA VALAHIA TARGOVISTE
SPECIALIZAREA MASTER: CONTROLUL SI EXPERTIZA ALIMENTELOR
TEMA DE CASA
Analiza chimica a alimentelor prin conductometrie
Principiul metodei. Analiza conductometrica se bazeaza pe proprietatea solutiilor de electroliti de a conduce curentul electric
Notiunile utilizate in analiza conductometrica, unitatile lor de masura si relatiile dintre notiuni
a)
![]()
R - reprezinta rezistenta, exprimata in ohmi pe care o coloana de electrolit de lungime l [cm] si suprafata S [cm2] o opune la trecerea curentului electric.
![]() reprezinta
rezistenta specifica
reprezinta
rezistenta specifica
b)
![]()
C - reprezinta conductibilitatea electrica pentru solutia de electrolit
c)
![]() , reprezinta
constanta celulei conductometrice exprimata in [cm-1],
formata din placi confectionate din platina, dispuse la
distanta l [cm] si
avand suprafetele s [cm2].
, reprezinta
constanta celulei conductometrice exprimata in [cm-1],
formata din placi confectionate din platina, dispuse la
distanta l [cm] si
avand suprafetele s [cm2].
d)
![]() , reprezinta
conductivitatea specifica a solutiei de electrolit, avand
semnificatia densitatii ionilor dizolvati in unitatea de
volum de solutie.
, reprezinta
conductivitatea specifica a solutiei de electrolit, avand
semnificatia densitatii ionilor dizolvati in unitatea de
volum de solutie.
Pentru caracterizarea conductometrica a solutiei unui electrolit, trebuie sa se cunoasca valoarea constantei celulei conductometrice k cu care se efectueaza determinarile. Pentru aceasta se masoara valorile conductibilitatilor electrice C ale unor solutii de KCl de concentratie cunoscuta la o anumita temperatura, pentru a etalona aparatul.
Pentru
solutia apoasa de KCl, conductivitatea electrica specifica ![]() creste
liniar in intervalul 0 pana la 6 moli/litru.
creste
liniar in intervalul 0 pana la 6 moli/litru.
Pentru
ceilalti electroliti tari, valoarea ![]() creste
pana la o concentratie molara de 4 moli/litru, dupa care
incepe sa scada.
creste
pana la o concentratie molara de 4 moli/litru, dupa care
incepe sa scada.
Comportarea electrolitilor tari se explica prin faptul ca la valori ridicate ale concentratiei molare, ionii din solutie incep sa se asocieze intre ei, scazand numarul purtatorilor de sarcina electrica.
O
comportare similara se inregistreaza si pentru compararea ![]() a
electrolitilor slabi. Se observa ca in cazul electrolitilor
slabi, valoarea
a
electrolitilor slabi. Se observa ca in cazul electrolitilor
slabi, valoarea ![]() e mica in
comparatie cu aceeasi valoare care caracterizeaza
electrolitii tari. Diferenta de comportare se datoreaza faptului
ca electrolitii slabi sunt partial disociati la dizolvare.
e mica in
comparatie cu aceeasi valoare care caracterizeaza
electrolitii tari. Diferenta de comportare se datoreaza faptului
ca electrolitii slabi sunt partial disociati la dizolvare.
Conductivitatea
electrica specifica (![]() ) mai mare a acizilor in comparatie cu bazele se
datoreaza mobilitatii ionice mai ridicate a ionului pozitiv de
hidrogen: H (proton) in comparatie cu ionul de K+
sau
) mai mare a acizilor in comparatie cu bazele se
datoreaza mobilitatii ionice mai ridicate a ionului pozitiv de
hidrogen: H (proton) in comparatie cu ionul de K+
sau ![]() .
.
e)
![]() , reprezinta
conductibilitatea echivalenta a unei solutii de electrolit
caracterizata de conductivitatea specifica
, reprezinta
conductibilitatea echivalenta a unei solutii de electrolit
caracterizata de conductivitatea specifica ![]() si de
concentratia normala C.
si de
concentratia normala C.
Avand
in vedere ca valoarea lui Cn este invers
proportionala cu volumul si tinand cont de unitatea de
masura a ![]() si a
volumului, unitatea de masura pentru
si a
volumului, unitatea de masura pentru ![]() este :
este :
![]()
Pentru
o solutie ideala, valoarea ![]() este independenta
de concentratie. O solutie ideala este solutia in care
ionii rezultati din disocierea electrolitului nu interactioneaza
electrostatic intre ei. Pentru a deosebi intre ei electrolitii care au o
comportare reala (si se abat de la idealitate) a fost introdusa
notiunea de conductibilitate electrica la dilutie infinita:
este independenta
de concentratie. O solutie ideala este solutia in care
ionii rezultati din disocierea electrolitului nu interactioneaza
electrostatic intre ei. Pentru a deosebi intre ei electrolitii care au o
comportare reala (si se abat de la idealitate) a fost introdusa
notiunea de conductibilitate electrica la dilutie infinita:
![]() reprezentand o
marime specifica a fiecarui electrolit prin extrapolare,
reprezentand grafic
reprezentand o
marime specifica a fiecarui electrolit prin extrapolare,
reprezentand grafic ![]() in functie
de concentratie.
in functie
de concentratie.
Se
obtine o curba care pentru
valori din ce in ce mai mici ale concentratiei devine asimptota la
axa ordonatei. Prin extrapolarea curbei se afla valoarea ![]() .
.
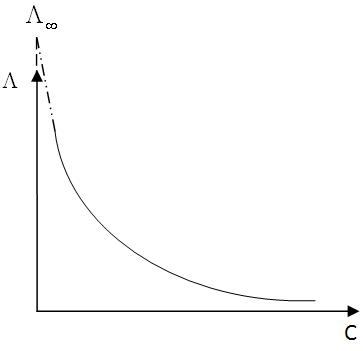
![]() si
si ![]() se afla cu relatia:
se afla cu relatia:
![]() , unde A reprezinta o constanta
caracteristica fiecarui electrolit, iar C reprezinta valoarea
concentratiei normale.
, unde A reprezinta o constanta
caracteristica fiecarui electrolit, iar C reprezinta valoarea
concentratiei normale.
Pentru
electrolit ideal, ![]() functie de
functie de ![]() :
:
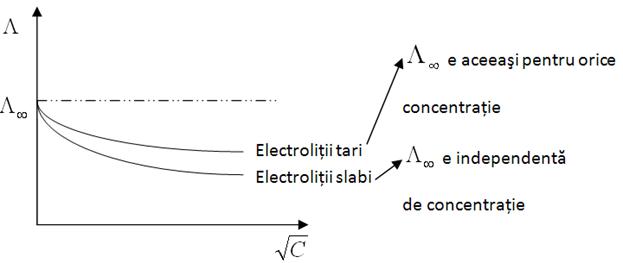
Pentru
electrolitii tari si pentru cei slabi, dependenta ![]() ,
,![]() este exponentiala. Aceste diferente de
comportare pot fi puse foarte usor in evidenta masurand
valoarea conductibilitatii specifice a unor solutii de
electrolit care au aceeasi concentratie normala. Se observa
intotdeauna ca electrolitii slabi genereaza solutii cu
valori mai coborate ale conductibilitatii specifice, respectiv ale
conductibilitatii echivalente.
este exponentiala. Aceste diferente de
comportare pot fi puse foarte usor in evidenta masurand
valoarea conductibilitatii specifice a unor solutii de
electrolit care au aceeasi concentratie normala. Se observa
intotdeauna ca electrolitii slabi genereaza solutii cu
valori mai coborate ale conductibilitatii specifice, respectiv ale
conductibilitatii echivalente.
Valorile
conductibilitatilor electrice au diverse aplicatii practice
si teoretice. Prin valorile electrice se pot determina valorile pentru
gradul de disociere ![]() la un electrolit
definit ca raportul dintre conductibilitatea lui echivalenta la o
anumita concentratie C si conductibilitatea lui echivalenta
la o dilutie infinita.
la un electrolit
definit ca raportul dintre conductibilitatea lui echivalenta la o
anumita concentratie C si conductibilitatea lui echivalenta
la o dilutie infinita.
![]()
Valorile ![]() sunt tabelate.
sunt tabelate.
Utilizare
Datorita capacitatii informationale foarte ridicate si a simplitatii instalatiei de analiza conductometrica aceasta metoda este utilizata pentru a descrie comportarea substantelor pure sau in amestec si pentru determinarea concentratiei acestora.
Astfel, conductometria poate fi utilizata pentru:
masurarea PH-ului,
masurarea conductibilitatii electrice a unor electroliti,
masurarea valorii produsului de solubilitate a unui electrolit univalent,
determinarea mineralitatii unei solutii (mineralitatea - reprezinta cantitatea de substante ionice dizolvate pentru 1 litru de solutie exprimata in miligrame/litru sau micrograme/mililitru),
determinarea gradului si constantei de disociere s unui electrolit slab,
titrarea conductometrica
Aparatele utilizate in conductometrie sunt conductometrele; acestea prezinta celule electrice de conductibilitate confectionate din material plastic sau sticla care protejeaza o suprafata de platina sau iridiu, ce reprezinta partea activa care intra in contact cu solutia de analizat. Impulsurile electrice generate sunt captate de sisteme electronice de masurare.
Conductometrele pot functiona pe doua principii:
pe baza de punte Wheatstone,
pe baza de circuite electronice integrate.
Titrarea conductometrica ofera posibilitatea stabilirii volumului de echivalenta la titrare in functie de valoarea conductibilitatii electrice a probei de analizat si de evolutia valorii acesteia in functie de volumul de reactiv adaugat.
Instalatia pentru titrarea conductometrica este formata din:
biureta cu agent titrant,
agitator magnetic care are rolul ca prin rotire sa omogenizeze solutia din paharul de titrare
celula de conductibilitate care e imersata complet in proba de analizat si cuplata la conductometru prin intermediul unui conductor
In pahar se introduce proba de analizat si se dilueaza cu solvent pana in momentul in care celula de conductibilitate e complet imersata in proba.
Determinarea experimentala presupune urmarirea evolutiei valorii conductibilitatii electrice a probei in functie de volumul de agent titrant care se adauga. Pentru stabilirea exacta a valorii volumului de echivalenta se inregistreaza intr-un tabel valoarea conductibilitatii in µs in functie de volumul masurat de agentul titrant (ml).
Agentul titrant se adauga in volume egale la intervale egale de timp astfel incat sa se poata citi exact valoarea conductibilitatii solutiei din pahar dupa fiecare volum de agent titrant adaugat.
|
V (ml) |
V1 |
V2 |
V3 |
Vn |
||
|
C (µs) |
C0 |
C1 |
C2 |
C3 |
Cn |
Valorile conductibilitatii se reprezinta grafic intr-un sistem de axe de coordonate in functie de valorile corespunzatoare ale volumului de agent titrant adaugat.
Titrarea unui acid tare cu o baza tare:
HCl
cu NaOH: ![]()
Avand
in vedere ca mobilitatea ionica a ![]() e cu mult mai mare decat mobilitatea
e cu mult mai mare decat mobilitatea ![]() , valoarea conductibilitatii electrice scade
pana la volumul de echivalenta.
, valoarea conductibilitatii electrice scade
pana la volumul de echivalenta.
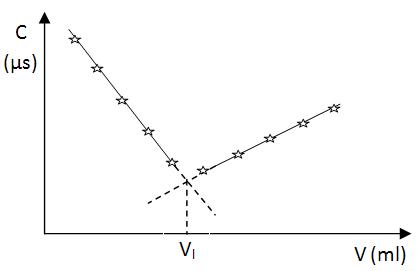
Dupa volumul de echivalenta, conductibilitatea incepe sa creasca datorita excesului de ion de Na . Cresterea concentratiei e mai mica datorita mobilitatii ionice mai mici a ionilor de sodium.
Daca titrarea se desfasoara astfel incat avem suficient de multe puncte in plan inainte de volumul de echivalenta se poate trasa o dreapta descendenta care reprezinta evolutia valorii conductibilitatii electrice a probei inainte de volumul de echivalenta. Daca avem suficient de multe valoriale volumului de agent titrant adaugat dupa volumul de echivalenta, se poate trasa o dreapta cu panta pozitiva care evidentiaza evolutia valorii conductibilitatii electrice a probei dupa volumul de echivalenta. Prelungind cele doua drepte, de la intersectia lor se coboara perpendicular o linie de ordine pana la axa volumelor unde se citeste direct valoarea volumului de echivalenta corespunzatoare volumului de acid titrant.
Acest tip de titrare este avantajoasa fata de titrarea cu indicatori pentru cazul lichidelor colorate unde nu se mai poate utiliza un indicator de viraj al culorii.
Aceasta metoda poate fi utilizata de exemplu pentru determinarea continutului de cenusa din zahar.
Determinarea continutului de cenusa din zaharul cristal:
2.2 Determinarea continutului de cenusa
Continutul de cenusa reprezinta o caracteristica de calitate
foarte importanta pentru mai multe produse alimentare, dar mai
ales pentru cele de origine vegetala.
Cenusa exprima continutul procentual de substante minerale
si impuritati minerale dintr-un produs.
Determinarea cenusii se efectueaza in mod obisnuit prin
calcinarea probei in conditii stabilite, prin metoda lenta la
550 - 650°C (metoda de referinta) si metoda rapida la 900 - 920°C.
. Principiul metodei: determinarea reziduului rezultat
prin calcinarea probei de analizat.
. Aparatura:
-dispozitiv de calcinare
-bec de gaz;
-trepied metalic;
-cuptor electric;
-placa termorezistenta;
-exicator;
-balanta analitica.
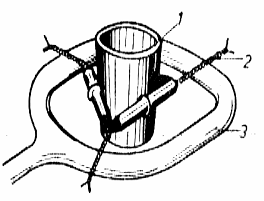
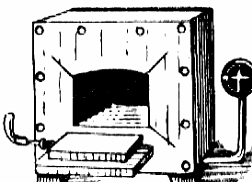
Fig. nr. 2.2 Dispozitiv de calcinare:
1-creuzet; 2-triunghi de samota;
3-inel
Fig. nr. 2.3 Cuptor electric
Marfuri alimentare
. Mod de lucru:
Intr-un creuzet de portelan (calcinat in prealabil la 550°C,
pana la masa
strat cat mai uniform, cantarita cu precizie de 0,0002 g, la balanta
analitica.
Pentru inceput, creuzetul se aseaza pe un triunghi de
portelan si se arde lent continutul la flacara unui bec de gaz (in
nisa), pana la totala disparitie a fumului. Se introduce apoi
creuzetul in cuptorul electric incalzit in prealabil la 550650°C.
Dupa 1 ora de calcinare, creuzetul se scoate pe o placa
termorezistenta si se umecteaza portiunile negre ale probei cu 23
picaturi de apa distilata. Umectarea provoaca dizolvarea cenusii sau
topiturii din jurul particulelor de carbune nears, permitand oxidarea
completa, dupa reluarea calcinarii. Dupa evaporarea apei, se
reintroduce proba in cuptor si se continua calcinarea cca. 6 ore,
pana la obtinerea unui reziduu de culoare alba sau cenusie deschisa,
fara urme de carbune.
Creuzetul calcinat se raceste in exicator pana la temperatura
camerei (max. 2 ore) si apoi se cantareste. Se repeta operatiile de
calcinare, racire si cantarire pana la obtinerea unei mase constante
(diferenta dintre doua cantariri succesive nu este mai mare de
0,0002 g).
Calcinarile urmatoare se efectueaza timp de o jumatate de
ora. Cu cat diferenta dintre doua cantariri succesive este mai mica
cu atat durata calcinarii va fi mai mica.
Rezultatul se exprima procentual, cu doua zecimale.
Determinarea se efectueaza asupra a doua probe, in paralel, in
aceleasi conditii.
Continutul de cenusa, % = (m1/m)x100, in care:
m = masa reziduului obtinut prin calcinare, in g;
m1 = masa probei de analizat, in g.
In cazul metodei rapide, creuzetul cu proba de analizat se
introduce in cuptorul electric termoreglat la 900-920°C
calcinandu-se 2 ore, dupa care se cantareste.
Marfuri alimentare
Continutul de cenusa se calculeaza dupa aceeasi formula.
In standardele referitoare la produsele alimentare cenusa se
exprima sub forma de:
Cenusa totala: substante minerale + impuritati;
Cenusa neta: substante minerale;
Cenusa insolubila in HCl 10%: impuritati minerale,
in special oxizii de siliciu si silicatii (aceasta
caracterizeaza gradul de impurificare cu nisip,
pamant, pietris - impuritati provenite de la materiile
prime vegetale spalate necorespunzator).
Prezentam in continuare cateva exemple din standardele de produs:
|
PRODUS |
CENUSA TOTALA % MAX. |
CENUSA INSOLUBILA IN HCl 10% MAX. |
STANDARD |
|
PINE ALBA |
- |
0,2 |
SR 878/1996 |
|
CAFEA BOABE PRAJITA |
4,5 calitatea I calitatea II |
- |
SR 13916/1995 |
|
CIOCOLATA SIMPLA |
2 |
- |
SR 6862/1995 |
|
ZAHAR CRISTAL |
0,03 |
- |
SR 11/1995 |
|
BOMBOANE STICLOASE NEUMPLUTE |
- |
0,1 |
SR 1841/1998 |
BIBLIOGRAFIA:
Ioan Sas - Analize fizico-chimice si controlul calitatii produselor, Univ. Galati 1985.
Ioan Sas - Analize fizico-chimice si controlul calitatii produselor - Indrumar de laborator, Univ. Galati 1989.
Kekedy Ladislau - Analiza fizico-chimica, Ed. Fizica si Pedagogica, Bucuresti 1969.
Al. Duca, C. Luca, I. Al. Crisan - Chimia analitica si analiza instrumentala, Ed. Didactica si Pedagogica, Bucuresti 1983.
Iuliu Pogany, Mircea Banciu - Heterofizice in chimia organica, Ed. Stiintifica, Bucuresti 1972.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |