Chimia mediului acvatic
Respandirea apei pe pamant
Apa este substanta cea mai raspandita de pe Terra. Totalitatea formelor de apa constituie Hidrosfera, care este constituita dintr-un ansamblu de 5 rezervoare naturale interconectate:
- Ape de suprafata (oceane, mari, lacuri etc);
- Depozite de gheata si de zapada (calotele polare);
- Apa subterana (apa/"panza" freatica);
- Apa atmosferica;
- Apa biologica (plante si animale).
Volumul hidrosferei este estimat la aproximativ 1380 106 km3 (1,38 miliarde km3), din care peste 97% este apa sarata (Tab1).
Tabel 1. Repartitia apei pe glob
|
Rezervoarele Hidrosferei |
Volum, km3 |
% |
|
Oceane si lacuri sarate | ||
|
Ghetari si suprafete inzapezite |
27. 820.000 | |
|
Panza apa freatica (umiditate sol) |
8.062.000 | |
|
Lacuri , fluvii rauri |
225.000 | |
|
Apa atmosferica |
13.000 | |
|
TOTAL (din care apa dulce) |
(36.120.000) |
Apa este elementul de baza al materiei vii (80% din compozitie):
- in plante - 60-80%;
- in animale superioare- intre 60-70%;
- in organisme marine (meduze, alge etc) - 98%;
- in bacterii - 50%.
Intre rezervoarele hidrosferei exista o circulatie perpetua, numita "Ciclul apei in natura" (Figurile 1 si 2). Acest ciclu este constituit in principal din 2 parti:
Partea atmosferica, sub forma de vapori de apa.
Partea terestra, reprezentand curgerea si stocarea apelor pe pamant si in oceane.
Figurile 1 si 2
Structura apei. Starile de agregare ale apei.
Molecula de apa este constituita din 1 atom de oxigen si 2 atomi de hidrogen. Intre acesti atomi se formeaza 2 legaturi covalente polare(Fig 3):
Datorita polaritatii legaturii, atomii de hidrogen au o sarcina partial pozitiva.
Datorita prezentei a 2 perechi de electroni neparticipanti la atonul de oxigen din molecula de apa, intre acest atom si un atom de hidrogen al unei molecule vecine se realizeaza legatura intermoleculara numita "Legarura de hidrogen".
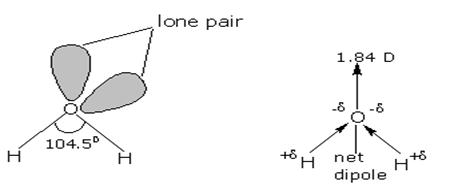
Fig 3 Atomul de Oxigen cu 6 electroni Structura moleculei de apa (covalente- de valenta (1s2 2s2 2p4) si hibridizeaza sp3 0.96A.
Legaturile de Hidrogen (Fig 4) determina existenta apei in 2 stari condensate:
Apa lichida, in care se realizeaza asocierea a 2-6 molecule de apa.
Apa solida (gheata, zapada), in care se realizeaza asocierea unui numar f mare de molecule de apa. Elementul structural consta dintr-o molecula centrala si 4 molecule periferice legate sub forma unui tetraedru ("stelutele de gheata"). Aceste grupe teraedrice se leaga la randul lor intr-o retea vasta de simetrie hexagonala, compacta in cazul ghetii (Fig. 5).
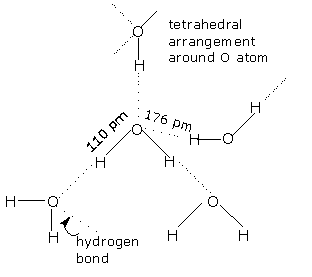
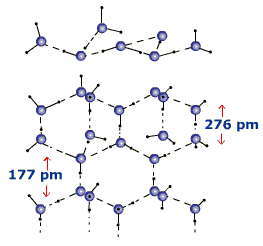
Fig. 4. Asocierea moleculei de Fig. 5 - Structura hexagonala a ghetii
apa prin legaturi de hidrogen
In apa solida, unghiurile de valenta sunt largite la 109,5o , iar covalentele sunt lungite la 0,99A. Distantele O.O sunt de 2,76A. Aceasta structura "afanata" face ca densitatea ghetii sa fie mai mica decat cea a apei si gheata sa pluteasca pe apa.
Apa lichida contine "fragmente" de grupe teraedrice si de asociatii hexagonale, care duc la aranjamente mai compacte si deci la o densitate mai mare ca a ghetii. De aceea la topire se produce o variatie (crestere) brusca a densitatii la 0oC, urmata e o crestere mai lenta pana la 4oC, cand este atins un maxim. Peste aceasta valoare se produce o scadere monotona a densitatii.
La topire se rup:
legaturi de hidrogen , la 0oC;
legaturi de hidrogen, la 40oC;
legaturi de hidrogen, la 100oC.
Domeniile de existenta ale celor 3 stari de agregare ale apei sunt definite de diagrama de stare (faze) a apei (Fig. 6). Curbele din diagrama delimiteaza cele 3 faze posibile ale apei :Solid-Lichid-Vapori
peste 0oC, gheata se topeste si trece in apa lichida (TOPIRE);
peste 100oC, apa lichida trece in vapori (EVAPORARE);
Trecerea directa a ghetii in stare de vapori (SUBLIMARE) are loc numai cu modificarea presiunii.
Punctul in care coexista apa in cele 3 stari de agregare se numeste PUNCTUL TRIPLU: T=0,01oC si P= 4,6 Torr.
Pe curbe pot coexista cate 2 faze in Fig. 6 Diagrama de stare a apei
echilibru.
In natura, echilibrul intre cele 3 stari de agregare a apei este instabil si dinamic. Perioadele de stationare pe Tera ale diferitelor forme ale apei sunt:
Ghetarii si zapezile din calotele polare : 9000-10000 ani;
Oceanul planetar: 2000-3000 ani;
Apele supterane:1000-15000 ani;
Apele lacurilor: 17 ani;
Apa din sol: 1 an;
Apa raurilor: 15-20 zile;
Apa atmosferica : 9 zile;
Apa biologica: cateva ore.
Compozitia chimica a apei
Apa naturala contine diverse impuritati solubile (solide, lichide si gazoase) precum si particule insolubile de diferite dimensiuni (coloidale, in suspensie, sedimentabile). Apa naturala este de fapt un sistem dispers complex avand ca mediu de dispersie o solutie apoasa.
Oxigenul dizolvat in apa este rezultatul unui echilibru dinamic intre 2 grupe de procese:
- procese care genereaza O2 in apa, dizolvarea oxigenului din aer si fotosinteza plantelor subacvatice respiratia organismelor acvatice, procese biochimice de degradare a substantelor organice, procese geochimice de dizolvare a solului si rocilor.
- procese care reduc cantitatea de O2, degradarea biochimica a substantelor organice din apa, sau oxidarea unor minerale (Fe, Mn).
Dioxidul de carbon dizolvat in apa este rezultatul unui echilibru dinamic intre 2 grupe de procese:
procese care genereaza CO2 in apa, respiratia organismelor acvatice, procese biochimice de degradare a substantelor organice, procese geochimice de dizolvare a solului si rocilor.
- procese care reduc cantitatea de CO2, trecerea in aer, fotosinteza organismelor acvatice.
Hidrogenul sulfurat se intalneste in special in apele subacvatice, in zonele cu zacaminte de sulf.
Solubilitatea gazelor in apa
Legea lui Henry - concentratia (fractia molara, xa) O2 dizolvat in apa este direct proportionala cu presiune partiala a O2 in aer (pa), kH(atm-1) - constanta Henry: pa= kH xa.
Legea lui Henry este valabila numai pentru gaze greu solubile (H2, N2, O2) care formeaza solutii fizice, care nu reactioneaza chimic cu apa. Ea nu se aplica unor gaze ca CO2, NH3, SO2 care formeaza combinatii chimice cu apa:
CO2 + H2O = H2CO3
SO2 + H2O= H2SO4
NH3 + H2O = NH4OH
Solubilitatea gazelor in apa se exprima prin constanta Henry si prin coeficientul de solubilitate = cantitatea/volumul de gaz dizolvat in 1 l apa la presiunea de 1 atm si o temperatura data.
Tabel. Coeficientii de absorbtie a unor gaze in apa(l gaz/l apa)
|
T |
H2 |
N2 |
O2 |
CO2 |
NH3 |
|
0oC 30oC |
8,6 (100oC) |
Gazele dizolvate fizic (inclusiv O2) sunt eliminate din solutie prin fierbere.
Gazele dizolvate chimic (CO2, NH3, SO2) care formeaza cu apa combinatii usor disociabile sunt eliminate din solutie daca se trece prin aceasta un current de gaz greu solubil (de ex. N2)).
Solubilitatea gazelor in lichide scade cu cresterea temperaturii. In concuzie, vara cantitatea de O2 din ape este mai mica decat in perioadele reci.
Volumul total al aerului dizolvat in 1 l apa la 0oC si 1 atm este:
- azot: 1000 x o,23 x 0,78 = 17,94 ml = 62,4%
- oxigen : 1000 x 0,049 x 0,21 = 10,29 ml = 35,8%
- argon: 1000 x 0,053 x 0,01 = 0,53 ml = 1,8%
Volumul gazului dizolvat = 28,76 ml
Din aceste calcule se observa ca solubilitatea oxigenului in aer este mult mai mare decat cea corespunzatoare legii lui Henry (pt solutii ideale), ceea ce este important pentru vietuitoarele acvatice.
Substantele minerale dizolvate in apele naturale contin in principal Ca2+, Na+, K+, Mg2+ dar si Mn2+, Cd2+, Ni2+, Co2+, Li+, Ba2+ si anionii Cl-, SO42-, CO32-, I-, F-.
Functie de gradul de mineralizare ( = Cantitatea totala de saruri dizolvate in 1 l apa), apele naturale se impart in:
ape slab mineralizate, <500 mg saruri/l apa;
ape mineralizate, 500 -1000 mg saruri/l apa;
ape puternic mineralizate > 1000 mg saruri/l apa.
Functie de substanta minerala dizolvata in cantitate majoritara, se intalnesc ape clorurate, ape sulfurate, ape bicarbonatate (calcice, magneziene, sodice).
Apele subterane sunt mai puternic mineralizate decat cele de suprafata. In cazul apelor de suprafata (curgatoare), gradul de mineralizare creste de la munte la ses, de la debite mici la debite mari.
Substante organice dizolvate - sunt produse de metabolism (cetone) a unor organisme acvatice sau provin din descompunerea unor organisme acvatice animale si vegetale din solurile spalate de apa. Cetonele sunt incolore, formeaza solutii reale cu in apa si dau acesteea un miros neplacut. In special zonele de turba si balti contin concentratie ridicata de substante organice. Apele naturale dizolva partial substantele organice din solurile humice.
Substantele organice in:
- in apele de adancime: 2-3 mg/l
- in apele freatice: 3-4 mg/l;
- in lacuri: 5-8 mg/l apa
- in balti: pana la 400mg/l.
Apele care strabat zonele petrolifere si carbonifere contin o mare incarcatura de substanta organice, exprimata ca CBO5 (consumul de oxigen pt degradarea substantelor organice la 5 zile).
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |